- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок 67 Строение атома и атомного ядра
Содержание
- 1. Урок 67 Строение атома и атомного ядра
- 2. Как развивалось учение о строении атома?Строение атома Дж. Дж. ТомсонаОпыт РезерфордаПланетарная модель РезерфордаКвантовые постулаты Бора
- 3. Атом по теории древних ученых Слово
- 4. Атом – сложная частицаОткрытия конца XIX, начала
- 5. Представление о неделимости атома
- 6. Теории строения атомаГипотеза Дж.Томсона 1904 г. «Сливовый
- 7. Дж.Дж. Томсон Английский физик,
- 8. Строение атома по представлениям Томсона В 1903
- 9. Почему модель Томсона нуждалась в проверке?
- 10. Схема опыта РезерфордаОсновная идея опыта:Узкий пучек а-частиц,
- 11. Чем же объяснить рассеяние а-частиц при прохождении
- 12. Модель Резерфорда Планетарная модель атома,
- 13. Как же устроен атом?Проанализировав результаты опытов, Резерфорд
- 14. Как Нильс Бор помог Резерфорду?В 1913 году
- 15. Почему атомы излучают?Согласно постулатам Бора
- 16. На пороге квантовой механики Выбранный Нильсом Бором
- 17. ЛитератураФизика для всех / Купер Л.- «Мир»1974гФизики
Слайд 2Как развивалось учение о строении атома?
Строение атома Дж. Дж. Томсона
Опыт Резерфорда
Планетарная
Квантовые постулаты Бора
Слайд 3Атом по теории древних ученых
Слово «атом» по - гречески
Слайд 4Атом – сложная частица
Открытия конца XIX, начала XX века.
Дж.Томсон,
1897 г.
А.Г.Столетов 1889 г. – явление фотоэффекта
Э.Резерфорд 1889-1900 г. – природа a-частиц
А.Беккерель. М.,Складовская-Кюри,
1896-1900г. – радиоактивность химических элементов.
Электрон(e)
Нейтрон(n)
Протон(p)
-
+
Слайд 5 Представление о неделимости атома утверждалось в физике почти
Перед учеными возникли важнейшие вопросы:
Как построен атом?
Что представляют собой отдельные части атома?
Как они взаимно расположены?
Слайд 6Теории строения атома
Гипотеза Дж.Томсона 1904 г. «Сливовый пудинг»
Планетарная модель атома Э.Резерфорда
Квантовые постулаты Н. Бора
1. Е=0
2. Е>0
е
е
е
е
е
е
е
Слайд 7Дж.Дж. Томсон
Английский физик, член Лондонского королевского общества.
Слайд 8Строение атома по представлениям Томсона
В 1903 г. Томсон предложил модель
Каждый электрон может совершать колебательные движения около своего положения равновесия.
Положительный заряд шара равен по модулю отрицательному заряду электронов.
Поэтому электрический заряд атома в целом равен нулю.:
Слайд 9Почему модель Томсона нуждалась в проверке?
Модель строения атома,
Поэтому в 1911 году Эрнест Резерфорд провел ряд опытов по исследованию состава и строения атомов
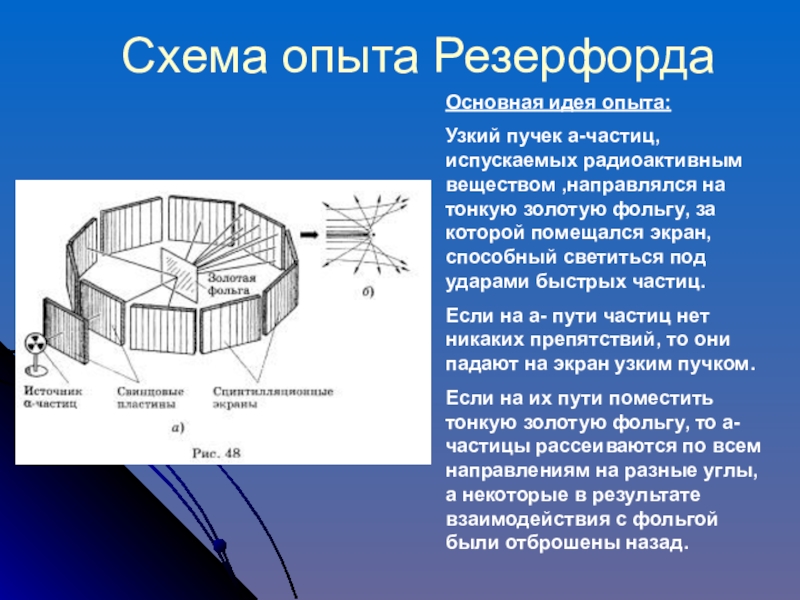
Слайд 10Схема опыта Резерфорда
Основная идея опыта:
Узкий пучек а-частиц, испускаемых радиоактивным веществом ,направлялся
Если на а- пути частиц нет никаких препятствий, то они падают на экран узким пучком.
Если на их пути поместить тонкую золотую фольгу, то а-частицы рассеиваются по всем направлениям на разные углы, а некоторые в результате взаимодействия с фольгой были отброшены назад.
Слайд 11Чем же объяснить рассеяние а-частиц при прохождении ими вещества?
Напряженность(E) создаваемого ядром
Поскольку диаметр ядра значительно меньше диаметра атома, то большая часть из числа всех а-частиц проходит сквозь атом на таких расстояниях от ядра где сила отталкивания создаваемого им поля слишком мала, чтобы существенно изменить направление движения а-частиц. И только очень немногие частицы пролетают рядом с ядром, т. е. в области сильного поля, и отклоняются на большие углы.
Слайд 12Модель Резерфорда
Планетарная модель атома, предложенная Резерфордом, – это
Слайд 13Как же устроен атом?
Проанализировав результаты опытов, Резерфорд в 1911 году предложил
Атом состоит из положительно заряженного ядра, которое занимает ничтожно малый объем атома. Вокруг ядра расположены электроны.
Электроны вращаются вокруг ядра на достаточно больших расстояниях от него. Совокупность этих электронов называют электронной оболочкой.
Таким образом, Атом представляется в виде планетной системы в маленьком масштабе(поэтому такую модель назвали планетарной)
Слайд 14Как Нильс Бор помог Резерфорду?
В 1913 году датский физик Нильс Бор
Нильс Бор применил свои постулаты для простейшей атомной системы – атома водорода.
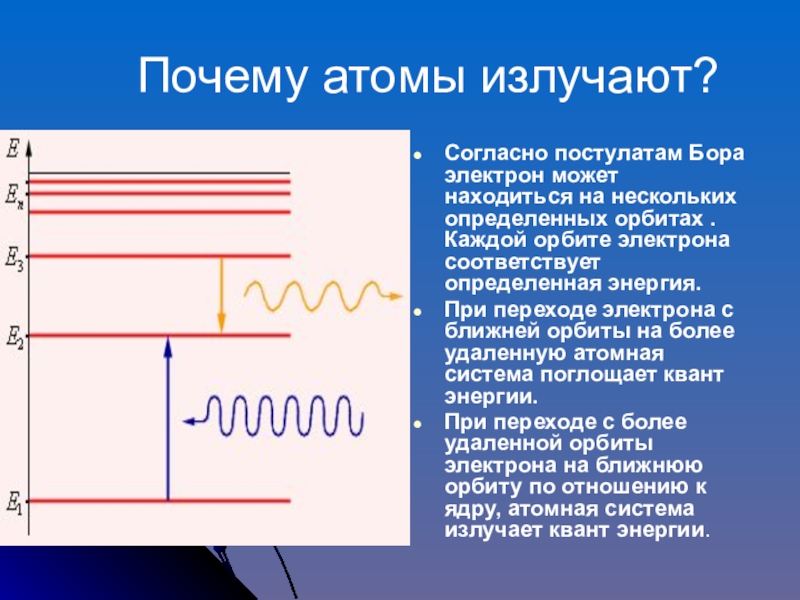
Слайд 15 Почему атомы излучают?
Согласно постулатам Бора электрон может находиться на
При переходе электрона с ближней орбиты на более удаленную атомная система поглощает квант энергии.
При переходе с более удаленной орбиты электрона на ближнюю орбиту по отношению к ядру, атомная система излучает квант энергии.
Слайд 16На пороге квантовой механики
Выбранный Нильсом Бором путь привел к созданию
Слайд 17Литература
Физика для всех / Купер Л.- «Мир»1974г
Физики / Храмов Ю.А.- «Наука»
Физика –9,11 / Перышкин А.В.- «Дрофа» 2004 г.
Интернет-ресурсы
http://www.rcio.rsu.ru/