- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Уравнение состояния идеального газа. Газовые законы
Содержание
- 1. Презентация Уравнение состояния идеального газа. Газовые законы
- 2. Идеальный газ теоретическая модель газа, в
- 3. N mоЕкυ V ТрM m
- 4. Уравнение состояние идеального газаОпр: Уравнение, выражающее связь
- 5. Уравнение Менделеева-Клапейрона
- 6. Следствия из уравнения Менделеева-КлапейронаПри одинаковых температурах и
- 7. Процессы, при которых один из
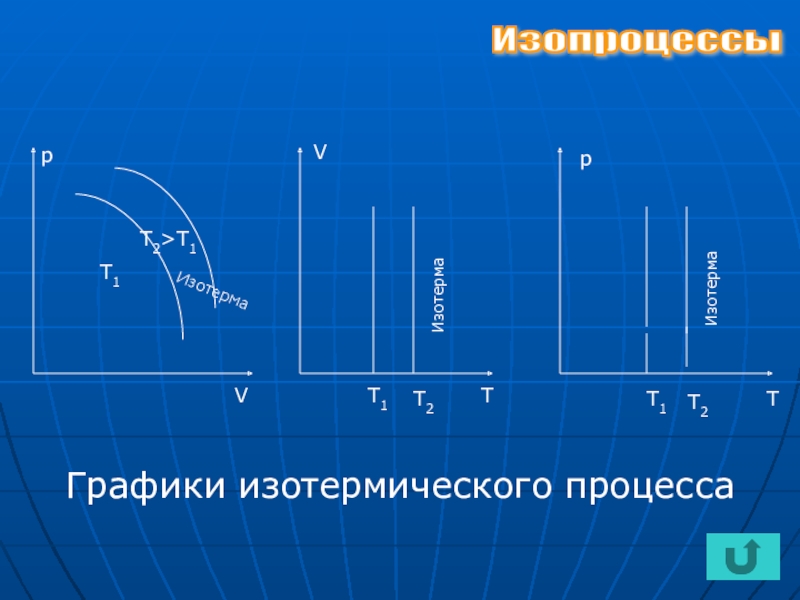
- 8. Изотермический процесс(от греч. «терме» - теплота)
- 9. VрVТТ1Т2Т1Т2>Т1рТТ1Т2 Графики изотермического процессаИзотермаИзотермаИзотермаИзопроцессы
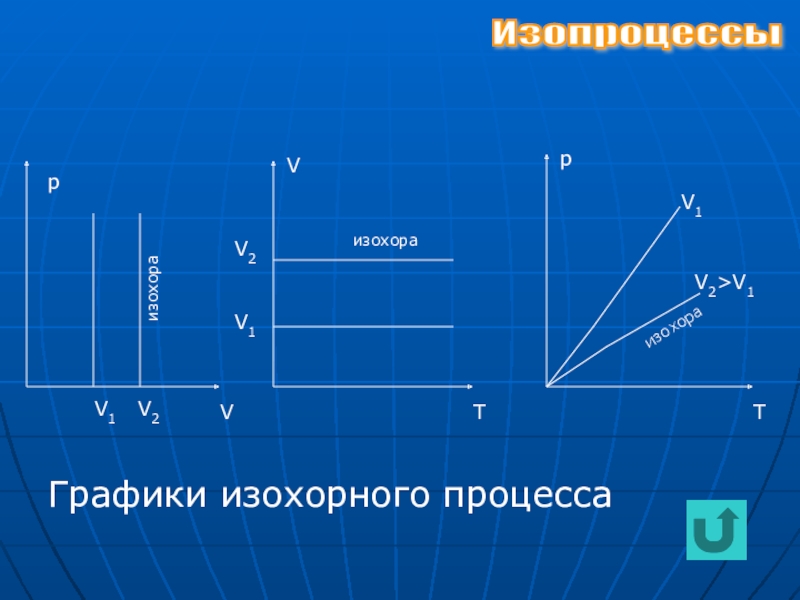
- 10. Изохорный процесс (от греч. «хора»-занимаемый объем)Р V
- 11. рVV1 V2VV1V2TpTV1V2>V1 Графики изохорного процессаизохораизохораизохораИзопроцессы
- 12. Изобарный процесс(от греч. «баросе» - тяжесть)Р V
- 13. Графики изобарного процессаИзопроцессырVpTVTp1p1p2p2p2p1
- 14. Вопросы и задания1. Какой газ называется идеальным?2.
Слайд 2Идеальный газ
теоретическая модель газа, в природе не существует
За
τст<< τ
N Vо<
λ τст
Слайд 4Уравнение состояние идеального газа
Опр: Уравнение, выражающее связь между макроскопическими (термодинамическими) параметрами
k =1.38∙ 10-23 Дж/К - постоянная Больцмана
N
Р= — k Т
V
Слайд 5Уравнение
Менделеева-Клапейрона
m
N = NА — ; Р= — k Т
М V
m
рV= — R Т, где R=k∙NА=8,31 Дж/(моль∙ К)
М универсальная газовая постоянная
1874 рус. Д.И. Менделеев
1834 фр. Б.П. Клапейрон
Слайд 6Следствия из уравнения Менделеева-Клапейрона
При одинаковых температурах и давлениях в равных объемах
Закон Авогадро 1811 г.
Давление смеси химически невзаимодействующих газов равно сумме парциальных давлений этих газов
Закон Дальтона 1801 г.
Отношение произведения давления и объема идеального газа к его абсолютной температуре есть величина постоянная для данной массы газа.
Уравнение Клапейрона 1834 г.
р V = р1 V1
Т Т1
объединенный газовый закон
Слайд 7
Процессы, при которых один из параметров состояния газа остается
(от греч. «изос» - равный)
Изопроцессы
изотермический
изохорный
изобарный
Слайд 8Изотермический процесс(от греч. «терме» - теплота)
m=соnst
При неизменной массе газа и постоянной температуре произведение давления идеального газа на его объем является величиной постоянной.
англ. Бойль 1662
фр. Мариотт 1676
Закон Бойля-Мариотта
Изопроцессы
р V = р1 V1
Т Т1
Слайд 10Изохорный процесс (от греч. «хора»-занимаемый объем)
Р V = P1V1
Т
При неизменном объеме отношение давления данной массы идеального газа к его абсолютной температуре является величиной постоянной.
фр. Шарль 1787 г.
Закон Шарля
Р = __Р1
V=соnst m=соnst
Изопроцессы
Слайд 12Изобарный процесс(от греч. «баросе» - тяжесть)
Р V = P1V1
Т
р=соnst
m=соnst
При неизменном давлении отношение объема данной массы идеального газа к его абсолютной температуре является величиной постоянной.
фр. Гей-Люссак 1753 г.
Закон Гей-Люссака
V = V1
Изопроцессы
Слайд 14Вопросы и задания
1. Какой газ называется идеальным?
2. Раздели параметры на 2
в 1 столбик выпиши микроскопические параметры, во 2 столбик – макроскопические (термодинамические) параметры:
Т, р, m0, m, N, M, Eкин, υ.
3. Запиши уравнение состояния идеального газа.
4. Запиши уравнение Менделеева-Клапейрона.
5. Сформулируйте и докажите закон Авогадро, закон Дальтона, уравнение Клапейрона (см учебник § 33).