- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике Уравнение состояния идеального газа
Содержание
- 1. Презентация по физике Уравнение состояния идеального газа
- 2. Слайд 2
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Уравнение состояния идеального газа
- 9. Цели урока:познакомиться с уравнением состояния идеального газа;записать
- 10. Модель «Идеальный газ»9. Частицы колеблются около положений
- 11. В о с с т а н о в и формулу
- 12. Проверьте знание формул!2. Зависимость внутренней энергии идеального
- 13. Уравнение состояния вещества Уравнение, выражающее
- 14. Уравнение состоянияидеального газа
- 15. R=8,31 Дж / (моль·К)NA k = RУниверсальная газоваяпостоянная - R
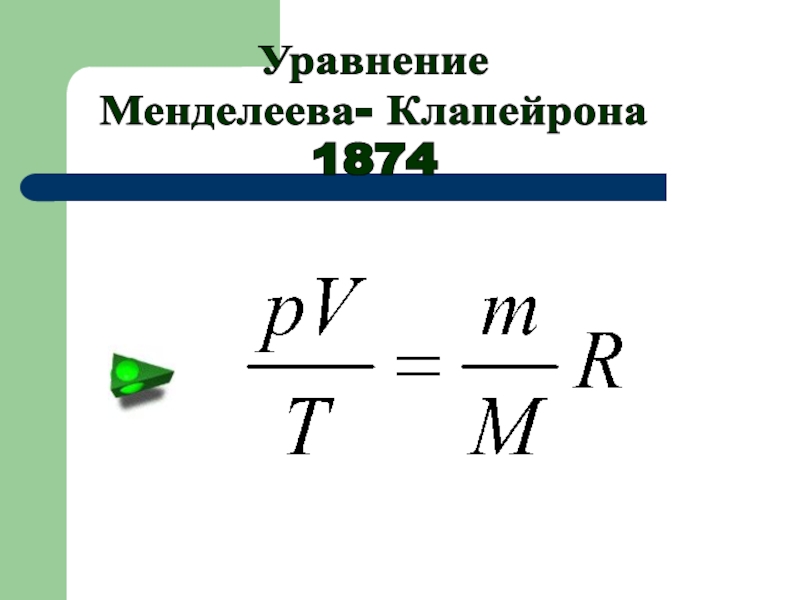
- 16. УравнениеМенделеева- Клапейрона1874
- 17. Дмитрий Иванович Менделеев (1834 – 1907)Крупнейший химик мира, физик, педагог
- 18. Закон Авогадро 1811
- 19. Закон Дальтона 1801
- 20. Отношение произведения давления и объема
- 21. p0, V0, T0 – параметры начального состояния
- 22. Во всем мне хочется дойти до самой сути…
- 23. Обратите внимание:Уравнение Менделеева - Клапейрона связывает между
- 24. Р е ш и т ь
- 25. Д а н о:
- 26. Какова плотность сжатого воздуха при 0
- 27. Р е ш е н и е,
- 28. Домашнее задание:Прочитать § 70Ответить на вопросы § 70
Слайд 9Цели урока:
познакомиться с уравнением состояния идеального газа;
записать это уравнение в классическом
рассмотреть следствия, вытекающие из уравнения состояния идеального газа;
научиться использовать полученные уравнения при решении задач.
Слайд 10Модель «Идеальный газ»
9. Частицы колеблются около положений равновесия, взаимодействуя с ближайшими
1. В любом макроскопическом объеме газа число молекул очень велико.
2. Размеры молекул пренебрежительно малы по сравнению с расстояниями между ними.
3. Между молекулами существуют силы взаимодействия- силы притяжения и силы отталкивания.
4. Все соударения молекул являются абсолютно упругими.
5. Молекулы взаимодействуют друг с другом или со стенкой сосуда только в момент соударения.
6. Значительная средняя потенциальная энергия взаимодействия препятствует изменению среднего расстояния между ними.
7. Молекулы находятся в непрерывном хаотическом движении.
8. К движению отдельной молекулы применимы законы механики Ньютона.
Слайд 12Проверьте знание формул!
2. Зависимость внутренней энергии идеального газа от температуры
3. Средняя
5. Средняя кинетическая энергия молекулы с массой m0
4. Тепловая скорость движения молекулы
1. Число частиц в любом теле
1
2
3
4
5
Слайд 13Уравнение состояния вещества
Уравнение, выражающее связь между макроскопическими параметрами
Слайд 18Закон Авогадро
1811
При одинаковых
температурах
содержится
одинаковое число молекул.
Слайд 19 Закон Дальтона 1801
Давление смеси химически не
p = p1+ … + pn
Парциальным называют давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
Слайд 20 Отношение произведения давления и объема идеального газа к его
Объединенный газовый закон
1824
Слайд 21p0, V0, T0 – параметры начального состояния газа,
p, V, T -
Уравнение Клапейрона
1834
Слайд 23Обратите внимание:
Уравнение Менделеева - Клапейрона связывает между собой 5 физических величин,
Уравнение Менделеева - Клапейрона и все его следствия с большой точностью можно применить к газам, находящимся в условиях, близких к нормальным (t = 0 0C, p = 1,013.105 Па), а также к разреженным газам.
Если плотность газа велика, а следовательно, взаимодействием молекул пренебречь нельзя, то модель идеального газа оказывается непригодной.
Проверьте, все ли величины выражены в СИ:
(1 л = 10-3 м3; 1 мм рт. ст. = 133 Па;
0 0С = 273 К; нормальное атмосферное давление:
1,013.105 Па).
Слайд 24Р е ш и т ь з а д
Сколько гелия потребуется для наполнения воздушного шара емкостью 500 м3 при нормальном атмосферном давлении и температуре 300 К ?
Слайд 25Д а н о:
V = 500 м3
p = 105 Па
Т = 300 К
М = 4.10-3 Дж/(моль.К)
m - ?
Ответ: m = 83 кг
83 кг
Слайд 26 Какова плотность
сжатого воздуха при 0 0С в камере шины
Р е ш и т ь з а д а ч у: