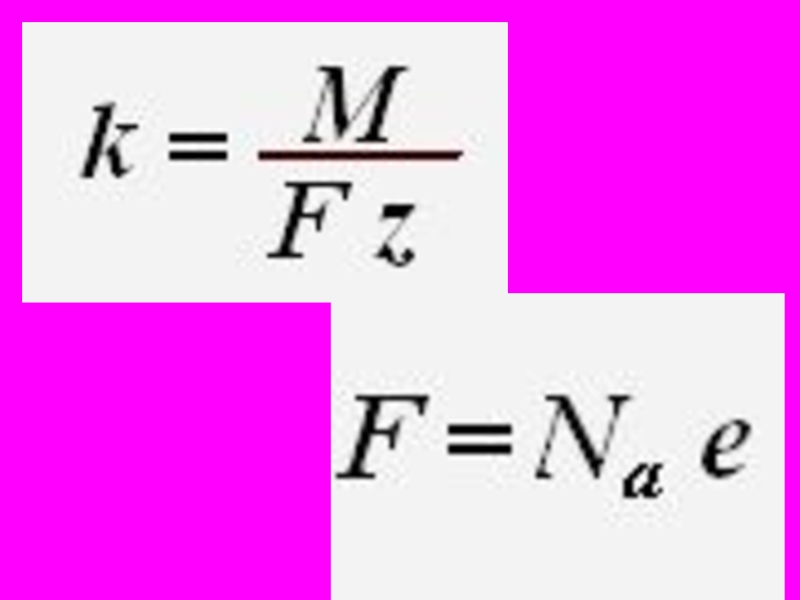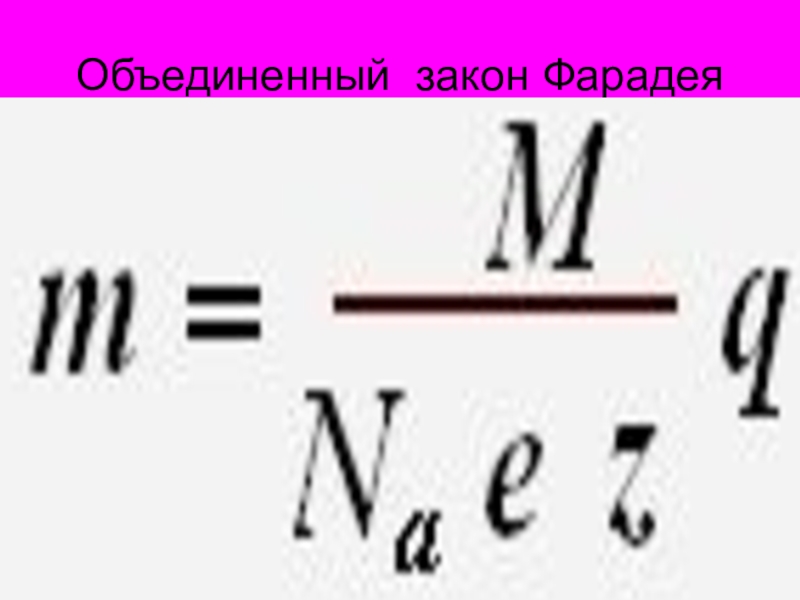т о к в
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на темуЭлектрический ток в жидкостях (10 класс)
Содержание
- 1. Презентация по физике на темуЭлектрический ток в жидкостях (10 класс)
- 2. Диэлектрики (дистилированная вода);Полупроводники (расплавленный селен);Проводники (растворы и
- 3. Растворы кислот, солей оснований (щелочей) э л
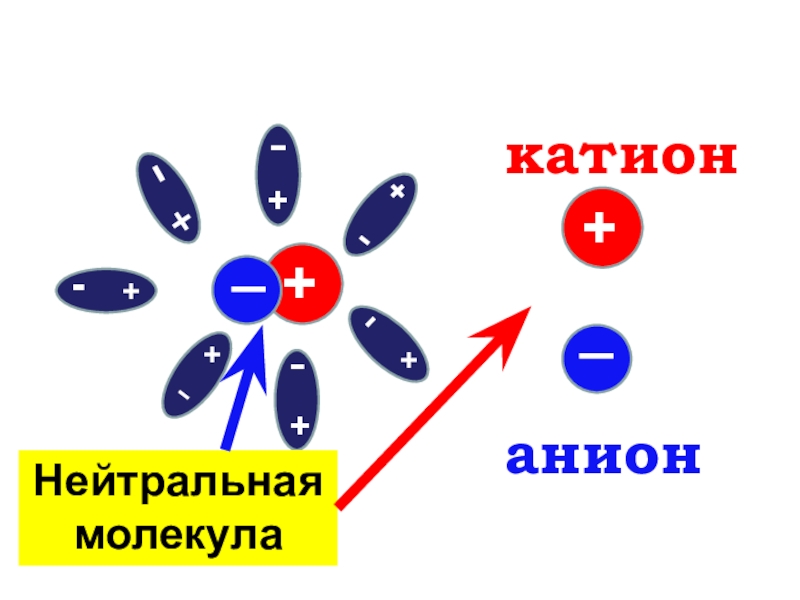
- 4. +++++++-------++катионанион__Нейтральная молекула
- 5. распад молекул электролитов на ионы под действием
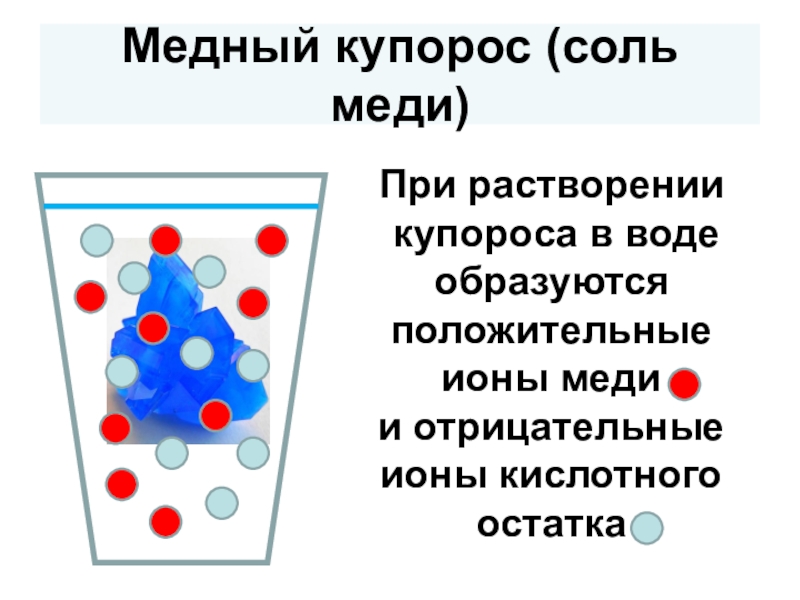
- 6. Медный купорос (соль меди)При растворении купороса в воде образуютсяположительные ионы медии отрицательные ионы кислотного остатка
- 7. Рекомбинация-объединение ионов в нейтральные молекулы
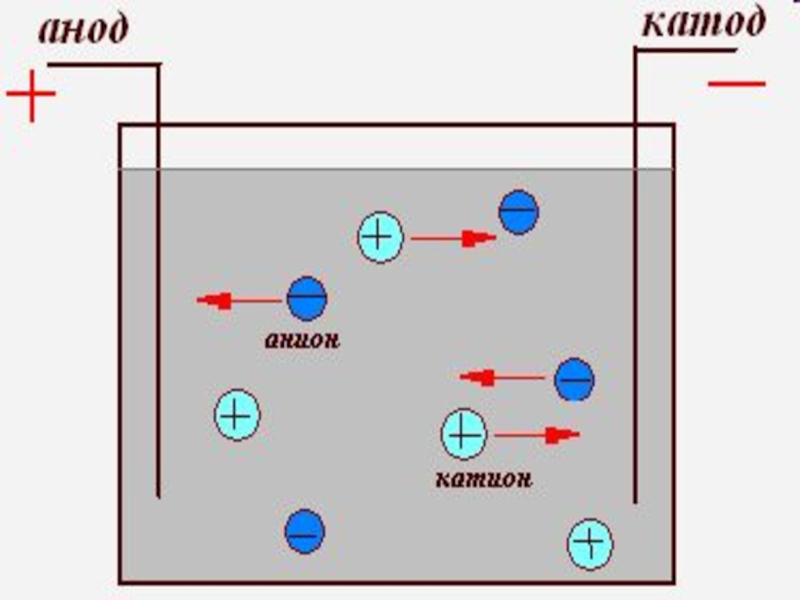
- 8. Электрический ток в электролитах -упорядоченное движение ионов
- 9. Слайд 9
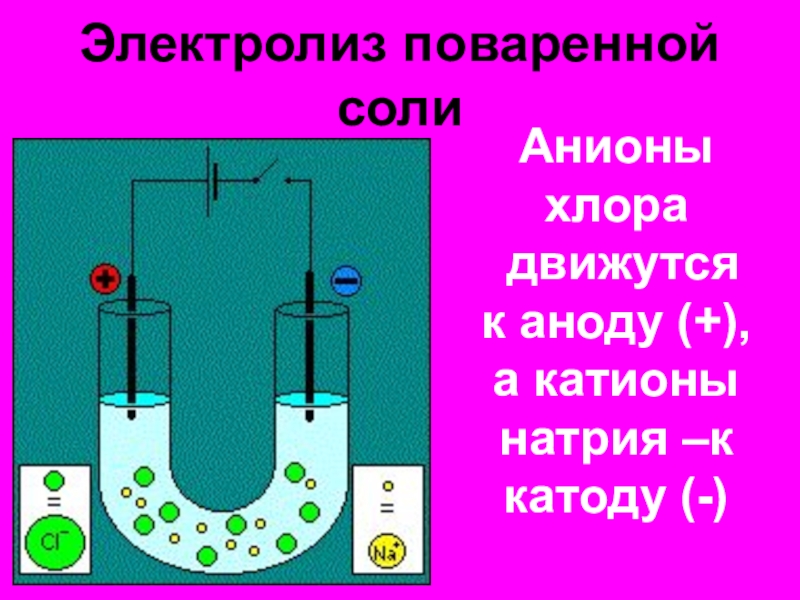
- 10. Электролиз поваренной солиАнионы хлора движутся к аноду (+),а катионы натрия –к катоду (-)
- 11. это окислительно-восстановительный процесс, протекающий на электродах
- 12. ОкислениеПроцесс отдачи электронов отрицательными ионами
- 13. ВосстановлениеПроцесс получения электронов положительными ионами
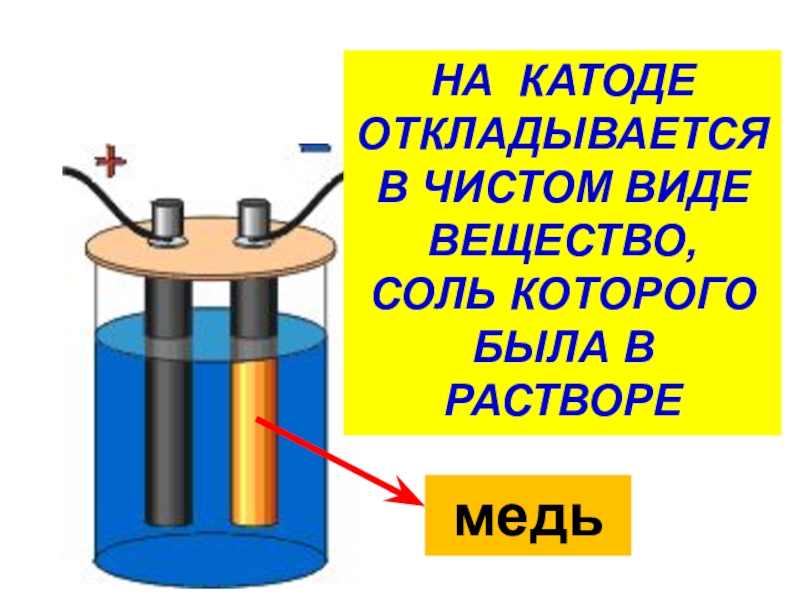
- 14. КАТОДНА КАТОДЕ ОТКЛАДЫВАЕТСЯ В ЧИСТОМ ВИДЕ ВЕЩЕСТВО,СОЛЬ КОТОРОГО БЫЛА В РАСТВОРЕмедь
- 15. Электролиз воды позволяет получить водород и кислород
- 16. э л е к т р о
- 17. водорода, кисло-рода, хлораалюминияфтораП о л у ч е н и е
- 18. Очистка металлов от примесей Р а
- 19. Пластина чистой меди
- 20. Частицы рафинированного серебра
- 21. Чешуйки электролитического хрома
- 22. Изготовление рельефных копий из металла (например,медалей, монет,
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Покрытие слоем металла поверхности металлического изделияГ а
- 27. Гальваностегия применяется для защиты металлов от коррозии
- 28. хромирование
- 29. Слайд 29
- 30. Слайд 30
- 31. золочение
- 32. Слайд 32
- 33. никелирование
- 34. Слайд 34
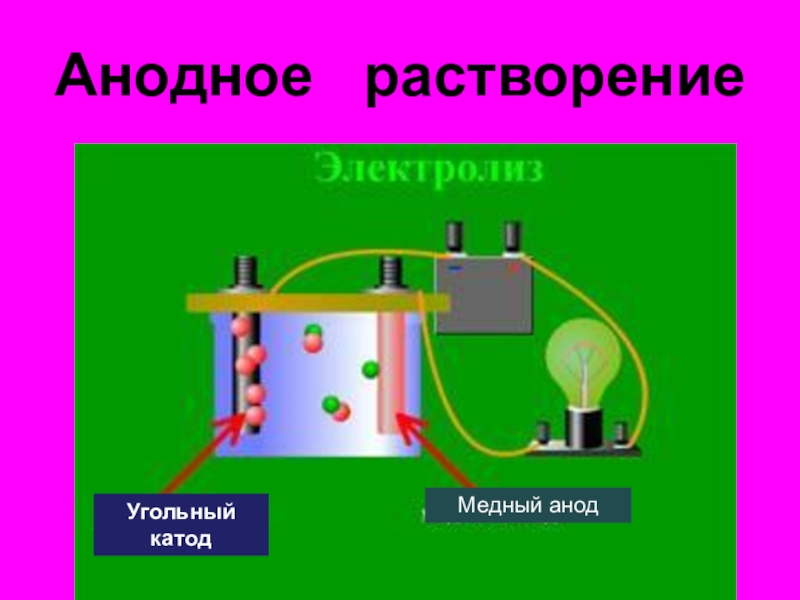
- 35. Анодное растворениеУгольный катодМедный анод
- 36. Анодное растворение
- 37. Слайд 37
- 38. Майкл Фарадей
- 39. Слайд 39
- 40. Первый закон Фарадея1. Масса вещества, выделяемого на электроде, прямо пропорциональна электрическому заряду, прошедшему через электролит.
- 41. m=kq
- 42. m-масса вещества, выделившегося на катоде
- 43. q – заряд, прошедший через электролит
- 44. k – электрохимический эквивалент веществазависит от рода вещества
- 45. Медь 0,33 мг/КлПри прохождении заряда 1 Кл через электролит на катоде выделяется 0,33 мг меди
- 46. m= kIt
- 47. 2 закон Фарадея Электрохимический эквивалент вещества прямо пропорционален его химическому эквиваленту.
- 48. Слайд 48
- 49. Постоянная Фарадея F численно равна заряду, который
- 50. Объединенный закон Фарадея
Диэлектрики (дистилированная вода);Полупроводники (расплавленный селен);Проводники (растворы и расплавы электролитов)ж и д к о с т и
Слайд 2Диэлектрики (дистилированная вода);
Полупроводники (расплавленный селен);
Проводники (растворы и расплавы электролитов)
ж и д
к о с т и
Слайд 5
распад молекул электролитов на ионы под действием растворителя
Э л е к
т р о л и т и ч е с к а я
д и с с о ц и а ц и я
Слайд 6Медный купорос (соль меди)
При растворении
купороса в воде образуются
положительные ионы меди
и
отрицательные ионы кислотного остатка
Слайд 11
это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического
тока через раствор или расплав электролитов.
Э л е к т р о л и з -
Слайд 22Изготовление рельефных копий из металла (например,медалей, монет, украшений)
Г а л ь
в а н о п л а с т и к а
Слайд 40Первый закон Фарадея
1. Масса вещества, выделяемого на электроде, прямо пропорциональна электрическому
заряду, прошедшему через электролит.
Слайд 45Медь 0,33 мг/Кл
При прохождении
заряда 1 Кл через электролит на катоде
выделяется
0,33 мг меди
0,33 мг меди
Слайд 472 закон Фарадея Электрохимический эквивалент вещества прямо пропорционален его химическому эквиваленту.
Слайд 49Постоянная Фарадея F численно равна заряду, который должен пройти через электролит,
чтобы выделить из него массу вещества, численно равную химическому эквиваленту.