- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Ток в электролитах
Содержание
- 1. Презентация по физике на тему Ток в электролитах
- 2. Слайд 2
- 3. Электролитическая диссоциация - распада молекул электролитов в
- 4. Ионы в электролите движутся хаотично.При создании
- 5. Ток в электролитах –
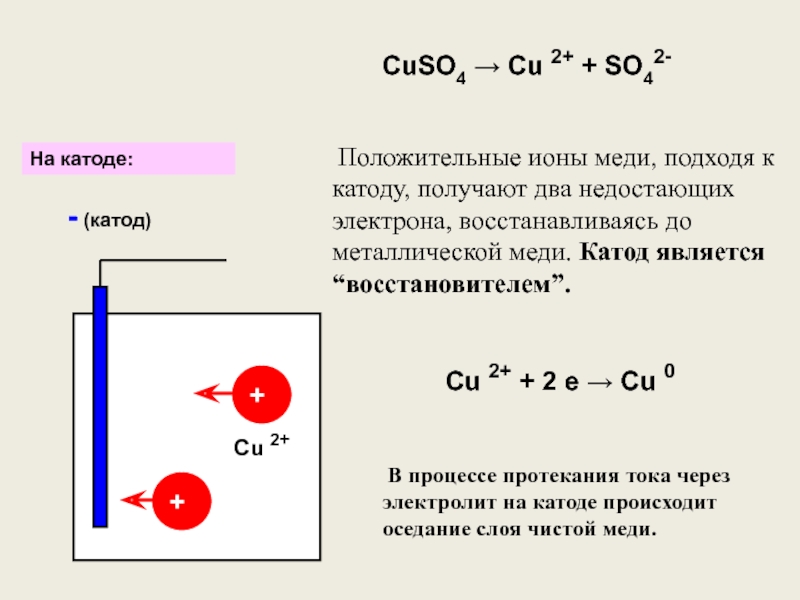
- 6. CuSO4 → Cu 2+ + SO42-++- (катод)
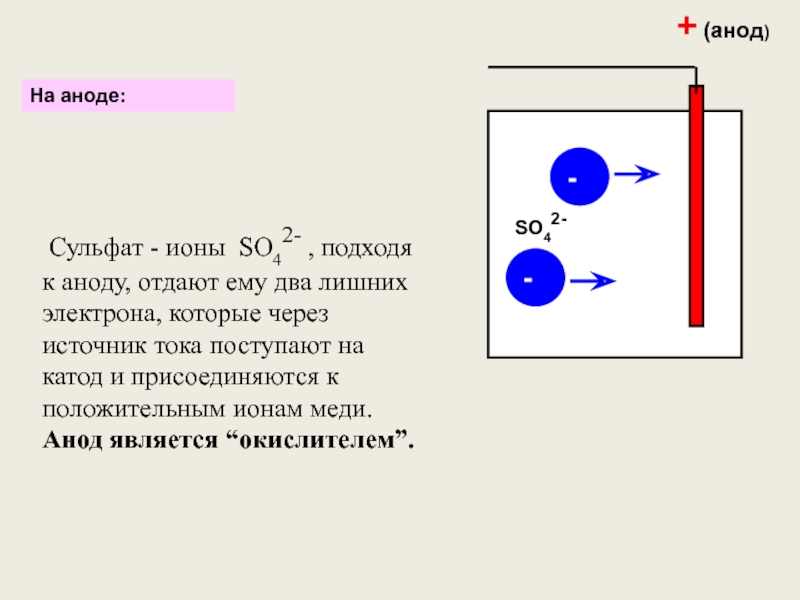
- 7. На аноде:+ (анод)-- Сульфат - ионы SO42-
- 8. Сущность электролиза состоит в том, что за
- 9. Явление электролиза было открыто в 1800
- 10. Закон
- 11. закон электролиза Масса вещества, выделившегося на электродах при электролизе, прямо пропорциональна величине заряда, прошедшего через электролит.
- 12. Если учесть, что q = I t,
- 13. Слайд 13
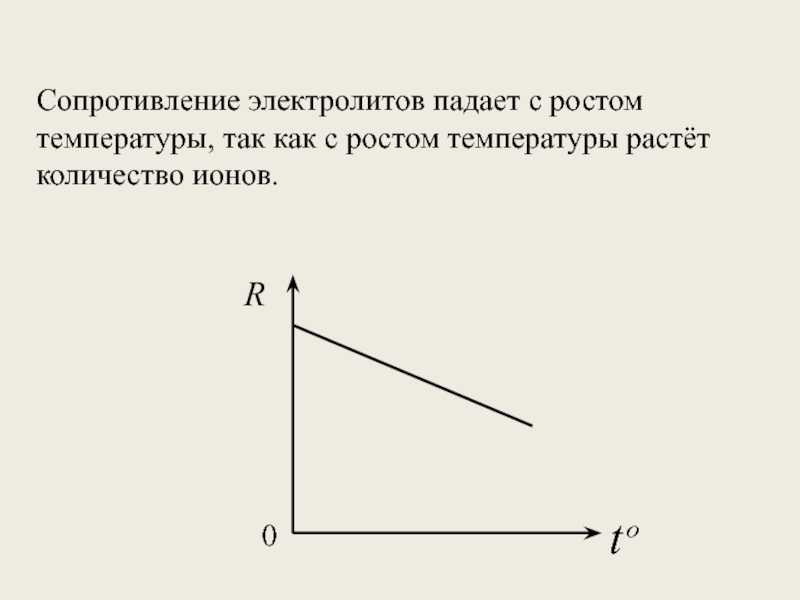
- 14. Сопротивление электролитов падает с ростом температуры, так как с ростом температуры растёт количество ионов. 0Rtº
- 15. Применение электролизаочистка металлов от примесейГальванопластикаГальваностегияЭлектрометаллургия
- 16. Домашнее заданиепрезентация или короткое сообщение:• Применение электролиза. • Как экспериментально определить заряд электрона?
- 17. Дано Задача №1. При силе тока 1,6
- 18. Дано Задача №2. При никелировании детали в
- 19. Всем спасибо!
Слайд 2
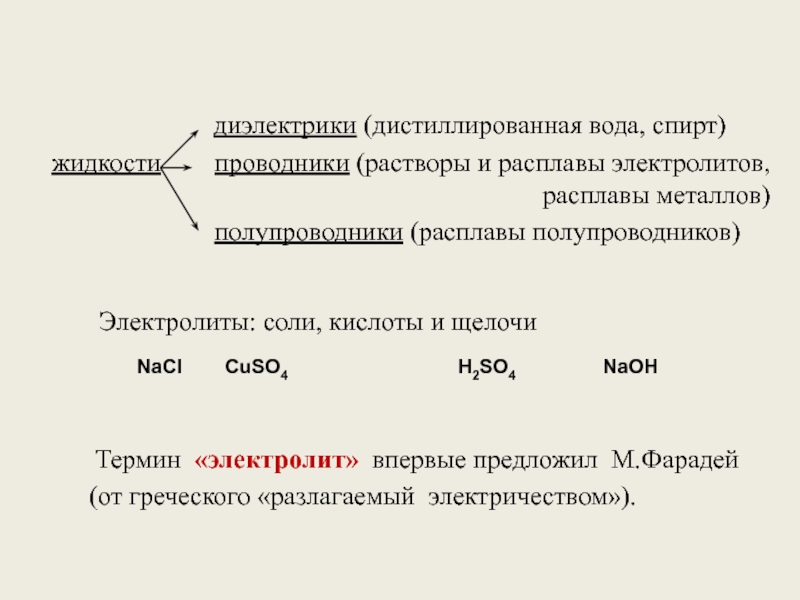
жидкости проводники (растворы и расплавы электролитов, расплавы металлов)
полупроводники (расплавы полупроводников)
Электролиты: соли, кислоты и щелочи
NaCl
CuSO4
H2SO4
NaOH
Термин «электролит» впервые предложил М.Фарадей
(от греческого «разлагаемый электричеством»).
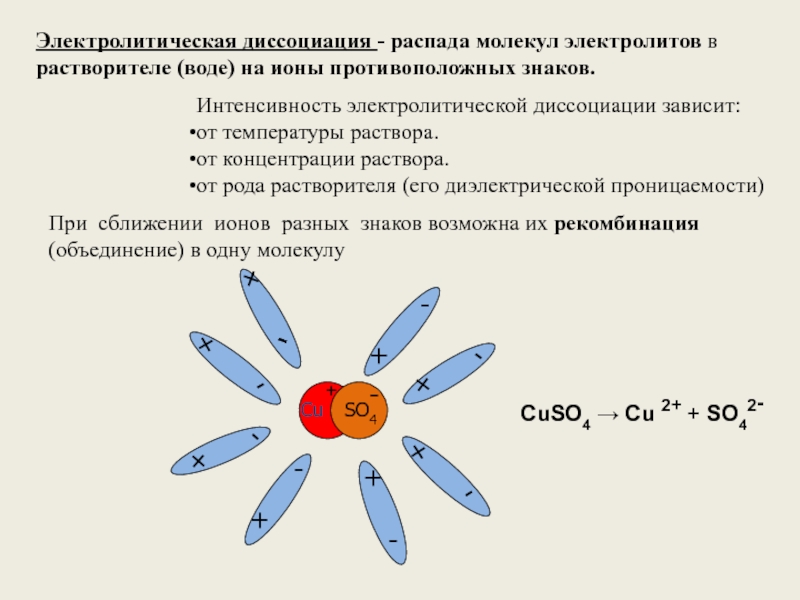
Слайд 3Электролитическая диссоциация - распада молекул электролитов в растворителе (воде) на ионы
CuSO4 → Cu 2+ + SO42-
При сближении ионов разных знаков возможна их рекомбинация (объединение) в одну молекулу
Интенсивность электролитической диссоциации зависит:
от температуры раствора.
от концентрации раствора.
от рода растворителя (его диэлектрической проницаемости)
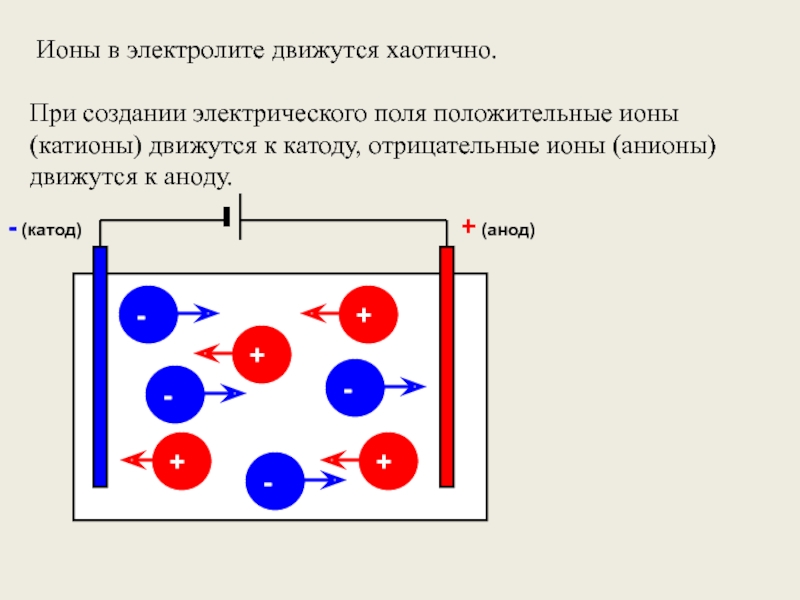
Слайд 4 Ионы в электролите движутся хаотично.
При создании электрического поля положительные ионы
+ (анод)
- (катод)
+
+
+
-
-
-
+
-
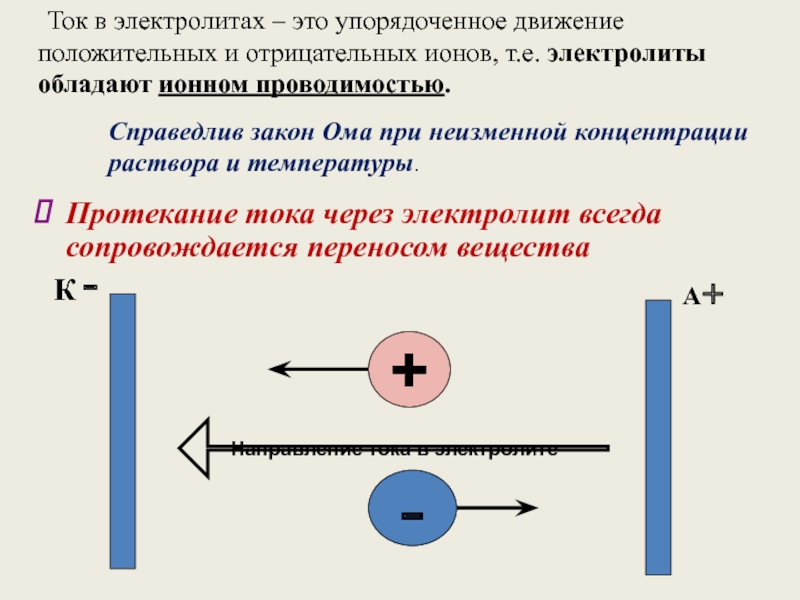
Слайд 5 Ток в электролитах – это упорядоченное движение положительных
+
-
Направление тока в электролите
К -
А+
Протекание тока через электролит всегда сопровождается переносом вещества
Справедлив закон Ома при неизменной концентрации раствора и температуры.
Слайд 6CuSO4 → Cu 2+ + SO42-
+
+
- (катод)
Положительные ионы меди, подходя
В процессе протекания тока через электролит на катоде происходит оседание слоя чистой меди.
Cu 2+ + 2 е → Cu 0
На катоде:
Cu 2+
Слайд 7На аноде:
+ (анод)
-
-
Сульфат - ионы SO42- , подходя к аноду,
SO42-
Слайд 8Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется
Выделение вещества на электродах вследствие окислительно – восстановительных реакций при прохождении тока через электролит называется электролизом.
Слайд 9 Явление электролиза было открыто в 1800 г. английскими учеными У.
У. Никольсон
Э.Карлейл
Слайд 10 Закон электролиза был экспериментально установлен
Майкл Фарадей (1791 – 1867)
Слайд 11закон электролиза
Масса вещества, выделившегося на электродах при электролизе, прямо пропорциональна
Слайд 12Если учесть, что q = I t, то
m (кг) –
I (А) – сила тока t (с) – время
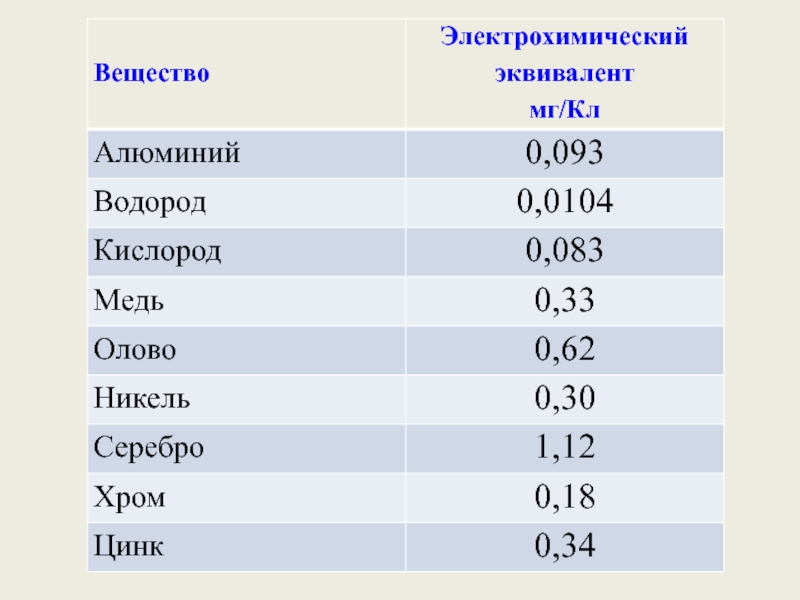
k (кг/Кл) – электрохимический эквивалент
(табличная величина), равен
массе вещества, выделившегося
при прохождении через
электролит заряда 1 Кл
Слайд 14Сопротивление электролитов падает с ростом температуры, так как с ростом температуры
0
R
tº
Слайд 15Применение электролиза
очистка металлов от примесей
Гальванопластика
Гальваностегия
Электрометаллургия
Слайд 16Домашнее задание
презентация или короткое сообщение:
• Применение электролиза.
• Как экспериментально
Слайд 17Дано
Задача №1. При силе тока 1,6 А на катоде выделилась
Найдите электрохимический эквивалент меди.
Найти: k -?
I = 1,6 А
m =0,316 кг
t = 10 мин
Ответ: 0,000329 (кг/Кл) ≈ 0,33 (мг/Кл)
=0,000329(кг/Кл)
Решение:
k =
k =
СИ
600 с
Слайд 18Дано
Задача №2. При никелировании детали в течении 50 минут сила
Найти: m -?
I = 2 А
k = 0,3 мг/Кл
t = 50 мин
Ответ: 1,8 ⋅ 10-3 (кг)
Решение:
m = 0,3⋅10-6 ⋅ 2 ⋅ 3000 = 1,8 ⋅ 10-3 (кг)
СИ
0,3⋅10-6 кг/Кл 3000 с