- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Световые кванты
Содержание
- 1. Презентация по физике на тему Световые кванты
- 2. Содержание1.Атомная физика2.Строение атома (Резерфорда)3.Модель атома водорода по Бору4.Квантовые постулаты Бора5.Испускание и поглощение света атомами
- 3. Атомная физикаАтомная физика — раздел физики, в
- 4. Атомная физика
- 5. Строение атома (по Резерфорду)Эрнест Резерфорд родился 30
- 6. Строение атома (по Резерфорду)
- 7. Модель атома водорода по БоруРодился 7 октября
- 8. Теория строения атома по БоруВ 1913 году
- 9. Квантовые постулаты БораН. Бор выдвинул дав постулата
- 10. Первый и второй постулаты Бора1 первый постулат
- 11. Испускание и поглощение света атомами Атомы могут
- 12. ЛазерыЛазеры Слово “лазер” представляет собой аббревиатуру английской
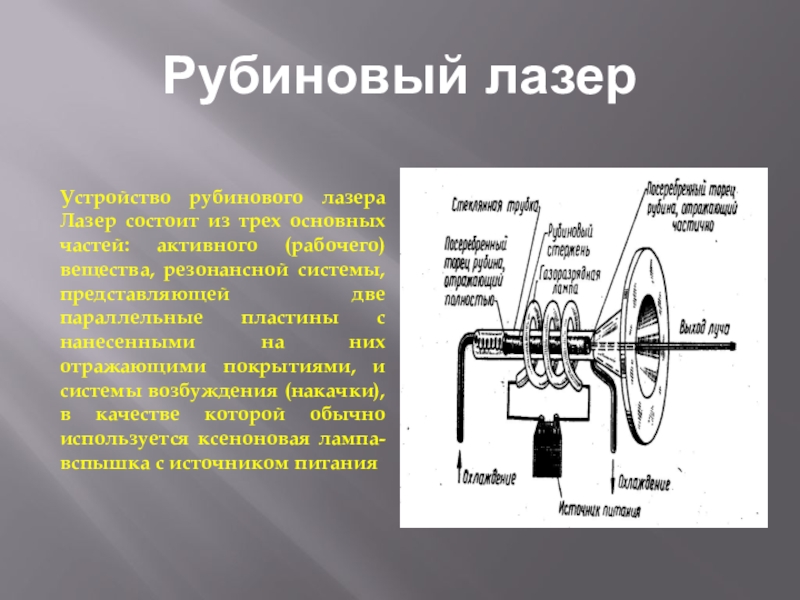
- 13. Рубиновый лазерУстройство рубинового лазера Лазер состоит из
- 14. Конец XIX века демонстрировал наличие теории, удовлетворяющей
- 15. Положительно заряженная часть атома была открыта в
- 16. Эта модель атома легко объясняет явление отклонения
Содержание1.Атомная физика2.Строение атома (Резерфорда)3.Модель атома водорода по Бору4.Квантовые постулаты Бора5.Испускание и поглощение света атомами
Слайд 2Содержание
1.Атомная физика
2.Строение атома (Резерфорда)
3.Модель атома водорода по Бору
4.Квантовые постулаты Бора
5.Испускание и
поглощение света атомами
Слайд 3Атомная физика
Атомная физика — раздел физики, в котором изучают строение и
состояние атомов. А. ф. возникла в конце 19 — начале 20 вв. В 10-х гг. 20 в. было установлено, что атом состоит из ядра и электронов, связанных электрическими силами. На первом этапе своего развития А. ф. охватывала также вопросы, связанные со строением атомного ядра. В 30-х гг. выяснилось, что природа взаимодействий, имеющих место в атомном ядре, иная, чем во внешней оболочке атома, и в 40-х гг. ядерная физика выделилась в самостоятельную область науки. В 50-х гг. от неё отпочковалась физика элементарных частиц, или физика высоких энергий.
Слайд 5Строение атома (по Резерфорду)
Эрнест Резерфорд родился 30 августа 1871 г. в
городе Спринг – Броув (Новая Зеландия) в семье шотландских
эмигрантов. В 1903 г. Резерфорд стал членом Лондонского королевского общества, а с 1925 по 1930 г. занимал пост его президента. В 1904 г. вышел фундаментальный труд учёного «Радиоактивные вещества и их излучения», который стал энциклопедией для физиков-ядерщиков. В 1908 г. Резерфорд стал нобелевским лауреатом за исследования радиоактивных элементов. Руководитель физической лаборатории в Манчестерском университете, Резерфорд создал школу физиков-ядерщиков, своих учеников. Умер учёный 19 октября 1937 г. в Кембридже. Как и многие великие люди Англии, Эрнест Резерфорд покоится в соборе Святого Павла, в «Уголке науки», рядом с Ньютоном, Фарадеем, Дарённом, Гершелем.
эмигрантов. В 1903 г. Резерфорд стал членом Лондонского королевского общества, а с 1925 по 1930 г. занимал пост его президента. В 1904 г. вышел фундаментальный труд учёного «Радиоактивные вещества и их излучения», который стал энциклопедией для физиков-ядерщиков. В 1908 г. Резерфорд стал нобелевским лауреатом за исследования радиоактивных элементов. Руководитель физической лаборатории в Манчестерском университете, Резерфорд создал школу физиков-ядерщиков, своих учеников. Умер учёный 19 октября 1937 г. в Кембридже. Как и многие великие люди Англии, Эрнест Резерфорд покоится в соборе Святого Павла, в «Уголке науки», рядом с Ньютоном, Фарадеем, Дарённом, Гершелем.
Слайд 6Строение атома (по Резерфорду)
Резерфорд предложил свою
схему строения атома : в центре атома находится положительное заряженное ядро, вокруг которого по разным орбиталиям вращаются отрицательные электроны. Центростремительные силы, возникаю -
щие при их вращениях удерживают их на своих орбитах и не дают им улететь.
щие при их вращениях удерживают их на своих орбитах и не дают им улететь.
Слайд 7Модель атома водорода по Бору
Родился 7 октября 1885 г. в Копенгагене.
Там
же в 1908 г. окончил университет.
Некоторое время работал в
Кембридже (Англия) в лаборатории у светила
в области физики Дж. Томсона, затем был
приглашён в Манчестер в лабораторию
другой знаменитости — Э. Резерфорда.
Бор предложил новую модель водородоподобно-
го атома и открыл условия его устойчивости.
Он развил идею квантования энергии Планка
и на основе модели атома Резерфорда создал
первую квантовую модель атома.
Теория
Бора получила название квантовой теории планетарного атома. За её разработку в 1922 г. учёному была присуждена Нобелевская премия.
Умер 18 ноября 1962 г.
же в 1908 г. окончил университет.
Некоторое время работал в
Кембридже (Англия) в лаборатории у светила
в области физики Дж. Томсона, затем был
приглашён в Манчестер в лабораторию
другой знаменитости — Э. Резерфорда.
Бор предложил новую модель водородоподобно-
го атома и открыл условия его устойчивости.
Он развил идею квантования энергии Планка
и на основе модели атома Резерфорда создал
первую квантовую модель атома.
Теория
Бора получила название квантовой теории планетарного атома. За её разработку в 1922 г. учёному была присуждена Нобелевская премия.
Умер 18 ноября 1962 г.
Слайд 8Теория строения атома по Бору
В 1913 году Бор предложил свою теорию
строения атома, в которой ему удалось с большим искусством согласовать спектральные явления с ядерной моделью атома , применив к последней так называемую квантовую теорию излучения, введённую в науку немецким ученым физиком Планком.
Слайд 9Квантовые постулаты Бора
Н. Бор выдвинул дав постулата – атомная система может
находится только в некоторых определенных состояниях, в которых не происходит излучение света, хотя движение происходит ускоренное и при переходе из одного состояния в другое происходит или поглощение или испускание кванта по закону где постоянная Планка:
hvRn=ER-EN
hvRn=ER-EN
Слайд 10Первый и второй постулаты Бора
1 первый постулат Бора гласит: атомная система
может находится только в особых стационарных или квантовых состояниях , каждому из которых соответствует определенная энергия En; в стационарном состоянии атом не излучает.
2 постулат Бора гласит: излучение света происходит при переходе атома из стационарного соcтояния с большей энергией ER в стационарное состояние с меньшей энергией En.
3 постулат Бора гласит: из всех возможных орбит, стоционарое состояние соответствует только тем для которых момент количества движения электрона кратен постоянной Планка.
2 постулат Бора гласит: излучение света происходит при переходе атома из стационарного соcтояния с большей энергией ER в стационарное состояние с меньшей энергией En.
3 постулат Бора гласит: из всех возможных орбит, стоционарое состояние соответствует только тем для которых момент количества движения электрона кратен постоянной Планка.
Слайд 11Испускание и поглощение света атомами
Атомы могут самопроизвольно испускать кванты света, при
этом оно проходит некогерентно (т.к. каждый атом излучает независимо от других) и называется спонтанным. Переход электрона с верхнего уровня на нижний может происходит под влиянием внешнего электромагнитного поля с частотой, равной частоте перехода. Такое излучение называют вынужденным (индуцированным).
Слайд 12Лазеры
Лазеры Слово “лазер” представляет собой аббревиатуру английской фразы “Light Amplification by
Stimulated Emission of Radiation”, переводимой как усиление света в результате вынужденного (индуцированного) излучения. Гипотеза о существовании индуцированного излучения была высказана в 1917 г. А Эйнштейном. Советские ученые Н.Г. Басов и А.М. Прохоров и независимо от них американский физик Ч. Таунс использовали явление индуцированного излучения для создания микроволнового генератора радиоволн с длинной волны =1,27 см.
Слайд 13Рубиновый лазер
Устройство рубинового лазера Лазер состоит из трех основных частей: активного
(рабочего) вещества, резонансной системы, представляющей две параллельные пластины с нанесенными на них отражающими покрытиями, и системы возбуждения (накачки), в качестве которой обычно используется ксеноновая лампа-вспышка с источником питания
Слайд 14Конец XIX века демонстрировал наличие теории, удовлетворяющей практическим потребностям. Явления электромагнетизма
использовались в осветительных и силовых устройствах. Термодинамические концепции привели к созданию двигателя внутреннего сгорания и химических установок, Электромагнитная теория вызвала к жизни радио. Область физики, занимавшаяся изучением электрических разрядов, проводившиеся с электрическими разрядами в вакууме опыты привели к интересным результатам, а электротехническая промышленность обнаружила потребность в совершенствовании вакуумной техники. Все это усилило интерес к исследованиям в этой области физики. Первым результатом усиления этого интереса было открытие У. Круксом катодных лучей, которые он назвал лучистой формой материи. Д. Стоней назвал катодные лучи электронами, Ж. Перрен обнаружил у них отрицательный заряд, а Д. Томсон измерил их скорость. Следующим шагом было совершено непредвиденное открытие К. Рентгеном - обнаружение Х-лучей (получивших название рентгеновских), исходивших из катодно-лучевой разрядной трубки. Это открытие, помимо практических перспектив, имело важное значение для других областей физики. Первая модель атома, предложенная В. Томсоном и затем Д. Томсоном, включала шарообразное облако положительного заряда, внутри которого находятся электроны, расположенные в этом облаке концентрическими кольцами. Данная модель просуществовала недолго. Но это был первый шаг в раскрытии структуры атома. Следующие модели атома появились уже в ХХ веке (модель Э. Резерфорда и модель Н. Бора).
Слайд 15Положительно заряженная часть атома была открыта в 1911 г. Резерфордом при
исследовании движения a-частиц в газах и других веществах. a- частицы, выбрасываемые веществами активных элементов представляют собой положительно заряженные ионы гелия, скорость движения которых достигает 20000 км/сек. Благодаря такой огромной скорости a-частицы, пролетая через воздух и сталкиваясь с молекулами газов, выбивают из них электроны. Молекулы, потерявшие электроны, становятся заряженными положительно, выбитые же электроны тотчас присоединяются к другим молекулам, заряжая их отрицательно. Таким образом, в воздухе на пути a-частиц образуются положительно и отрицательно заряженные ионы газа. Исследуя пути движения частиц с помощью камеры, Резерфорд заметил, что в камере они параллельны (пути), а при пропускании пучка параллельных лучей через слой газа или тонкую металлическую пластинку, они выходят не параллельно, а несколько расходятся, т.е. происходит отклонение частиц от их первоначального пути. Некоторые частицы отклонялись очень сильно, некоторые вообще не проходили через тонкую пластинку.
Слайд 16Эта модель атома легко объясняет явление отклонения a- частиц. Размеры ядра
и электронов очень малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство a-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда a-частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние a-частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития, было определение величины заряда ядра различных атомов. Так как атом в целом электрически нейтрален, то, определив заряд ядра, можно было бы установить и число окружающих ядро электронов.