- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Первый закон термодинамики ( 10 класс)
Содержание
- 1. Презентация по физике на тему Первый закон термодинамики ( 10 класс)
- 2. Ответить на вопросы :От каких величин зависит
- 3. Проверка № 659Дано:сосудS=250см2N2m1=10ггиряm2=12,5кгt1=25˚Ct2=625 ˚CP0=105ПаАг-?∆V-?Си:=25·10-3м2=10·10-3кгT1=289КT2=898КРешение1.Работу газа найдем по
- 4. I закон термодинамики- закон сохранения энергии для
- 5. A вн = A гВторая формулировка закона:Количество
- 6. Применение I закона термодинамики к изопроцессам. Изобарное
- 7. Изотермическое расширение:Изотермическое сжатие:t˚-const =>∆U=0
- 8. Изохорное охлаждениеИзохорное нагреваниеt˚↓=>∆U∆U>0
- 9. №674 (Степанова)Для изобарного нагревания газа в количестве
- 10. Дано: =800моль∆Т=500КQ=9,4МДж -?∆U-?Ответ:Решение1.Работу газа
- 11. Домашнее задание:10 "A": §56 +вопросы668, 673, 675*10 «Б»: §56+вопросы663, 665, 673*
- 12. Спасибо за внимание!!!
Ответить на вопросы :От каких величин зависит работа , совершаемая силой давления газа? Как можно рассчитать работу газа?Какую по знаку работу совершает газ при расширении ( ΔV > 0 ) и при сжатии ( ΔV <
Слайд 2Ответить на вопросы :
От каких величин зависит работа , совершаемая силой
давления газа?
Как можно рассчитать работу газа?
Какую по знаку работу совершает газ при расширении ( ΔV > 0 ) и при сжатии ( ΔV < 0 ) ?
Какой геометрический смысл имеет работа на диаграмме ( р,V ) ?
Какая работа совершается при изохорном процессе? Ответ обоснуйте.
Как можно рассчитать работу газа?
Какую по знаку работу совершает газ при расширении ( ΔV > 0 ) и при сжатии ( ΔV < 0 ) ?
Какой геометрический смысл имеет работа на диаграмме ( р,V ) ?
Какая работа совершается при изохорном процессе? Ответ обоснуйте.
Слайд 3Проверка № 659
Дано:
сосуд
S=250см2
N2
m1=10г
гиря
m2=12,5кг
t1=25˚C
t2=625 ˚C
P0=105Па
Аг-?
∆V-?
Си:
=25·10-3м2
=10·10-3кг
T1=289К
T2=898К
Решение
1.Работу газа найдем по формуле:
2.При этом процессе объем
газа увеличивается
p-давление которое оказывает гиря
p0-нормальное атмосферное давление
Ответ:А2=1780Дж, ∆V=0,017м3
p-давление которое оказывает гиря
p0-нормальное атмосферное давление
Ответ:А2=1780Дж, ∆V=0,017м3
Слайд 4I закон термодинамики- закон сохранения энергии для тепловых процессов.
Первая формулировка закона:
Изменение
внутренней энергии системы при её переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
∆U=Q+Aвн
Слайд 5A вн = A г
Вторая формулировка закона:
Количество теплоты, подведенное к системе,
идет на изменение ее внутренней энергии и на совершение системной работы над внешними телами:
Q=∆U+A г
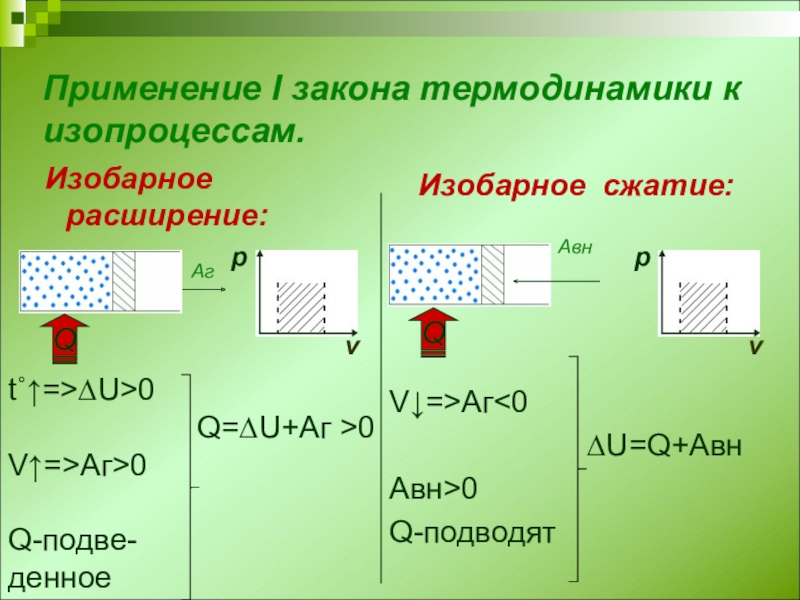
Слайд 6Применение I закона термодинамики к изопроцессам.
Изобарное расширение:
Изобарное сжатие:
V↓=>Аг
∆U=Q+Авн
Авн>0
Q-подводят
Авн>0
Q-подводят
t˚↑=>∆U>0
Q=∆U+Аг >0
V↑=>Аг>0
Q-подве-
денное
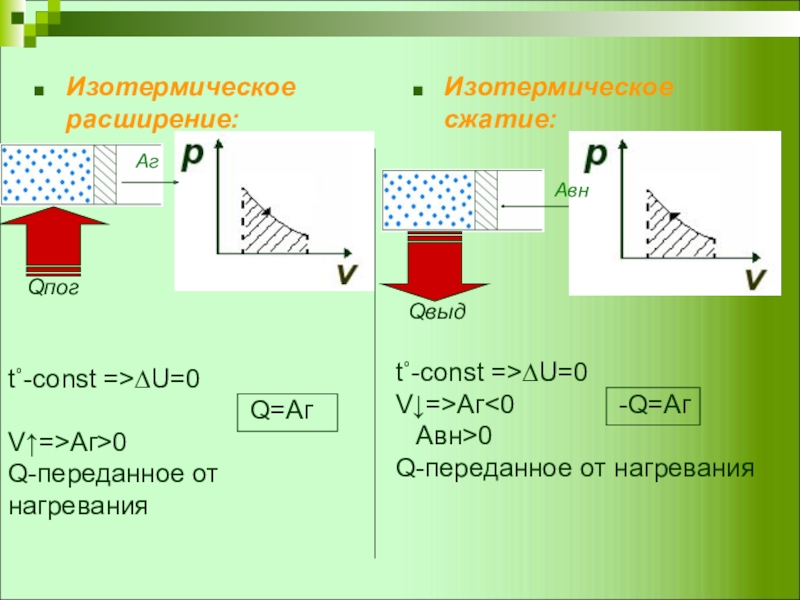
Слайд 7Изотермическое расширение:
Изотермическое сжатие:
t˚-const =>∆U=0
Q=Аг
V↑=>Аг>0
Q-переданное от нагревания
V↑=>Аг>0
Q-переданное от нагревания
t˚-const =>∆U=0
V↓=>Аг<0 -Q=Аг
Aвн>0
Q-переданное от нагревания
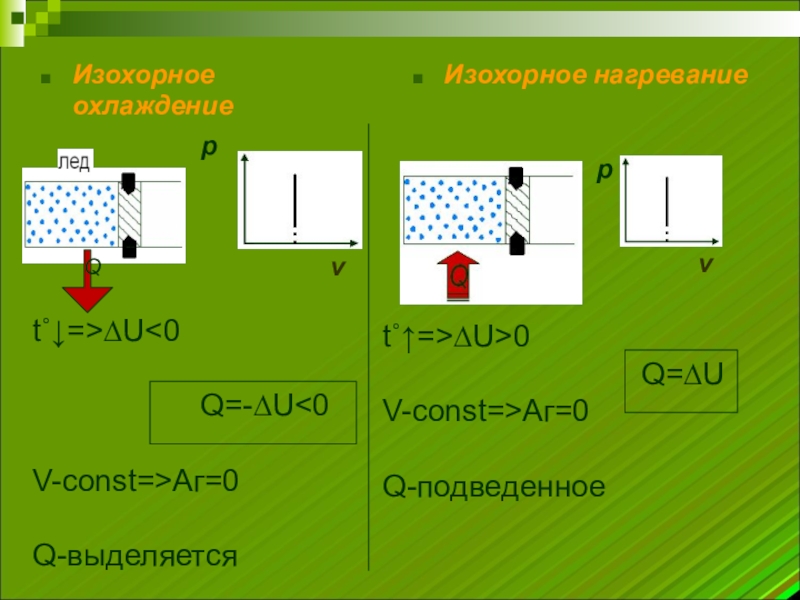
Слайд 8Изохорное охлаждение
Изохорное нагревание
t˚↓=>∆U
Q=-∆U<0
V-const=>Аг=0
Q-выделяется
V-const=>Аг=0
Q-выделяется
t˚↑=>∆U>0
Q=∆U
V-const=>Аг=0
Q-подведенное
Q
Слайд 9№674 (Степанова)
Для изобарного нагревания газа в количестве 800 моль на 500
К ему сообщили количество теплоты 9,4 МДж . Определите работу газу и приращение его внутренней энергии.
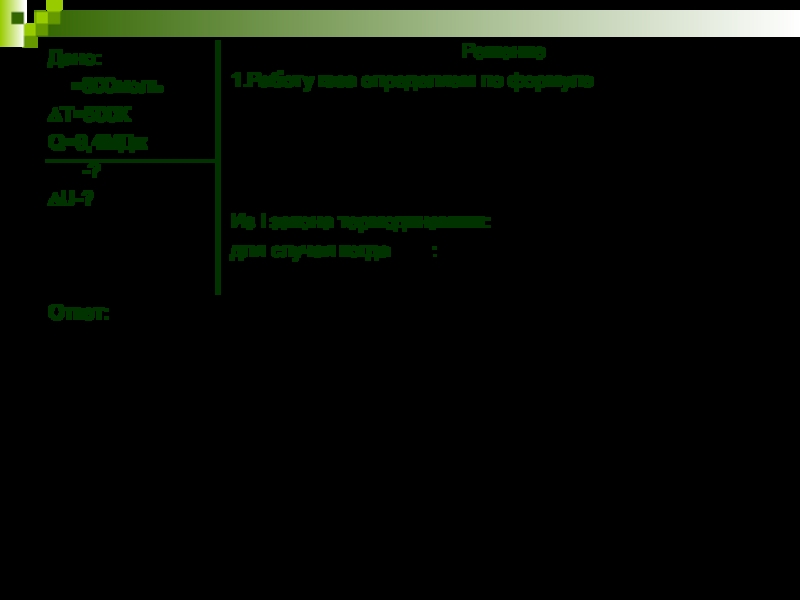
Слайд 10Дано:
=800моль
∆Т=500К
Q=9,4МДж
-?
∆U-?
Ответ:
Решение
1.Работу газа определяем по формуле
Из I
закона термодинамики:
для случая когда :
для случая когда :