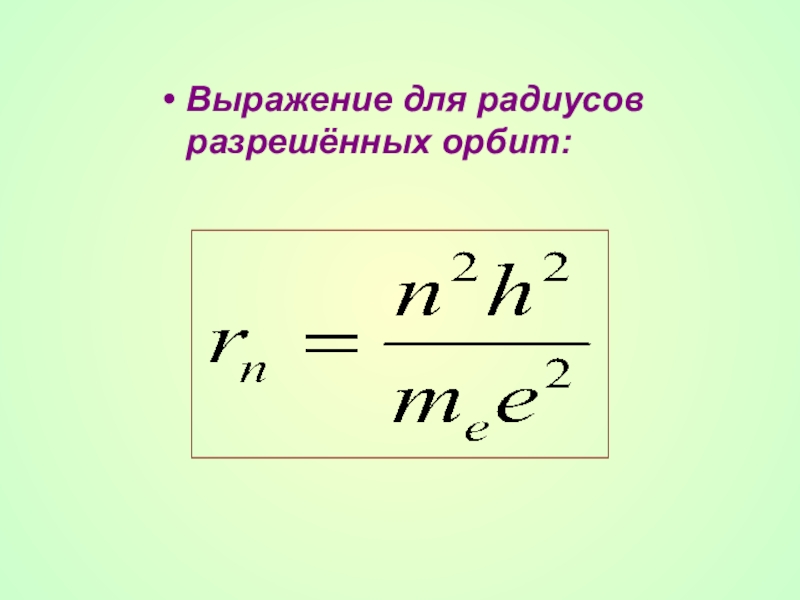- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на темк Строение атома (11 класс)
Содержание
- 1. Презентация по физике на темк Строение атома (11 класс)
- 2. “Отыщи всему начало и ты многое поймёшь” Козьма Прутков
- 3. Атом - именно это понятие было введено древнегреческим ученым Левкиппом для обозначения мельчайших единиц бытия.
- 4. Начальные представления о строении атомаДемокрит(ок.460 – 370
- 5. Доказана реальность существования атомовЛомоносовМихаил Васильевич(1711-1765) ЛавуазьеАнтуан Лоран(1743-1794)
- 6. 1833г. Исследование явления электролизаФарадейМайкл(1791-1867)Ток в растворе электролита
- 7. 1885 г.Исследование линейчатых спектровОткрыты дискретные спектральные линии
- 8. 1896 г.Соли урана являются источником неизвестного излученияБеккерельАнтуан Анри(1852-1908)Открыто явление радиоактивности
- 9. Склодовская-КюриМария(1867-1934)Кюри Пьер(1859-1906)
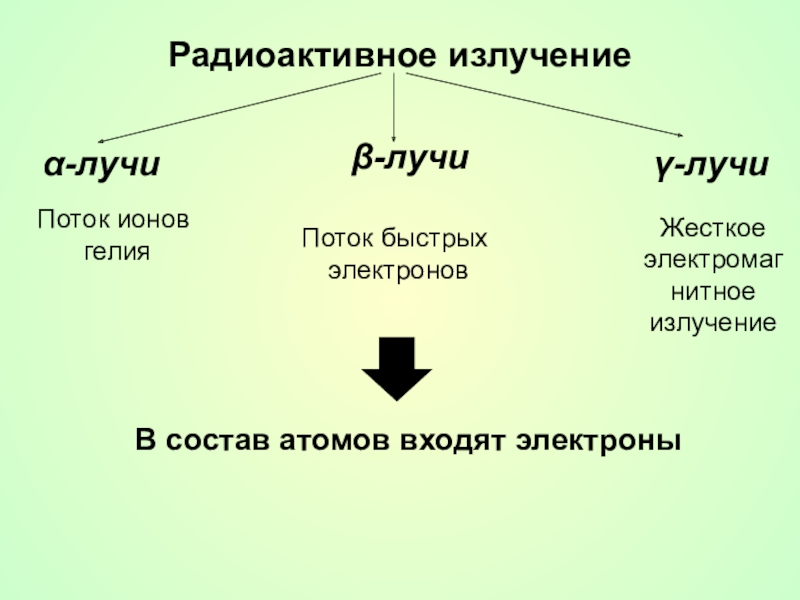
- 10. Радиоактивное излучениеα-лучиβ-лучиγ-лучиПоток ионов гелия Поток быстрых электроновЖесткое электромагнитное излучениеВ состав атомов входят электроны
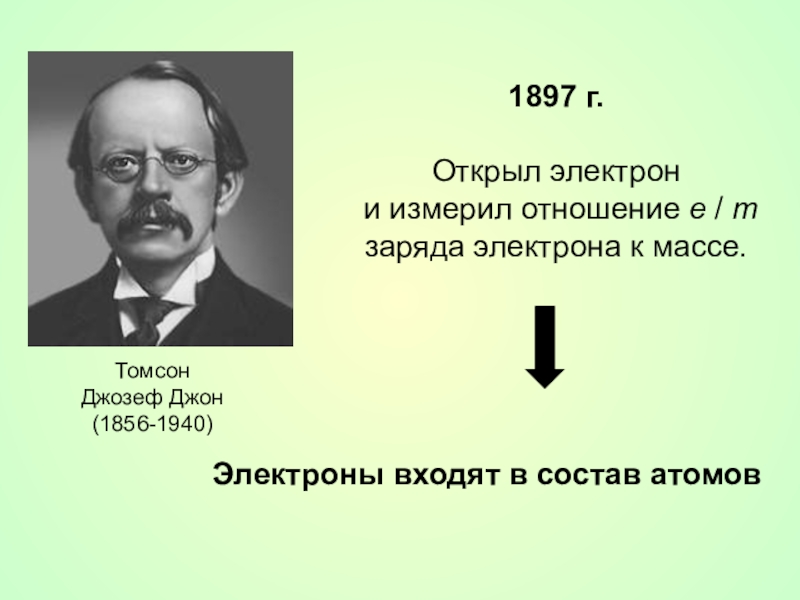
- 11. ТомсонДжозеф Джон(1856-1940)1897 г.Открыл электрон и измерил отношение
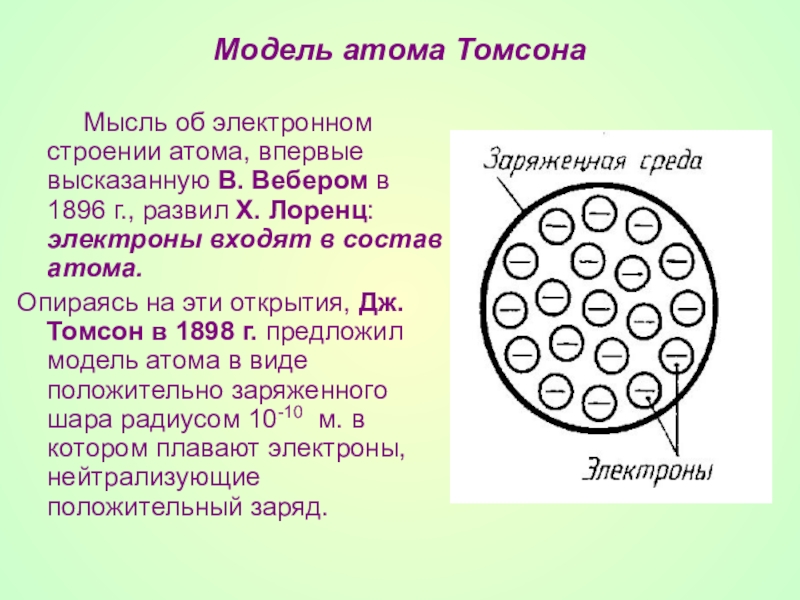
- 12. Модель атома Томсона
- 13. 1911г.Проверка состоятельности модели атома ТомсонаРезерфорд Эрнест(1871-1937)
- 14. Ядерная модель атомаЭкспериментальная проверка модели Томсона была
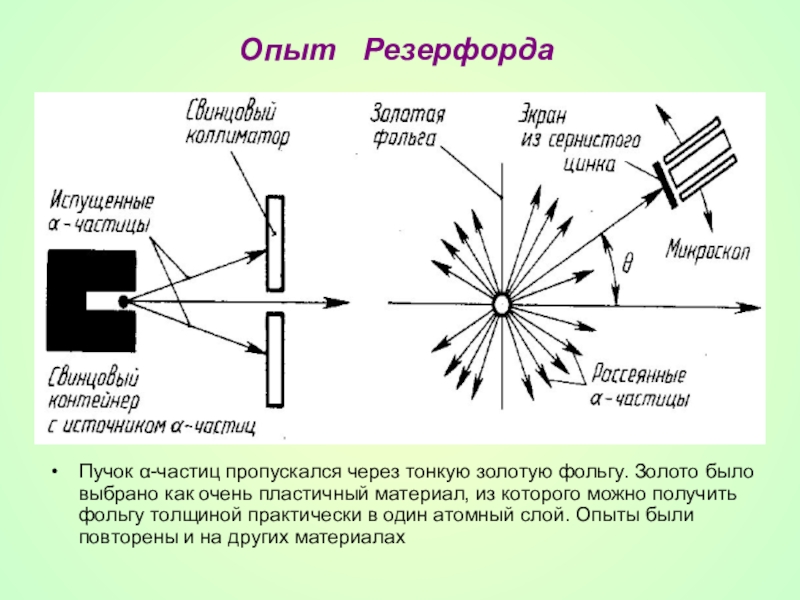
- 15. Опыт РезерфордаПучок α-частиц пропускался через тонкую
- 16. Выводы из опыта Резерфорда Э. Резерфорд
- 17. Атом по Резерфорду это положительно заряженное
- 18. Размеры атома и ядраРадиус атома R ≈ 10-10 мРадиус ядра R ≈ 10-15 м
- 19. Недостатки планетарной модели
- 20. «Перед нами - безумная теория. Вопрос в том, достаточно ли она безумна, чтобы быть верной?» Нильс Бор
- 21. I постулат - постулат стационарных состояний:В атоме существуют стационарные
- 22. II постулат - правило частот:При переходе атома из одного
- 23. Здесь (Ek - En) - разность
- 24. При поглощении атомом кванта энергии (фотона) атом
- 25. Модель атома водорода по БоруСвои постулаты Н.
- 26. Правило квантования орбит:Электроны могут двигаться в атоме
- 27. Выражение для радиусов разрешённых орбит:
- 28. Квантованные значения радиусов орбит:
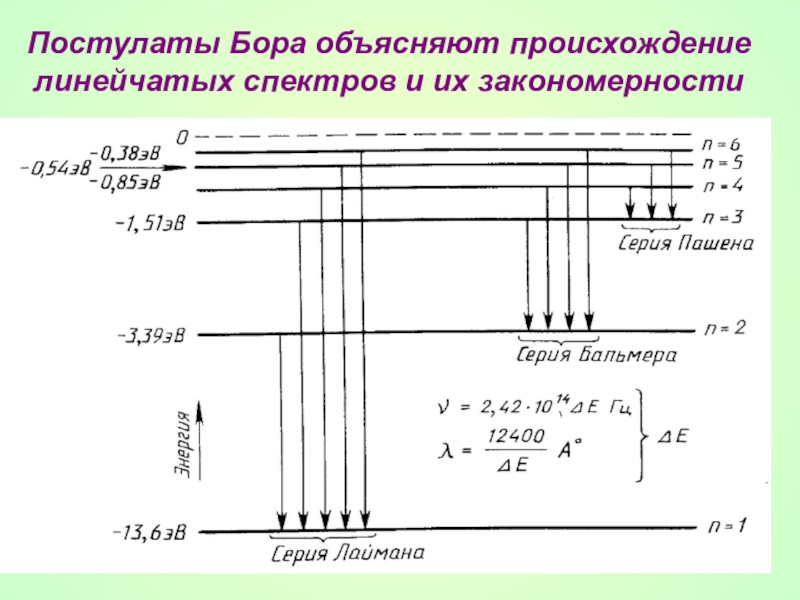
- 29. Постулаты Бора объясняют происхождение линейчатых спектров и их закономерности
- 30. Слайд 30
- 31. По второму постулату Бора возможные частоты
- 32. В спектре водорода обнаружены следующие серии: n
- 33. P.S. Надо помнить!Однако, надо помнить, что для атомов с
- 34. Трудности теории Бора Правило квантования
- 35. «Границ научному познанию и предсказанию предвидеть невозможно» Д.И.Менделеев
- 36. Это интересно)Атом – это ядро из протонов и
- 37. В 1908 году знаменитый физик Эрнест Резерфорд сказал, что
- 38. Английский физик Э. Резерфорд в 1911 году уже знал это,
Слайд 3
Атом - именно это понятие было введено древнегреческим ученым Левкиппом для обозначения мельчайших единиц бытия.
Слайд 4Начальные представления о строении атома
Демокрит
(ок.460 – 370 до н.э.)
Вещества состоят из
(атомос (греч.)- неделимый)
Слайд 5Доказана реальность существования атомов
Ломоносов
Михаил Васильевич
(1711-1765)
Лавуазье
Антуан Лоран
(1743-1794)
Слайд 61833г.
Исследование явления электролиза
Фарадей
Майкл
(1791-1867)
Ток в растворе электролита это упорядоченное движение заряженных частиц
В состав атомов входят заряженные частицы
Элементарный электрический заряд
e = 1,60·10–19 Кл
Слайд 71885 г.
Исследование линейчатых спектров
Открыты дискретные спектральные линии в излучении атомов водорода
Бальмер
Иоганн Якоб
(1825-1898)
Атомы имеют сложную структуру
Слайд 81896 г.
Соли урана являются источником неизвестного излучения
Беккерель
Антуан Анри
(1852-1908)
Открыто явление радиоактивности
Слайд 10Радиоактивное излучение
α-лучи
β-лучи
γ-лучи
Поток ионов
гелия
Поток быстрых
электронов
Жесткое электромагнитное излучение
В состав атомов
Слайд 11Томсон
Джозеф Джон
(1856-1940)
1897 г.
Открыл электрон
и измерил отношение e / m заряда электрона к
Электроны входят в состав атомов
Слайд 12Модель атома Томсона
Мысль об электронном строении
Опираясь на эти открытия, Дж. Томсон в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10-10 м. в котором плавают электроны, нейтрализующие положительный заряд.
Слайд 14Ядерная модель атома
Экспериментальная проверка модели Томсона была осуществлена в 1911 г.
Идея опыта заключалась в изучении рассеяния α-частиц (заряд +2е, масса 6,64*10-27 кг) на атомах. α-частицы были выбраны, т.к. их кинетическая энергия много больше кинетической энергии электронов (β-лучи) и, в отличие от γ-лучей они имеют электрический заряд.
Слайд 15Опыт Резерфорда
Пучок α-частиц пропускался через тонкую золотую фольгу. Золото было
Слайд 16Выводы из опыта Резерфорда
Э. Резерфорд и его помощники обнаружили,
Резерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома:
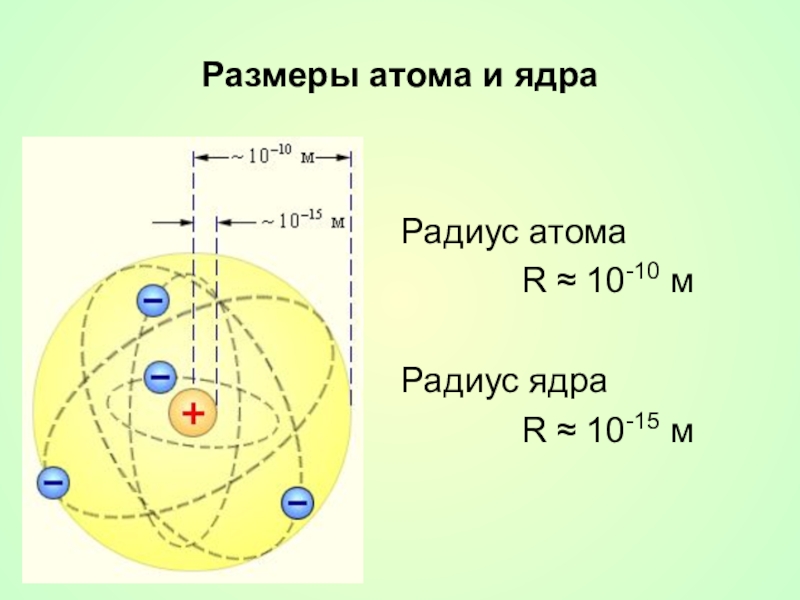
Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (~ 10-15 м).
В ядре сконцентрирована почти вся масса атома.
Отрицательный заряд всех электронов распределен по всему объему атома и компенсирует положительный заряд ядра.
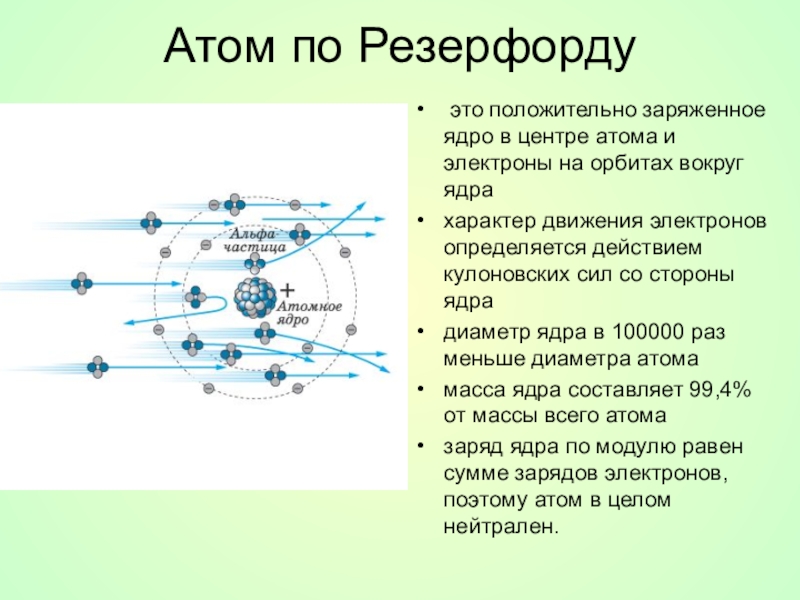
Слайд 17Атом по Резерфорду
это положительно заряженное ядро в центре атома и
характер движения электронов определяется действием кулоновских сил со стороны ядра
диаметр ядра в 100000 раз меньше диаметра атома
масса ядра составляет 99,4% от массы всего атома
заряд ядра по модулю равен сумме зарядов электронов, поэтому атом в целом нейтрален.
Слайд 19Недостатки планетарной модели
Предложенная модель строения
ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро (расчет показывает, что это должно произойти за 10-8 с), так как при движении по спирали уменьшается энергия электрона, в действительности атомы являются устойчивыми системами;
спектр излучения при этом должен быть непрерывным (должны присутствовать все длины волн). На опыте спектр получается линейчатым;
нет ответа на вопрос о строении ядра. Если в него входят только положительные частицы, то почему они не отталкиваются?
Слайд 20«Перед нами - безумная теория.
Вопрос в том, достаточно ли она безумна, чтобы быть
Нильс Бор
Слайд 21I постулат - постулат стационарных состояний:
В атоме существуют стационарные квантовые состояния, не изменяющиеся
В этих состояниях атом не излучает электромагнитных волн, хотя и движется с ускорением.
Каждому стационарному состоянию атома соответствует определенная энергия атома. Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны
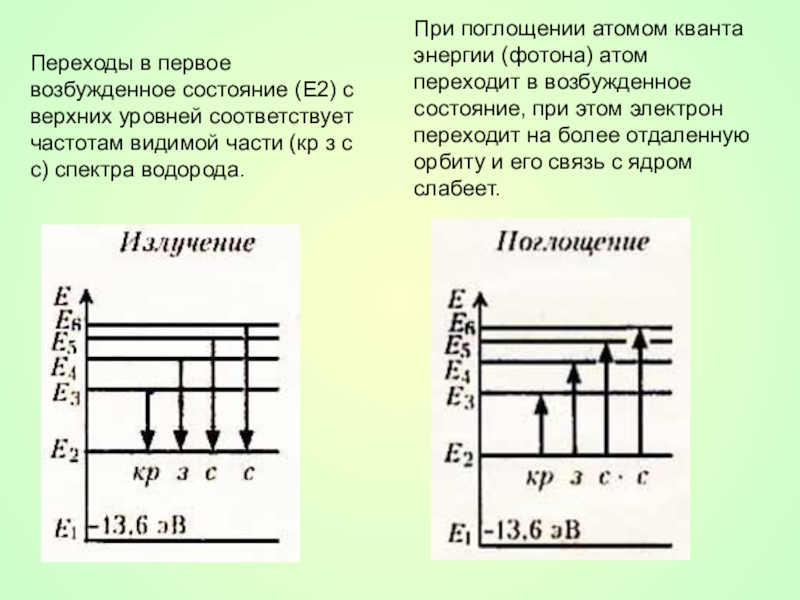
Слайд 22II постулат - правило частот:
При переходе атома из одного стационарного состояния в другое
Слайд 23 Здесь (Ek - En) - разность энергий стационарных состояний. При Ек > Eп происходит
где k и n - номера стационарных состоянии, или главные квантовые числа. б) Атом поглощает 1 фотон, когда переходит из стационарного состояния с меньшей энергией (E n) в стационарное состояние с большей энергией (E k).
При Ек < Еn происходит поглощение фотона.
Слайд 24При поглощении атомом кванта энергии (фотона) атом переходит в возбужденное состояние,
Переходы в первое возбужденное состояние (Е2) с верхних уровней соответствует частотам видимой части (кр з с с) спектра водорода.
Слайд 25Модель атома водорода по Бору
Свои постулаты Н. Бор применил для построения
Слайд 26Правило квантования орбит:
Электроны могут двигаться в атоме только по определённым орбитам,
где rn - радиус n-ой орбиты; vn - скорость электрона на этой орбите; me - масса электрона, п - целое число - номер орбиты или главное квантовое число.
Слайд 31
По второму постулату Бора возможные частоты излучения водорода равны:
где R –
n и k – номера орбит.
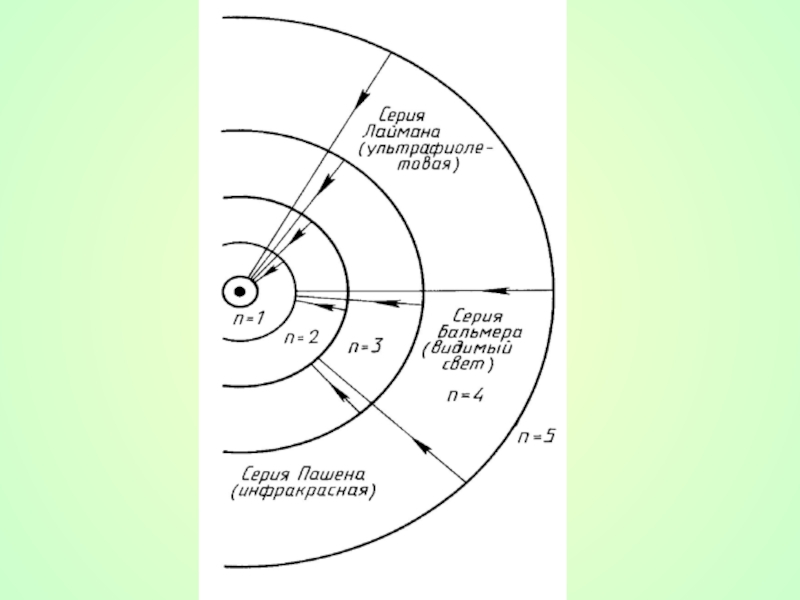
Слайд 32В спектре водорода обнаружены следующие серии:
n = I - серия Лаймана
n = 2 - серия Бальмера (1885г.) - видимое излучение
n = 3 - серия Пашена - инфракрасное излучение
и т.д.
Слайд 33P.S. Надо помнить!
Однако, надо помнить, что для атомов с большим числом электронов (
Точнее, электрон на орбите можно назвать электронным облаком, имеющим разную плотность. Орбитой электрона в атоме называется геометрическое место точек, в которых с наибольшей вероятностью можно обнаружить электрон.
Слайд 34Трудности теории Бора
Правило квантования Бора применимо не всегда,
В 1917 г. А. Эйнштейн предсказал возможность перехода атома с высшего энергетического состояния в низшее под влиянием внешнего воздействия. Такое излучение называется вынужденным излучением и лежит в основе работы лазеров.
Слайд 36Это интересно)
Атом – это ядро из протонов и нейтронов, вокруг которого вращаются
Нейтронные звезды – остатки сверхновых, которые являются фактически огромными атомными ядрами, состоящими на 90% из нейтронов и на 10% из протонов, и окружены «атмосферой» из электронов.
Слайд 37В 1908 году знаменитый физик Эрнест Резерфорд сказал, что он имел дело со
В 1908 году Э. Резерфорд получил Нобелевскую премию по химии за свои работы в области изучения атома. В те годы исследования по строению атома и радиоактивности относили к химии.
Слайд 38Английский физик Э. Резерфорд в 1911 году уже знал это, но на Сольвеевском конгрессе
катастрофе.
Через два года он получил пакет от датского физика Нильса Бора из Копенгагена, который подтвердил правильность его открытия.
Их современник, оценивая сложившуюся ситуацию, писал: "Это было так, точно из-под ног ушла земля, и нигде не было видно твердой почвы, на которой можно было строить...".
Речь идет о планетарной модели атома Резерфорда и об открытиях Н. Бора, все это свидетельствовало о катастрофе классической физики!