- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике к итоговому уроку по теме Молекулярная физика
Содержание
- 1. Презентация по физике к итоговому уроку по теме Молекулярная физика
- 2. ОСНОВНЫЕ ПОНЯТИЯ, ЗАКОНЫ И ФОРМУЛЫ МОЛЕКУЛЯРНОЙ
- 3. Математическая модель – это приближенное описание
- 4. При изучении явлений в природе и технической
- 5. Основные положения МКТВсе вещества – жидкие, твердые
- 6. 1.Модели строения газов, жидкостей и твердых В
- 7. 2.Тепловое движение атомов и молекул Тепловое
- 8. Установите соответствие:1. Молекулы движутся с огромными скоростями.2.
- 9. 3.Броуновское движение Броуновское движение - это тепловое
- 10. 4. ДиффузияДИФФУЗИЯ – это взаимное проникновение молекул
- 11. 5.Взаимодействие частиц веществаНа очень малых расстояниях между
- 12. 6.ИДЕАЛЬНЫЙ ГАЗ Известно, что частицы в
- 13. Реальный газ можно считать идеальным, если он сильно разрежен и хорошо нагретводород гелий
- 14. Идеальный газ (модель)1. Совокупность большого числа
- 15. Модель идеального газаВ кинетической модели идеального газа
- 16. Какие параметры, характеризующие газ и процессы, проходящие в нем, называются микроскопическими параметрами (микропараметрами)
- 17. МикропараметрыМоль – это количество вещества, содержащее столько
- 18. Температуру, объем, давление и некоторые другие параметры
- 19. 7.Связь между давлением и средней кинетической энергией
- 20. Среднеквадратичная скоростьТак как движение молекул газа хаотическое,
- 21. Средняя квадратичная скорость движения молекул
- 22. Среднее значение квадрата скорости молекул В
- 23. Уравнение состояния - первое из замечательных обобщений
- 24. Вывод основного уравнения МКТ
- 25. Основное уравнение идеального газа
- 26. Слайд 26
- 27. Задача: Каково давление азота, если
- 28. Задача: При температуре – 27о С давление
- 29. 8.Абсолютная температура
- 30. 9.Абсолютная температура как мера средней кинетической
- 31. Средняя кинетическая энергия хаотического движения молекул газа
- 32. Давление газаВследствие теплового движения, частицы газа время
- 33. Зависимость давления идеального газа от:Массы молекулКонцентрации молекулСкорости движения молекул
- 34. Слайд 34
- 35. Слайд 35
- 36. Слайд 36
- 37. Слайд 37
- 38. Слайд 38
- 39. Основное уравнение МКТ идеального газа.
- 40. Связь давления со средней кинетической энергией
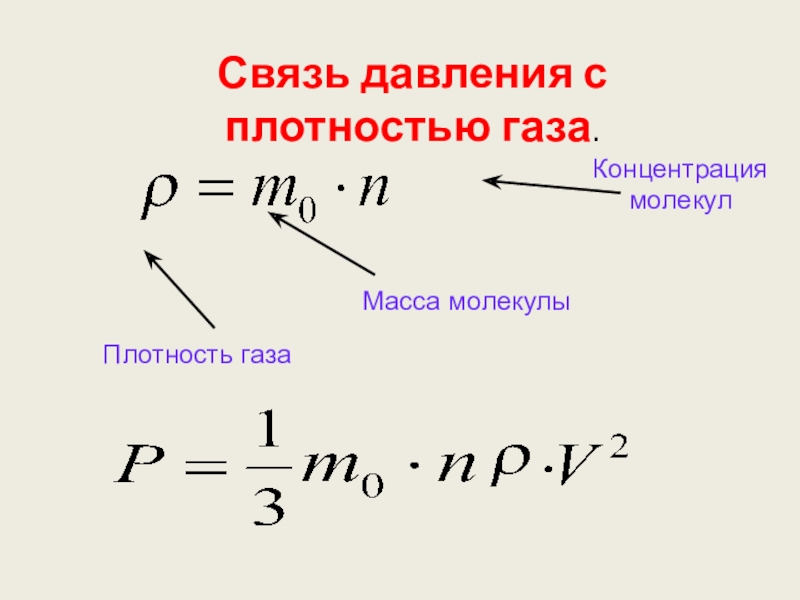
- 41. Связь давления с плотностью газа.
- 42. Воспользуйтесь формулой :Плотность
- 43. Сначала найдите плотность газа по формуле:А потом выразите скорость движения молекул из формулы:
- 44. Средняя кинетическая энергия поступательного движения молекулы
- 45. Анализ уравненияЧем больше масса частиц, тем больше
- 46. Задачи1. Как измениться давление газа при уменьшении
- 47. Задача С3-6. При температуре 10 °С
- 48. 10.Уравнение Менделеева-Клапейрона
- 49. Уравнение Менделеева-Клапейрона Произведение постоянной Авогадро NA на
- 50. Вопросы 1. Каковы нормальные условия для идеального
- 51. Как изменится давление газа на стенки сосуда,
- 52. Решение:Ответ: V=707 м/с
- 53. Задача.Одноатомный идеальный газ неизменной массы совершает циклическийпроцесс,
- 54. Слайд 54
- 55. Задача. Как изменится температура идеального газа, если
- 56. 11. Изопроцессы: изотермический, изохорный, изобарный, адиабатный
- 57. 2013 Очер Бавкун Т.Н.Газовые законы рассматриваются для
- 58. Изотермический процесс -Vр1р2процесс изменения состояния термодинамической системы
- 59. Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессыИзотермический процесс
- 60. Слайд 60
- 61. Изобарный процесспроцесс изменения состояния термодинамической системы
- 62. Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессыИзобарным процессом
- 63. Слайд 63
- 64. Изохорный процесспроцесс изменения состояния термодинамической системы
- 65. Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессыИзохорный процесс
- 66. Слайд 66
- 67. Графическое изображение процессовГрафиком изотермического процесса является
- 68. Дан график цикла. Пользуясь им, ответь на
- 69. 2. Решите задачу:При температуре – 27о С
- 70. Задача . Один моль идеального одноатомного
- 71. Насыщенный пар – это идеальный газ, масса
- 72. Насыщенные и ненсыщенные парыВ закрытом сосуде жидкость
- 73. 1. При длительном нахождении пара в контактео
- 74. 2. Давление (и плотность) насыщенного пара не
- 75. 3. Давление (плотность) насыщенного пара очень сильно
- 76. 4. Кипение жидкости начинается при такой температуре,
- 77. Приборы для измерения влажности
- 78. ПСИХРОМЕТРИЧЕСКАЯ ТАБЛИЦА
- 79. - это величина, равная отношению массы пара
- 80. ОТНОСИТЕЛЬНАЯ ВЛАЖНОСТЬэто – отношение абсолютной влажности пара
- 81. ОТНОСИТЕЛЬНАЯ ВЛАЖНОСТЬМаксимальная относительная влажность равна 1, или
- 82. Задача 1 Качественная задача на основные
- 83. Решение. Так как пар и вода находятся
- 84. Задача 2 Взаимосвязь параметров насыщенного и ненасыщенного пара.Какова плотность насыщенного пара при температуре 100 °С?
- 85. Решение. При нормальном давлении (р = 105Па)
- 86. Задача 3 Знание определения относительной влажности. Какова
- 87. Решение. Из таблицы берём значение абсолютной влажности
- 88. Задача 4Изменение относительной влажности воздуха. Масса испаряемой
- 89. Решение. Найдём массу пара при заданной температуре
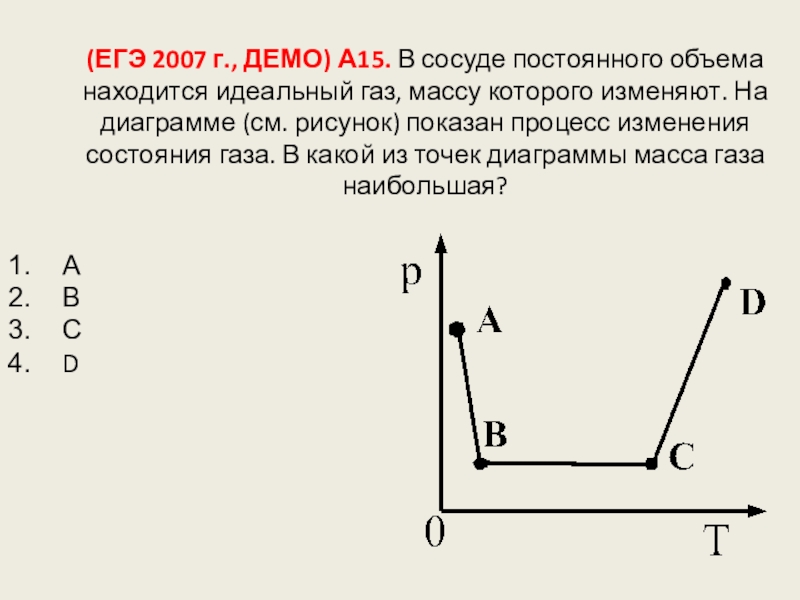
- 90. 14.Изменение агрегатных состояний вещества: испарение и конденсация,
- 91. 14.Изменение агрегатных состояний вещества: испарение и
- 92. Изменение агрегатных состояний вещества: испарение и
- 93. 15.Изменение агрегатных состояний вещества: плавление и
- 94. Молекулярно-кинетическая теория. Основные формулыОсновы молекулярно-кинетической теории: NA
- 95. Молекулярно-кинетическая теория. Основные формулыИзотермический процесс (закон Бойля-Мариотта):Изохорный
- 96. Словарь по Молекулярной Физике и Тепловым ЯвлениямАбсолютная
- 97. Словарь по Молекулярной Физике и Тепловым ЯвлениямДеформация
- 98. Словарь по Молекулярной Физике и Тепловым ЯвлениямИдеальный
- 99. Словарь по Молекулярной Физике и Тепловым ЯвлениямПарообразование
- 100. Словарь по Молекулярной Физике и Тепловым ЯвлениямТвердые
- 101. Словарь по Молекулярной Физике и Тепловым ЯвлениямУдельная
- 102. (ЕГЭ 2001 г., Демо) А13. Экспериментально исследовалось,
- 103. (ЕГЭ 2001 г., Демо) А14. Испарение жидкости
- 104. (ЕГЭ 2001 г., Демо) А15. Тела, имеющие
- 105. (ЕГЭ 2002 г., Демо) А8. Какой из
- 106. 2002 г. А9 (КИМ). В баллоне находится 6 моль газа. Сколько примерно молекул газа находится в баллоне?
- 107. (ЕГЭ 2002 г., Демо) А13. При испарении
- 108. 2002 г. А13 (КИМ). При сжатии идеального
- 109. 2002 г. А29 (КИМ). Идеальный газ сначала
- 110. (ЕГЭ 2002 г., Демо) А30. Какова температура
- 111. (ЕГЭ 2003 г., КИМ) А8. Диффузия происходит
- 112. (ЕГЭ 2003 г., КИМ) А9. При неизменной
- 113. (ЕГЭ 2003 г., КИМ) А10. На рисунке
- 114. (ЕГЭ 2003 г., КИМ) А13. Температура
- 115. (ЕГЭ 2003 г., КИМ) А14. На рисунке
- 116. (ЕГЭ 2004 г., демо) А7. Давление идеального
- 117. (ЕГЭ 2004 г., демо) А23. При переходе
- 118. (ЕГЭ 2004 г., демо) А24. Идеальному газу
- 119. (ЕГЭ 2005 г., ДЕМО) А11. Как изменяется
- 120. (ЕГЭ 2005 г., ДЕМО) А13. Парциальное
- 121. (ЕГЭ 2006 г., ДЕМО) А9. Лед при
- 122. (ЕГЭ 2006 г., ДЕМО) А10. При какой
- 123. (ЕГЭ 2006 г., ДЕМО) А11. Абсолютная температура
- 124. (ЕГЭ 2006 г., ДЕМО) А27. Экспериментаторы закачивают
- 125. ЕГЭ – 2006, ДЕМО. А 28. В
- 126. (ЕГЭ 2007 г., ДЕМО) А15. В сосуде
- 127. (ЕГЭ 2007 г., ДЕМО) А13. На графике
- 128. (ЕГЭ 2007 г., ДЕМО) А13. На графике
- 129. (ЕГЭ 2008 г., ДЕМО) А11. На фотографии
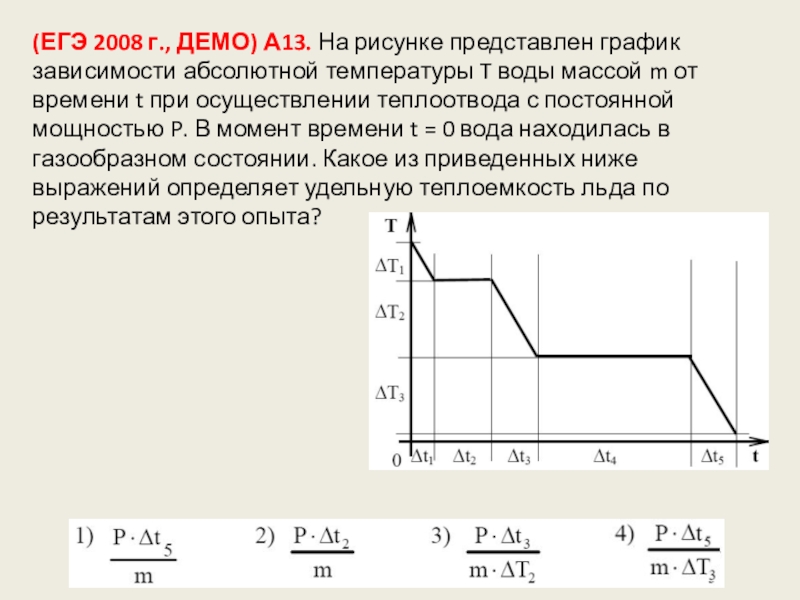
- 130. (ЕГЭ 2008 г., ДЕМО) А13. На рисунке
- 131. (ЕГЭ 2009 г., ДЕМО) А8. При понижении
- 132. (ЕГЭ 2009 г., ДЕМО) А12. В сосуде
- 133. (ЕГЭ 2010 г., ДЕМО) А9. На рисунке
- 134. Используемая литератураБерков, А.В. и др. Самое полное
Слайд 1МОЛЕКУЛЯРНАЯ ФИЗИКА
Работу выполнила : Серова
Учитель физики ГБОУ СШ № 578
Приморского района
г. Санкт-Петербург
Слайд 2ОСНОВНЫЕ ПОНЯТИЯ, ЗАКОНЫ И ФОРМУЛЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ В СООТВЕТСТВИИ С
Модели строения газов, жидкостей и твердых
Тепловое движение атомов и молекул
Броуновское движение
Диффузия
Взаимодействие частиц вещества
Модель идеального газа
Связь между давлением и средней кинетической энергией теплового движения молекул идеального газа
Абсолютная температура
Абсолютная температура как мера средней кинетической энергии его частиц
Уравнение Менделеева-Клапейрона
Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Насыщенные и ненасыщенные пары
Влажность воздуха
Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Изменение агрегатных состояний вещества: плавление и кристаллизация
Слайд 3
Математическая модель – это приближенное описание какого-либо класса явлений или
Слайд 4При изучении явлений в природе и технической практике невозможно учесть все
Слайд 5Основные положения МКТ
Все вещества – жидкие, твердые и газообразные – образованы
Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества.
В основе молекулярно-кинетической теории лежат
три основных положения:
Слайд 61.Модели строения газов, жидкостей и твердых
В твердых телах молекулы совершают
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
В газах расстояния между молекулами обычно значительно больше их размеров, каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда.
Слайд 72.Тепловое движение атомов и молекул
Тепловое движение атомов в твердых телах:
Тепловое
Тепловое движение молекул в газе:
Беспорядочное хаотическое движение молекул называется тепловым движением.
Слайд 8Установите соответствие:
1. Молекулы движутся с огромными скоростями.
2. Тела сохраняют форму и
3. Атомы колеблются около положения равновесия.
4.Расстояние между молекулами превышает размер молекул.
5.Молекулы колеблются, периодически перескакивая на новое место.
6. Тела сохраняют форму, но не сохраняют объем.
А. Твердые тела.
Б. Жидкости.
В. Газы.
Ответы:
1-В
2-А
3-А
4-В
5-Б
6-Б
Слайд 93.Броуновское движение
Броуновское движение - это тепловое движение мельчайших частиц,
Броуновское движение :
Броуновская частица среди молекул:
Траектория движения проникновения двух или нескольких соприкасающихся веществ друг в друга.3-х броуновских частиц :
Слайд 104. Диффузия
ДИФФУЗИЯ – это взаимное проникновение молекул одного вещества в межмолекулярные
Диффузия приближает систему к состоянию термодинамического равновесия
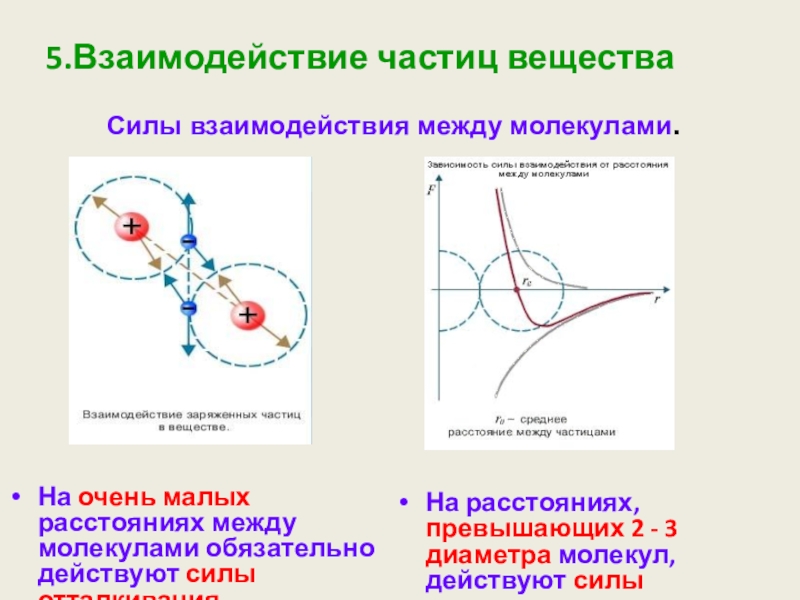
Слайд 115.Взаимодействие частиц вещества
На очень малых расстояниях между молекулами обязательно действуют силы
На расстояниях, превышающих 2 - 3 диаметра молекул, действуют силы притяжения.
Силы взаимодействия между молекулами.
Слайд 12
6.ИДЕАЛЬНЫЙ ГАЗ
Известно, что частицы в газах, в отличие от
идеальный газ
Слайд 14Идеальный газ (модель)
1. Совокупность большого числа молекул массой m0, размерами
2. Молекулы находятся на больших расстояниях друг от друга и движутся хаотически.
3. Молекулы взаимодействуют по законам упругих столкновений , силами притяжения между молекулами пренебрегают.
4. Скорости молекул разнообразны, но при определенной температуре средняя скорость молекул остается постоянной.
5. Для отдельно взятой молекулы справедливы законы Ньютона.
Реальный газ
1. Молекулы реального газа не являются точечными образованиями, диаметры молекул лишь в десятки раз меньше расстояний между молекулами.
2. Молекулы не взаимо- действуют по законам упругих столкновений.
Слайд 15Модель идеального газа
В кинетической модели идеального газа молекулы рассматриваются как идеально
Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ.
Микроскопические параметры (масса, скорость, кинетическая энергия молекул)
Макроскопическими параметрами (давление, газ, температура)
Слайд 16Какие параметры, характеризующие газ и процессы, проходящие в нем, называются микроскопическими
Слайд 17Микропараметры
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько
в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА: NА = 6,02·1023 моль–1.
Массу одного моля вещества принято называть молярной массой M.
Молярная масса выражается в килограммах на моль (кг/моль)
Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12C называется относительной массой.
Слайд 18Температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния
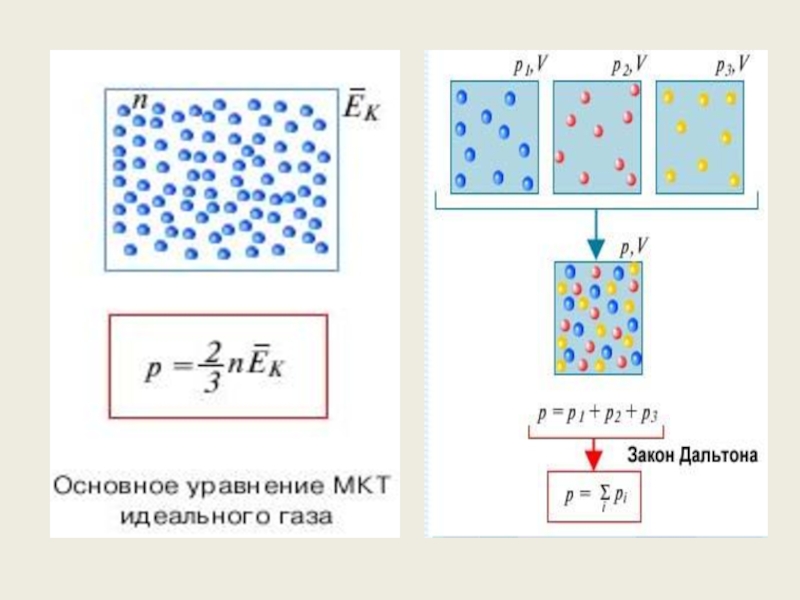
Слайд 197.Связь между давлением и средней кинетической энергией теплового движения молекул идеального
Давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема
p = nkT,
где n = N / V – концентрация молекул (т. е. число молекул в единице объема сосуда)
k –постоянной Больцмана, в честь австрийского физика. Ее численное значение в СИ равно:
k = 1,38·10–23 Дж/К.
Закон Дальтона: давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений
p = p1 + p2 + p3 + … = (n1 + n2 + n3 + …)kT.
Основное уравнение МКТ газов.
Слайд 20Среднеквадратичная скорость
Так как движение молекул газа хаотическое, то направление и величина
Если v1 v2 v3 ….vN – скорости отдельных молекул, то сумма скоростей молекул v1 + v2 + ….. + vN = 0
Среднеквадратичная скорость [формула]
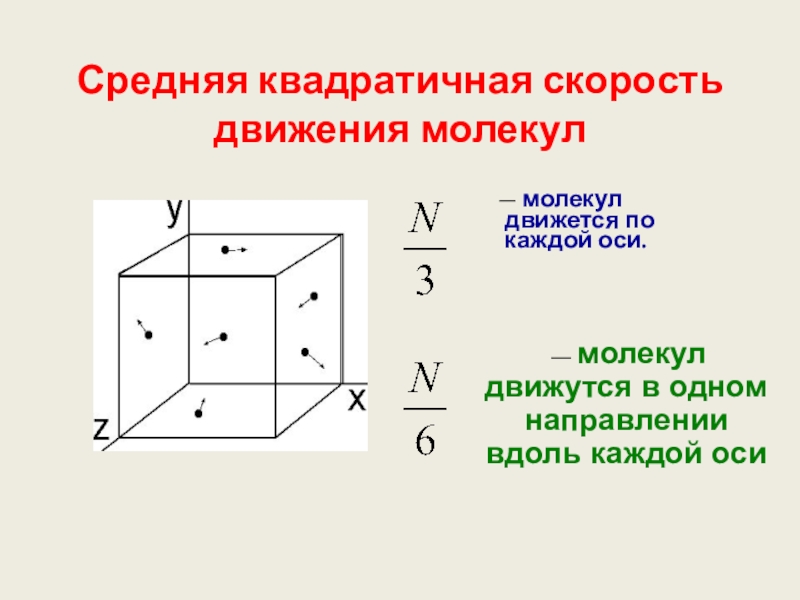
Слайд 21Средняя квадратичная скорость движения молекул
— молекул
— молекул движутся в одном направлении вдоль каждой оси
Слайд 22 Среднее значение квадрата скорости молекул
В различных газах молекулы имеют
Пусть V1, V 2, V3……. VN -,
модули скоростей молекул
Слайд 23Уравнение состояния - первое из замечательных обобщений в физике, с помощью
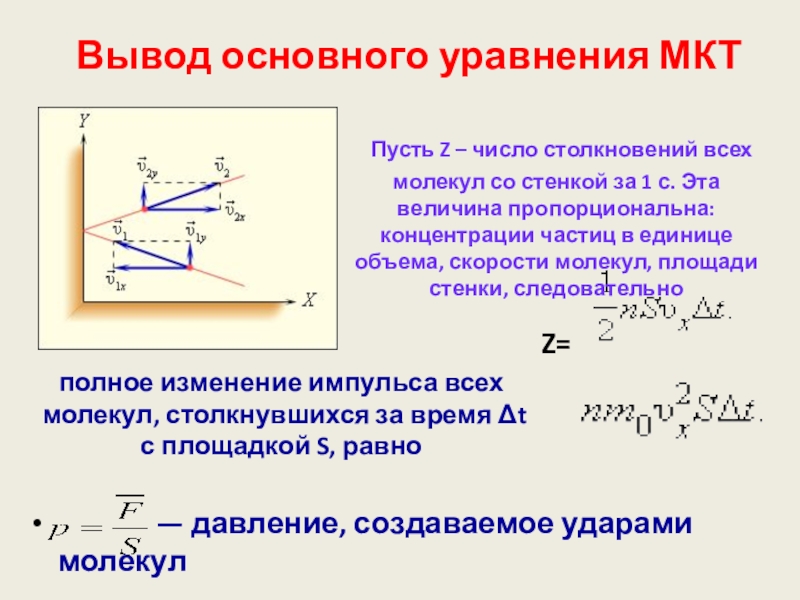
Слайд 24 Вывод основного уравнения МКТ
Пусть Z – число столкновений всех молекул со стенкой за 1 с. Эта величина пропорциональна: концентрации частиц в единице объема, скорости молекул, площади стенки, следовательно
Z=
полное изменение импульса всех молекул, столкнувшихся за время Δt с площадкой S, равно
Слайд 25 Основное уравнение идеального газа [формула]
р
m0 - масса молекулы
v – среднеквадратичная скорость
n – концентрация частиц
Слайд 27 Задача: Каково давление азота, если средняя квадратичная скорость его
Слайд 28Задача:
При температуре – 27о С давление газа в закрытом сосуде
Дано:
Т1 = 27о С
Т2 = - 13 о С
Р1 = 75 кПа
Р2 - ?
Си
300К
260 К
75000 ПА
Решение Р1/ Т1 = Р2/ Т2
Р2 =(Р1 . Т2)/ Т1
Р2 = (75000ПА . 260 К):300 К=
= 65000 Па = 65кПА
Ответ: P2 = 65 кПА
Слайд 30
9.Абсолютная температура как мера средней кинетической энергии его частиц
Тепловое равновесие
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические приборы – термометры
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K.
TК = TС + 273,15
Температурная шкала Кельвина называется абсолютной шкалой температур.
Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры, достаточно принять еще одну фиксированную опорную точку - температура тройной точки воды (0,01° С), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар - 273,16 К.
Слайд 31Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре.
Температура
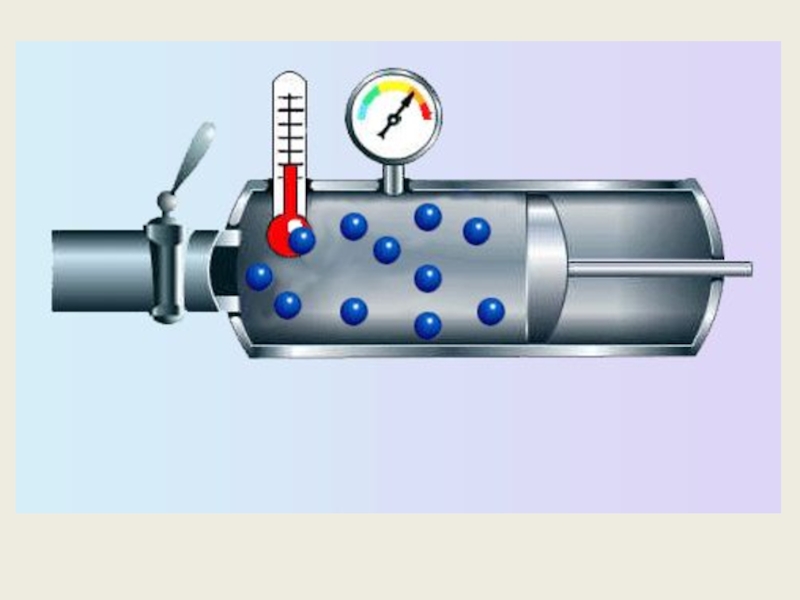
Слайд 32Давление газа
Вследствие теплового движения, частицы газа время от времени ударяются о
Давление газа
Вследствие теплового движения, частицы газа время от времени ударяются о стенки сосуда. При каждом ударе молекулы действуют на стенку сосуда с некоторой силой. Складываясь друг с другом, силы ударов отдельных частиц образуют некоторую силу давления, постоянно
Давление газа создается ударами молекул.
малые силы отдельных ударов складываются в постоянную силу давления
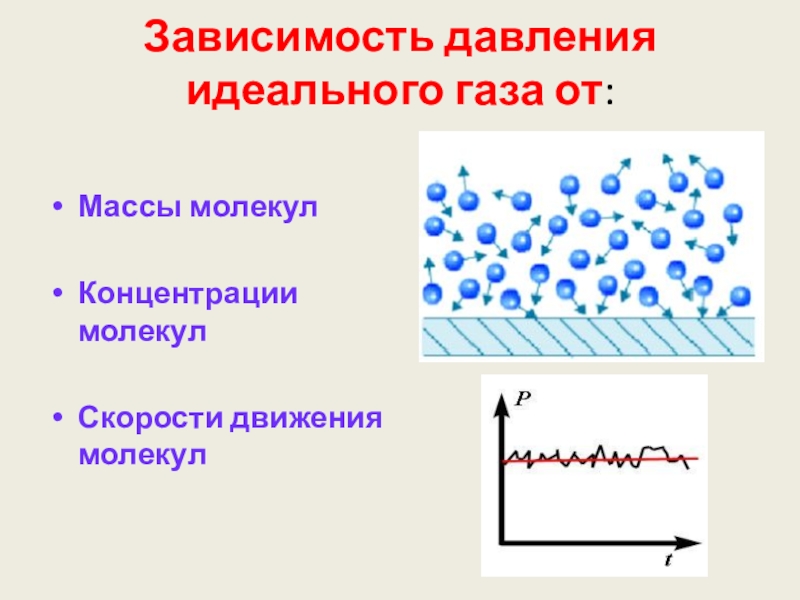
Слайд 33Зависимость давления идеального газа от:
Массы молекул
Концентрации молекул
Скорости движения молекул
Слайд 43Сначала найдите плотность газа по формуле:
А потом выразите скорость движения молекул
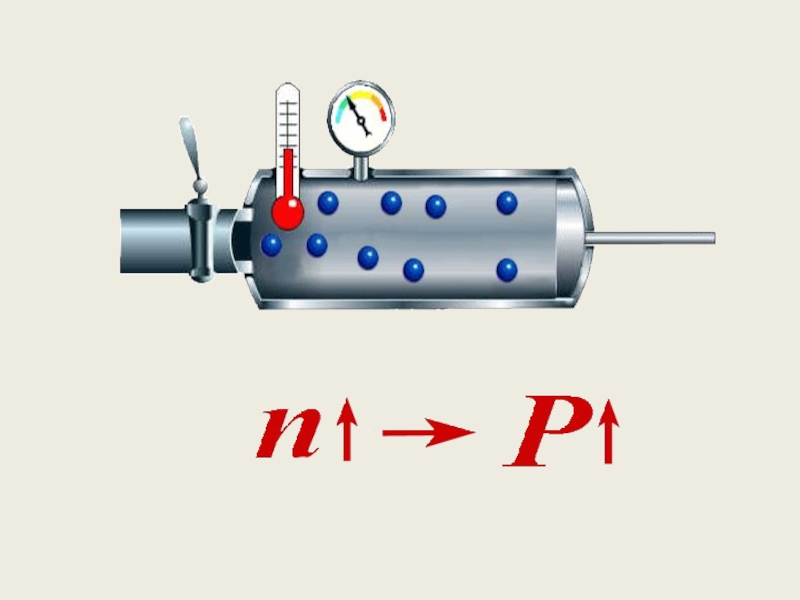
Слайд 45Анализ уравнения
Чем больше масса частиц, тем больше сила удара о стенки
Чем больше число частиц (n), тем чаще совершаются удары о стенку
Чем больше скорость частиц, тем чаще удары о стенку
Задача
Какова среднеквадратичная скорость движения молекул газа, если его масса 6кг, объём 5м³ и давление 200кПа?
Слайд 46Задачи
1. Как измениться давление газа при уменьшении в 4 раза его
2. Оцените число молекул воздуха, находящегося в классе, при нормальном атмосферном давлении и температуре 20 градус Цельсия?
3. Чему равен объем одного моля газа при нормальных условиях?
4. Вычислите отношение произведения давления на объем к данной температуре, если газ находиться при нормальных условиях
Слайд 47Задача С3-6.
При температуре 10 °С и давлении 105 Па
Слайд 49Уравнение Менделеева-Клапейрона
Произведение постоянной Авогадро NA на постоянную Больцмана k называется универсальной
R = 8,31 Дж/моль·К
Уравнение состояния идеального газа:
Закон Авогадро: один моль любого газа при нормальных условиях занимает один и тот же объем V0, равный V0 = 0,0224 м3/моль = 22,4 дм3/моль.
Для смеси невзаимодействующих газов уравнение состояния принимает вид
pV = (ν1 + ν2 + ν3 + ...)RT
где ν1, ν2, ν3 и т. д. – количество вещества каждого из газов в смеси
Уравнение состояния идеального газа.
Слайд 50Вопросы
1. Каковы нормальные условия для идеального газа?
2. Какова концентрация молекул
3. Какие величины характеризуют состояние газа?
4. Чем отличается уравнение состояния газа от уравнения Менделеева - Клапейрона? Какое из них полнее по содержанию? Почему?
5. Чему равна универсальная газовая постоянная?
Слайд 51Как изменится давление газа на стенки сосуда, если:
масса молекулы увеличится в
концентрация молекул уменьшится в 4 раза
скорость движения молекул увеличится в 2 раза
объем увеличится в 5 раз
масса молекулы уменьшится в 4 раза, а концентрация увеличится в 2 раза
масса молекулы увеличится в 2 раза, а скорость движения молекул увеличится в 3 раза
концентрация молекул увеличится в 3 раза, скорость движения молекул уменьшится в 3 раза
Слайд 53
Задача.
Одноатомный идеальный газ неизменной массы совершает циклический
процесс, показанный на рисунке. Газ
количество теплоты |Qх| = 8 кДж. Чему равна работа газа за цикл?
За цикл количество теплоты, отданное холодильнику:
|Qх| = (U2 – U3) + |A23| = (3/2)(νRT2 – νRT3) + (1/2)(p0 + 2p0) 2V0 =
= (3/2)(2p0 3V0 – p0V0) + 3p0V0 = (21/2)p0V0.
Работа газа за цикл Aц = (p0/2) 2V0 = p0V0.
Отсюда Ац = (2/21) |Qх| ≈ 760 Дж.
Ответ: Ац ≈ 760 Дж.
Слайд 55Задача. Как изменится температура идеального газа, если увеличить его объем в
Решение:
Выразим из уравнения Менделеева-Клапейрона давление p: (1). Подставим (1) в формулу, описывающую данный процесс: ; Следовательно, при увеличении объема в 2 раза температура должна понизиться в 8 раз
Слайд 56 11. Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Газовые законы рассматриваются для
Модель идеального газа предполагает следующее: молекулы обладают пренебрежимо малым объемом по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударении молекул друг с другом и со стенками сосуда действуют силы отталкивания.
Слайд 572013 Очер Бавкун Т.Н.
Газовые законы рассматриваются для идеального газа.
Модель идеального газа
Слайд 58Изотермический процесс -
V
р1
р2
процесс изменения состояния термодинамической системы
макроскопических тел
Воспользуемся уравнением Менделеева – Клапейрона
p1 . V1 = (m/M) . R. T
p2 . V2 = (m/M) . R. T
p . V =const при T=const
или
p1/ p2 = V2 / V1
V p
p V
Открыт закон в 1862 году Р.Бойлем (Англия),
Э.Мариоттом (Франция)
Р.Бойль
Носит название:
закона Бойля – Мариотта:
Для газа данной массы произведение
давление газа на объём есть величина
постоянная, если температура газа не
меняется
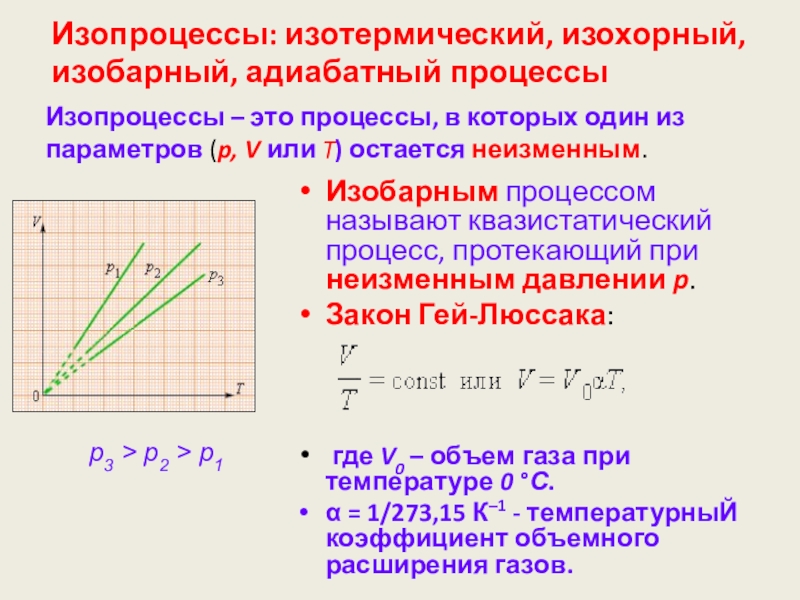
Слайд 59Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Изотермический процесс (T = const) -квазистатический процесс, протекающий
Закон Бойля–Мариотта: при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным:
pV = const
Изопроцессы – это процессы, в которых один из параметров (p, V или T) остается неизменным.
T3 > T2 > T1
Слайд 61Изобарный процесс
процесс изменения состояния термодинамической системы
макроскопических тел при
Воспользуемся уравнением Менделеева – Клапейрона
р . V1 = (m/M) . R . T1
p . V2 = (m/M) . R . T2
V / T=const при p=const
или
V1 / T1 = V2 / T2
Установлен закон в 1802 году Ж. Гей –Люссаком
(Франция)
V
T
Носит название:
Закон Гей – Люссака :
Для газа давление газа не меняется. а данной массы отношение
объёма к температуре постоянно,
если д
T
T
V
V
Слайд 62Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Изобарным процессом называют квазистатический процесс, протекающий
Закон Гей-Люссака:
где V0 – объем газа при температуре 0 °С.
α = 1/273,15 К–1 - температурныЙ коэффициент объемного расширения газов.
Изопроцессы – это процессы, в которых один из параметров (p, V или T) остается неизменным.
p3 > p2 > p1
Слайд 64Изохорный процесс
процесс изменения состояния термодинамической системы
макроскопических тел при
Воспользуемся уравнением Менделеева – Клапейрона
p1 . V = (m/M) . R. T1
p2 . V = (m/M) . R. T2
p / T=const при V=const
или
p1/ Т1 = р2 / Т2
V =const
т
T
T
p
p
Открыт закон в 1787 году Ж. Шарлем (Франция)
Носит название: закон Шарля:
Для газа данной массы отношение давления
к температуре постоянно, если объём не меняется.
Слайд 65Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы
Изохорный процесс – это процесс квазистатического
Закон Шарля: при постоянном объеме V и неизменном количестве вещества ν в сосуде давление газа p изменяется прямо пропорционально его абсолютной температуре :
Изопроцессы – это процессы, в которых один из параметров (p, V или T) остается неизменным.
V3 > V2 > V1
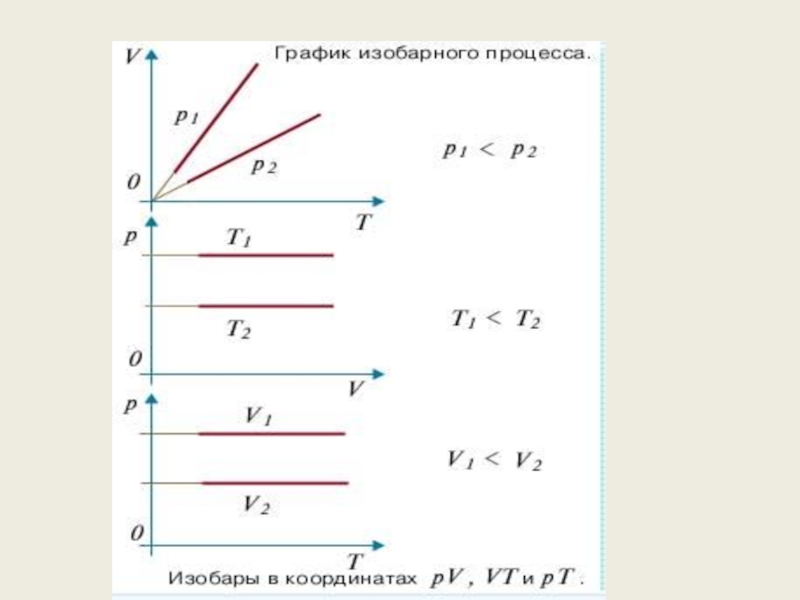
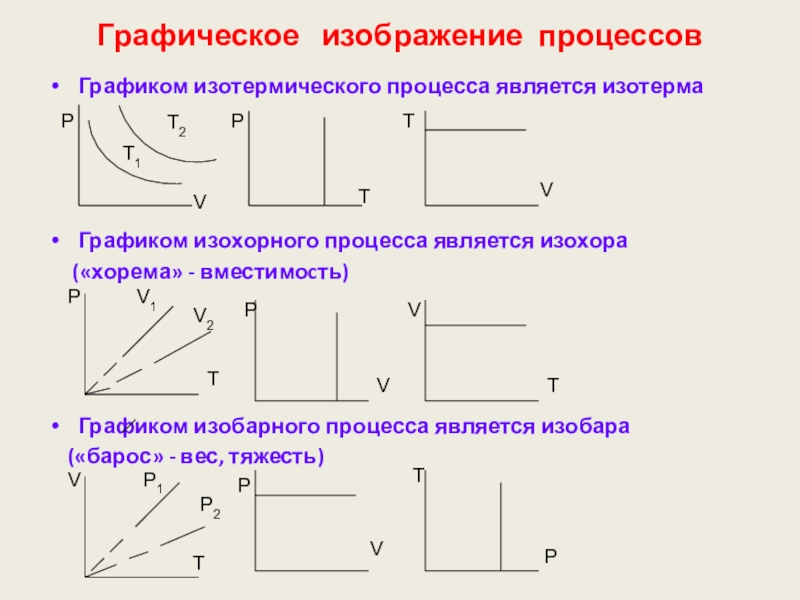
Слайд 67Графическое изображение процессов
Графиком изотермического процесса является изотерма
Графиком изохорного процесса является
(«хорема» - вместимоcть)
Графиком изобарного процесса является изобара
(«барос» - вес, тяжесть)
Р
V
P
T
T
V
Р
Т
Р
V
V
T
V
T
P
V
T
P
T1
T2
V1
V2
P1
P2
Слайд 68
Дан график цикла. Пользуясь им, ответь на вопросы:
- Как изменяются параметры?
Р
V
1
3
2
Проверь себя:
1- 2 т. к.T=const Изотермический
объём уменьш., давление увелич.
2 -3 т. к. P = const Изобарный
объём уменьш., температура уменьш.
3 – 1 т. к. V = const Изохорный
давление увел., температура увелич.
Слайд 692. Решите задачу:
При температуре – 27о С давление газа в закрытом
при температуре – 13оС ?
Дано:
Т1 = 27о С
Т2 = - 13 о С
Р1 = 75 кПа
Р2 - ?
Си
300К
260 К
75000 ПА
Решение:
Р1/ Т1 = Р2/ Т2
Р2 =(Р1 . Т2)/ Т1
Р2 = (75000ПА . 260 К):300 К=
= 65000 Па = 65кПА
Ответ: P2 = 65 кПА
Слайд 70
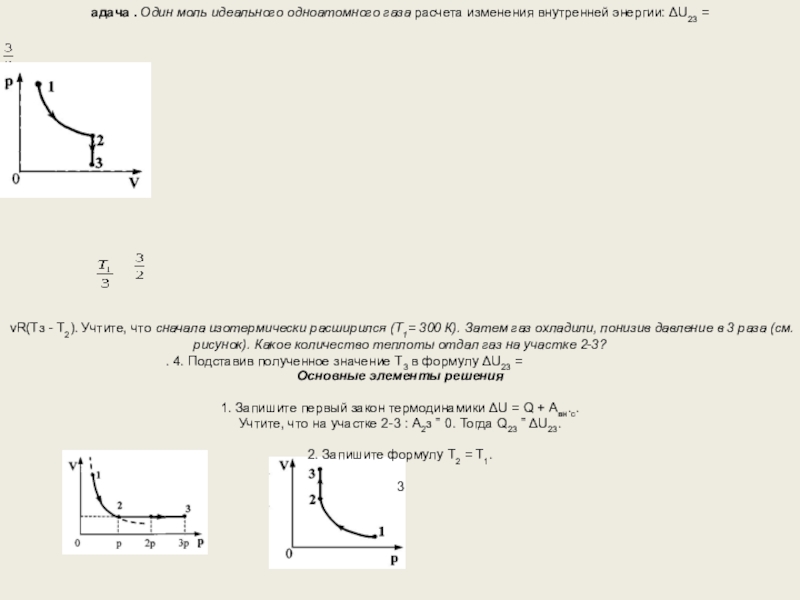
З
адача . Один моль идеального одноатомного газа расчета изменения внутренней энергии:
νR(Тз - Т2). Учтите, что сначала изотермически расширился (T1= 300 К). Затем газ охладили, понизив давление в 3 раза (см. рисунок). Какое количество теплоты отдал газ на участке 2-3?
Основные элементы решения
1. Запишите первый закон термодинамики ΔU = Q + Авн.с.
Учтите, что на участке 2-3 : А2з = 0. Тогда Q23 = ΔU23.
2. Запишите формулу Т2 = Т1.
3
. Примените закон Шарля для состояний 2 и 3:
=
и получите соотношение Т3 =
. 4. Подставив полученное значение Т3 в формулу ΔU23 =
νR(Тз - Т2)= Q23, сделайте расчет количества теплоты: Q23 = -νRT1= 2,5 кДж.
Слайд 71Насыщенный пар – это идеальный газ, масса которого меняется, поэтому газовые
неприменимы, однако можно и нужно использовать уравнение состояния идеального газа.
12.Насыщенные и ненасыщенные пары
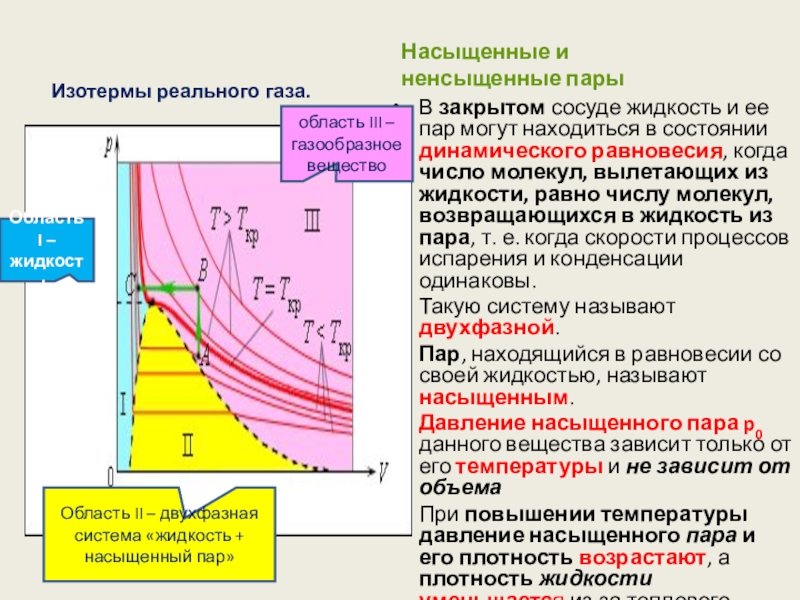
Слайд 72Насыщенные и ненсыщенные пары
В закрытом сосуде жидкость и ее пар могут
Такую систему называют двухфазной.
Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения.
Изотермы реального газа.
Область I – жидкость
Область II – двухфазная система «жидкость + насыщенный пар»
область III – газообразное вещество
Слайд 731. При длительном нахождении пара в контакте
о своей жидкостью в замкнутом
СВОЙСТВА НАСЫЩЕННОГО ПАРА
Слайд 742. Давление (и плотность) насыщенного пара не зависит от его объёма.
медленном процессе снова станет равновесным, так как «лишние молекулы» пара перейдут в жидкость
(«сконденсируются») и скорости испарения и конденсации снова выровняются.
СВОЙСТВА НАСЫЩЕННОГО ПАРА
Слайд 753. Давление (плотность) насыщенного пара очень сильно зависит от температуры. Это
СВОЙСТВА НАСЫЩЕННОГО ПАРА
Слайд 764. Кипение жидкости начинается при такой температуре, когда давление насыщенного пара
СВОЙСТВА НАСЫЩЕННОГО ПАРА
Слайд 77Приборы для измерения влажности
Гигрометры:
Волосной
Конденсационный
13.Влажность воздуха
Слайд 79- это величина, равная отношению массы пара к его объёму. По
АБСОЛЮТНАЯ ВЛАЖНОСТЬ
Слайд 80ОТНОСИТЕЛЬНАЯ ВЛАЖНОСТЬ
это – отношение абсолютной влажности пара к абсолютной влажности (плотности)
Слайд 81ОТНОСИТЕЛЬНАЯ ВЛАЖНОСТЬ
Максимальная относительная влажность равна 1, или 100%. Увеличить относительную влажность
Слайд 82Задача 1
Качественная задача на основные свойства насыщенного пара.
В цилиндрическом
Слайд 83Решение. Так как пар и вода находятся в контакте длительное время,
Комментарии. Большое количество аналогичных
задач есть в материалах первой части ЕГЭ. Для их решения необходимо твёрдо знать свойства насыщенного пара.
Слайд 84Задача 2
Взаимосвязь параметров насыщенного и ненасыщенного пара.
Какова плотность насыщенного пара
Слайд 85Решение. При нормальном давлении (р = 105Па) 100 °С – это
ρ=0,58 кг/м3
Слайд 86Задача 3
Знание определения относительной влажности.
Какова масса водяных паров воздуха
V = 1 м3 в летний день при температуре t = 30 °С и
относительной влажности ⱷ = 75%?
Слайд 87Решение. Из таблицы берём значение абсолютной влажности при данной температуре (ρнп=
·
m = ρ·V = ⱷ·ρнас·V = 0,75 · 30,3 г/м3 · 1 м3
≈ 23 г.
Комментарии. Не во всех задачниках имеется справочный материал. В таких случаях в условии задачи даётся значение либо давления, либо плотности насыщенного пара.
Слайд 88Задача 4
Изменение относительной влажности воздуха. Масса испаряемой или конденсирующейся (отбираемой) воды
В помещение нужно подать V = 10 000 м3 воздуха с температурой t1=18°С и относительной влажностью ⱷ1= 50%. Воздух снаружи имеет температуру t2= 10 °С и относительную влажность ⱷ2= 60%.
Осушать или увлажнять придётся наружный воздух? Сколько воды придётся при этом сконденсировать или испарить?
Слайд 89Решение. Найдём массу пара при заданной температуре и влажности. Вид формулы
Даны значения давления насыщенного пара:
где индекс 1 относится к состоянию пара, который должен содержаться в воздухе, а индекс 2 – к состоянию пара в воздухе, находящемуся снаружи. При m2– m1> 0 (пара больше, чем должно быть) воздух необходимо осушить
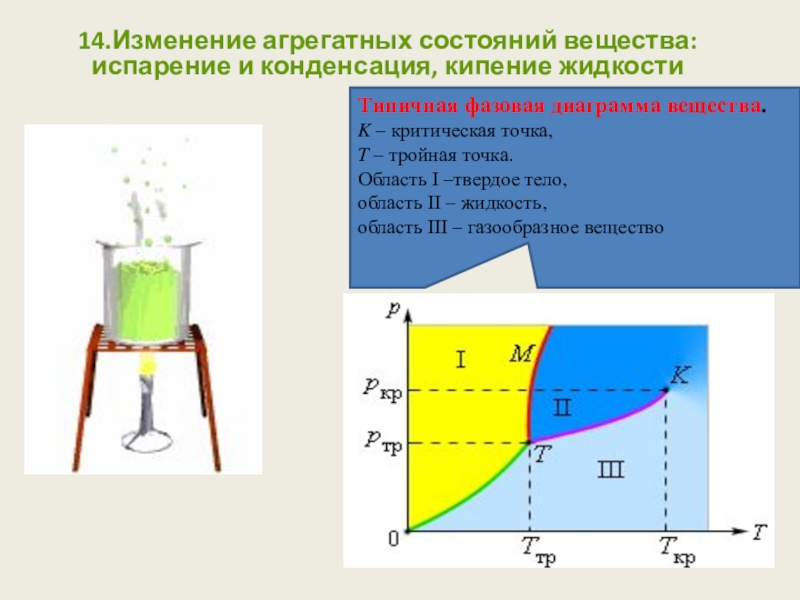
Слайд 9014.Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости
Типичная фазовая
K – критическая точка,
T – тройная точка.
Область I –твердое тело,
область II – жидкость, область III – газообразное вещество
Слайд 9114.Изменение агрегатных состояний вещества:
испарение и конденсация, кипение жидкости
Если давление
Кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром
По кривой равновесия p0 (T) можно определять температуру кипения жидкости при различных давлениях.
Зависимость равновесного давления от температуры называется кривой фазового равновесия.
Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
Переход из одного состояния в другое называется фазовым переходом
Слайд 92Изменение агрегатных состояний вещества:
испарение и конденсация, кипение жидкости
Все реальные
Такое превращение может происходить только при критической температуры Tкр.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
Переход из одного состояния в другое называется фазовым переходом
Слайд 9315.Изменение агрегатных состояний вещества:
плавление и кристаллизация
Плавление — переход из кристаллического твёрдого
Плавление происходит с поглощением удельной теплоты плавления и является фазовым переходом первого рода.
Способность плавиться относится к физическим свойствам вещества.
При нормальном давлении, наибольшей температурой плавления среди металлов обладает вольфрам (3422 °C), простых веществ вообще - углерод (по разным данным 3500 — 4500 °C) а среди произвольных веществ — карбид гафния HfC (3890 °C).
Можно считать, что самой низкой температурой плавления обладает гелий: при нормальном давлении он остаётся жидким при сколь угодно низких температурах.
Многие вещества при нормальном давлении не имеют жидкой фазы. При нагревании они путем сублимации сразу переходят в газообразное состояние.
Слайд 94Молекулярно-кинетическая теория.
Основные формулы
Основы молекулярно-кинетической теории:
NA – постоянная Авогадро.
Основное уравнение МКТ
Среднеквадратичная скорость молекул:
R – универсальная газовая постоянная.
Давление идеального газа на стенки сосуда:
k – постоянная Больцмана.
Средняя кинетическая энергия поступательного движения молекул:
Закон Дальтона:
Уравнение состояния идеального газа:
R = kNA – универсальная газовая постоянная
p = nkT
p = p1 + p2 + p3 + ... = (n1 + n2 + n3 + ...)kT
Слайд 95Молекулярно-кинетическая теория.
Основные формулы
Изотермический процесс (закон Бойля-Мариотта):
Изохорный процесс (закон Шарля):
Изобарный процесс
Потенциальная энергия свободной поверхности жидкости:
σ – коэффициент поверхностного натяжения
Высота подъема смачивающей жидкости в капилляре:
Абсолютная температура:
pV = const при V = const
Ep = σS
T = (t °C + 273,15) К
Слайд 96Словарь по Молекулярной Физике и Тепловым Явлениям
Абсолютная влажность(р) - парциальное давление
Агрегатное состояние вещества - состояние одного и того же вещества, переходы между которыми сопровождаются скачкообразным изменением ряда физических свойств.
Аморфные тела - твердые тела, не имеющие упорядоченного, периодического расположения частиц в пространстве.
Анизотропия - неодинаковость физических свойств среды в различных направлениях, связанная с внутренним строением сред.
Атом - наименьшая часть химического элемента, являющаяся носителем его свойств.
Броуновское движение - беспорядочное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием молекул.
Влажность (кг/м3) - содержание водяного пара в воздухе.
Внутренняя энергия идеального одноатомного газа - суммарная кинетическая энергия теплового движения атомов газа.
Внутренняя энергия тела (U) - сумма энергии хаотического (теплового) движения всех микрочастиц тела (молекул, атомов, ионов и т. д.) и энергии взаимодействия этих частиц.
Слайд 97Словарь по Молекулярной Физике и Тепловым Явлениям
Деформация - изменение формы или
Динамическое равновесие - процесс, при котором скорость парообразования равна скорости конденсации.
Диффузия - взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Жидкости сохраняют свой объем и принимают форму сосуда.
Закон Бойля-Мариотта. Для газа данной массы произведение давления на его объем постоянно, если его температура не меняется.
Закон Гей-Люссака. Для данной массы газа отношение его объема к абсолютной температуре постоянно, если давление газа не меняется.
Закон Гука. Относительное удлинение прямо пропорционально механическому напряжению.
Закон Шарля. Для данной массы газа отношение его давления к абсолютной температуре постоянно, если его объем не меняется
Слайд 98Словарь по Молекулярной Физике и Тепловым Явлениям
Идеальный газ - модель, в
Изобарический процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении.
Изопроцесс - процесс, протекающий в термодинамической системе с неизменной массой при постоянном значении одного из параметров состояния.
Изотермический процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре.
Изохорический процесс - процесс изменения состояния термодинамической системы при постоянном объеме.
Испарение - парообразование со свободной поверхности жидкости при любой температуре.
Кипение - процесс парообразования внутри и с поверхности жидкости при температуре кипения.
Количество вещества - отношение числа молекул в данном теле к числу атомов в 0,012 кг углерода.
Коэффициент полезного действия теплового двигателя (КПД, n) - физическая величина, определяемая отношением работы А, совершенной тепловым двигателем за один цикл, к количеству теплоты Q1, полученной от нагревателя.
Кристаллические тела - твердые тела, имеющие упорядоченное, периодическое расположение частиц в пространстве.
Критическая температура - температура, при которой исчезают различия в физических свойствах между жидкостью и ее насыщенным паром.
Слайд 99Словарь по Молекулярной Физике и Тепловым Явлениям
Парообразование - процесс перехода вещества
Первый закон термодинамики (первая формулировка). Изменение внутренней энергии тела (системы) при переходе из одного состояния в другое равно сумме совершенной над телом работы и полученного им количества теплоты.
Первый закон термодинамики (вторая формулировка). Количество тепла, полученного телом (системой) расходуется на изменение внутренней энергии системы и на работу против внешних сил.
Плавление - процесс перехода вещества из твердого (кристаллического) состояния в жидкое.
Плазма - частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов равны.
Пластическая (остаточная) деформация - деформация, не исчезающая после прекращения действия внешних сил.
Пластичность - свойства твердых тел под действием внешних сил изменять, не разрушаясь, свою форму и раз4 меры и сохранять остаточные деформации после прекращения действия этих сил.
Полиморфизм - способность твердых тел существовать в двух или нескольких кристаллических структурах.
Постоянная Авогадро (NA) - количество структурных элементов (атомов, молекул, ионов или других частиц) в одном моле вещества.
Предел пропорциональности (бпроп) - максимальное напряжение, при котором еще выполняется закон Гука.
Предел прочности (бпр) - наибольшее напряжение, возникающее в теле перед началом его разрушения.
Предел упругости (бупр) - напряжение, при котором тело полностью утрачивает упругость.
Слайд 100Словарь по Молекулярной Физике и Тепловым Явлениям
Твердые тела - агрегатное состояние
Температура (Т, t°) - величина, характеризующая состояние термодинамического равновесия макроскопической системы и пропорциональная средней кинетической энергии частиц системы.
Температура кипения - температура жидкости, при которой давление ее насыщенного пара равно или превышает внешнее давление.
Температура плавления - температура, при которой кристаллическое вещество плавится.
Тепловое движение - беспорядочное (хаотическое) движение микрочастиц, из которых состоят все тела.
Тепловой двигатель - устройство, в котором осуществляется преобразование внутренней энергии топлива в механическую.
Теплоемкость тела (С) - количество теплоты, которое нужно сообщить данному телу, чтобы повысить его температуру на один градус.
Теплопередача - процесс изменения внутренней энергии без совершения работы над телом или самим телом.
Теплопроводность - передача тепла в телах, не сопровождаемая перемещением составляющих их частиц. При теплопроводности перенос энергии осуществляется в результате непосредственной передачи энергии от частиц (молекул, атомов, электронов), обладающих большей энергией, частицам с меньшей энергией.
Термодинамические параметры - физические величины, которые служат в термодинамике для характеристики состояния рассматриваемой системы.
Термодинамическое равновесие - состояние термодинамической системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды.
Термометр - прибор для измерения температуры посредством контакта его с исследуемой средой.
Слайд 101Словарь по Молекулярной Физике и Тепловым Явлениям
Удельная теплоемкость (с) - физическая
Удельная теплота парообразования (L) - величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.
Удельная теплота плавления (А) - физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления перевести его в жидкое состояние.
Упругая деформация - деформация, полностью исчезающая после прекращения действия внешних сил.
Упругость - свойство тел восстанавливать свою форму и объем после прекращения действия внешних сил и других причин, вызывающих деформацию тел.
Уравнение состояния идеального газа. Для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная.
Хрупкость - способность твердых тел разрушаться при механических воздействиях без заметной пластической деформации
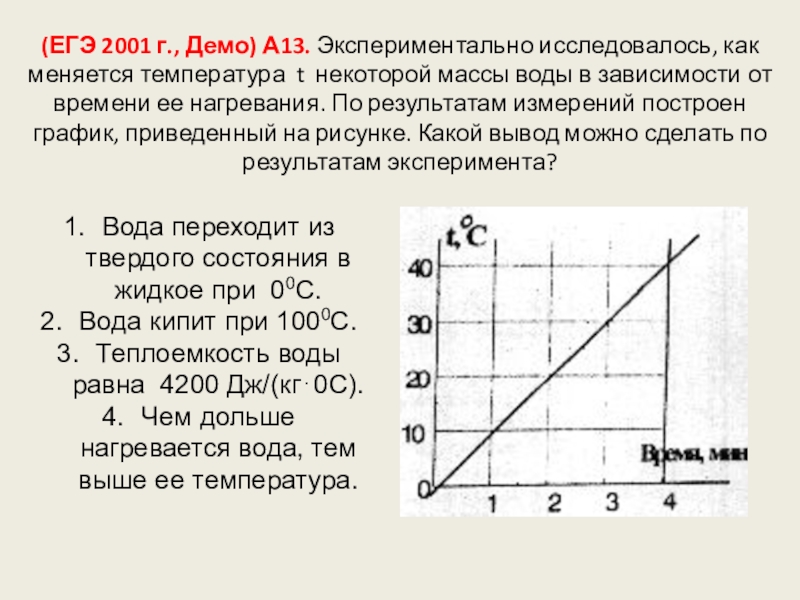
Слайд 102(ЕГЭ 2001 г., Демо) А13. Экспериментально исследовалось, как меняется температура t
Вода переходит из твердого состояния в жидкое при 00С.
Вода кипит при 1000С.
Теплоемкость воды равна 4200 Дж/(кг⋅0С).
Чем дольше нагревается вода, тем выше ее температура.
Слайд 103(ЕГЭ 2001 г., Демо) А14. Испарение жидкости происходит потому, что .
разрушается кристаллическая решетка.
самые быстрые частицы покидают жидкость.
самые медленные частицы покидают жидкость.
самые крупные частицы покидают жидкость.
Слайд 104(ЕГЭ 2001 г., Демо) А15. Тела, имеющие разные температуры, привели в
В положении I теплопередача осуществляется от тела 1 к телу 2.
В положении II теплопередача осуществляется от тела 1 к телу 2.
В любом положении теплопередача осуществляется от тела 2 к телу 1.
Теплопередача осуществляется только в положении II.
Слайд 105(ЕГЭ 2002 г., Демо) А8. Какой из перечисленных ниже опытов (А,
только А
только Б
только В
А, Б и В
Слайд 1062002 г. А9 (КИМ). В баллоне находится 6 моль газа. Сколько примерно
Слайд 107(ЕГЭ 2002 г., Демо) А13. При испарении жидкость остывает. Молекулярно-кинетическая теория
равна средней кинетической энергии молекул жидкости
превышает среднюю кинетическую энергию молекул жидкости
меньше средней кинетической энергии молекул жидкости
равна суммарной кинетической энергии молекул жидкости
Слайд 1082002 г. А13 (КИМ). При сжатии идеального газа объем уменьшился в
Слайд 1092002 г. А29 (КИМ). Идеальный газ сначала нагревался при постоянном давлении,
Слайд 110(ЕГЭ 2002 г., Демо) А30. Какова температура идеального газа в точке
200 К
400 К
600 К
1200 К
Слайд 111(ЕГЭ 2003 г., КИМ) А8. Диффузия происходит быстрее при повышении температуры
увеличивается скорость движения частиц
увеличивается взаимодействие частиц
тело при нагревании расширяется
уменьшается скорость движения частиц
Слайд 112(ЕГЭ 2003 г., КИМ) А9. При неизменной концентрации частиц идеального газа
уменьшилось в 3 раза
увеличилось в 3 раза
увеличилось в 9 раз
не изменилось
Слайд 113(ЕГЭ 2003 г., КИМ) А10. На рисунке изображен график зависимости давления
изобарное нагревание
изохорное охлаждение
изотермическое сжатие
изохорное нагревание
Слайд 114(ЕГЭ 2003 г., КИМ) А13.
Температура кипения воды зависит от
мощности нагревателя
вещества
атмосферного давления
начальной температуры воды
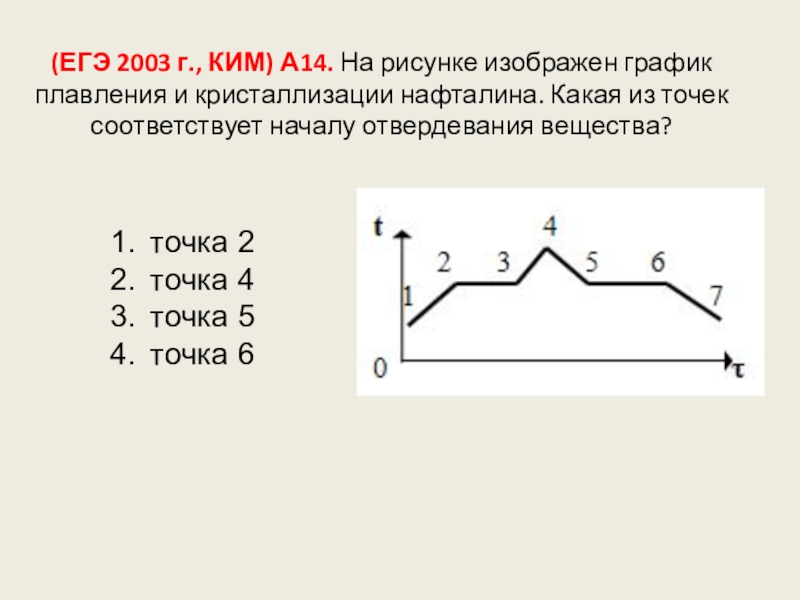
Слайд 115(ЕГЭ 2003 г., КИМ) А14. На рисунке изображен график плавления и
точка 2
точка 4
точка 5
точка 6
Слайд 116(ЕГЭ 2004 г., демо) А7. Давление идеального газа зависит от А.
только от А
только от Б
и от А, и от Б
ни от А, ни от Б
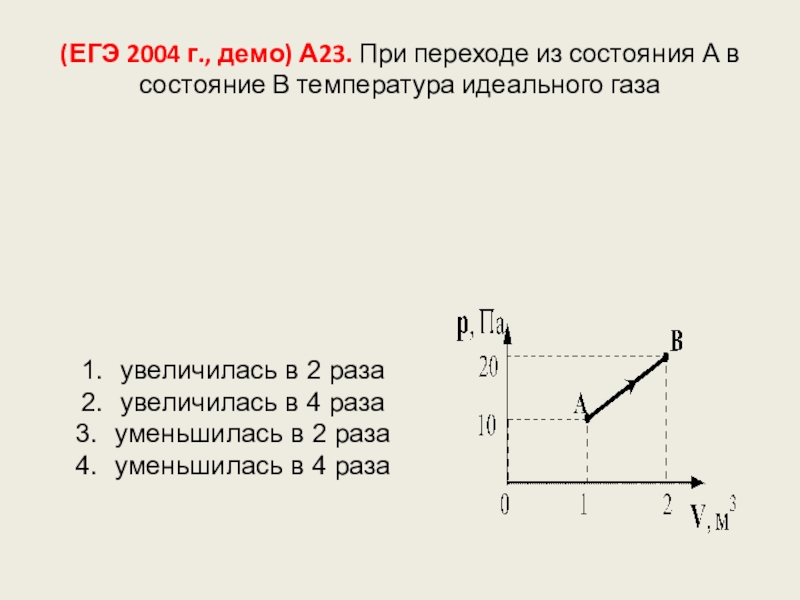
Слайд 117(ЕГЭ 2004 г., демо) А23. При переходе из состояния А в
увеличилась в 2 раза
увеличилась в 4 раза
уменьшилась в 2 раза
уменьшилась в 4 раза
Слайд 118(ЕГЭ 2004 г., демо) А24. Идеальному газу сообщили количество теплоты 400
увеличилась на 1000 Дж
увеличилась на 200 Дж
уменьшилась на 1000 Дж
уменьшилась на 200 Дж
Слайд 119(ЕГЭ 2005 г., ДЕМО) А11. Как изменяется внутренняя энергия кристаллического вещества
увеличивается для любого кристаллического вещества
уменьшается для любого кристаллического вещества
для одних кристаллических веществ увеличивается, для других – уменьшается
не изменяется
Слайд 120(ЕГЭ 2005 г., ДЕМО) А13. Парциальное давление водяного пара в воздухе
10 %
20 %
30 %
40 %
Слайд 121(ЕГЭ 2006 г., ДЕМО) А9. Лед при температуре 0°С внесли в
не изменится, так как вся энергия, получаемая льдом в это время, расходуется на разрушение кристаллической решетки
не изменится, так как при плавлении лед получает тепло от окружающей среды, а затем отдает его обратно
повысится, так как лед получает тепло от окружающей среды, значит, его внутренняя энергия растет, и температура льда повышается
понизится, так как при плавлении лед отдает окружающей среде некоторое количество теплоты
Слайд 122(ЕГЭ 2006 г., ДЕМО) А10. При какой влажности воздуха человек легче
при низкой, так как при этом пот испаряется быстро
при низкой, так как при этом пот испаряется медленно
при высокой, так как при этом пот испаряется быстро
при высокой, так как при этом пот испаряется медленно
Слайд 123(ЕГЭ 2006 г., ДЕМО) А11. Абсолютная температура тела равна 300 К.
– 27°С
27°С
300°С
573°С
Слайд 124(ЕГЭ 2006 г., ДЕМО) А27. Экспериментаторы закачивают воздух в стеклянный сосуд,
в 2 раза
в 3 раза
в 6 раз
в 1,5 раза
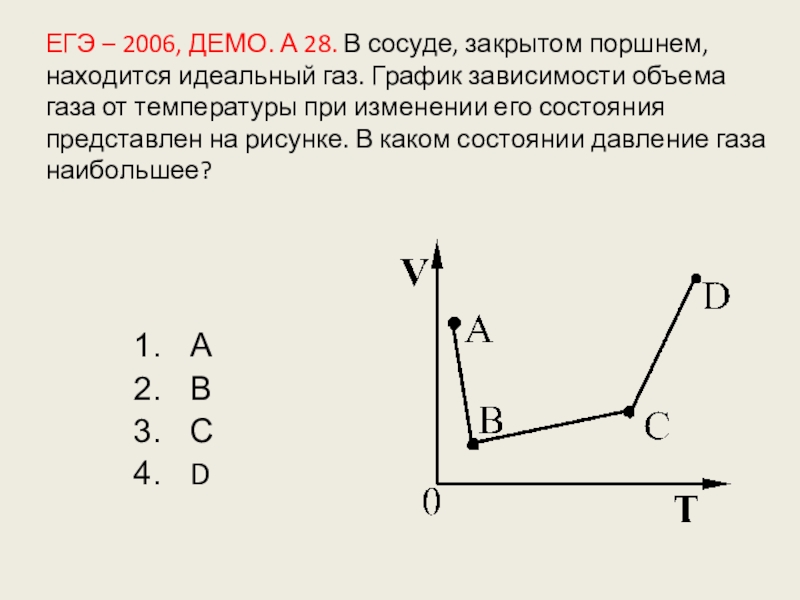
Слайд 125ЕГЭ – 2006, ДЕМО. А 28. В сосуде, закрытом поршнем, находится
А
В
С
D
Слайд 126(ЕГЭ 2007 г., ДЕМО) А15. В сосуде постоянного объема находится идеальный
А
В
С
D
Слайд 127(ЕГЭ 2007 г., ДЕМО) А13. На графике (см. рисунок) представлено изменение
5
6
3
7
Слайд 128(ЕГЭ 2007 г., ДЕМО) А13. На графике (см. рисунок) представлено изменение
5
6
3
7
Слайд 129(ЕГЭ 2008 г., ДЕМО) А11. На фотографии представлены два термометра, используемые
37%
40%
48%
59%
Относительная влажность воздуха в помещении, в котором проводилась съемка, равна
Слайд 130(ЕГЭ 2008 г., ДЕМО) А13. На рисунке представлен график зависимости абсолютной
Слайд 131(ЕГЭ 2009 г., ДЕМО) А8. При понижении абсолютной температуры одноатомного идеального
увеличится в 1,5 раза
уменьшится в 1,5 раза
уменьшится в 2,25 раза
не изменится
Слайд 132(ЕГЭ 2009 г., ДЕМО) А12. В сосуде находится постоянное количество идеального
Слайд 133(ЕГЭ 2010 г., ДЕМО) А9. На рисунке приведены графики зависимости давления
Слайд 134Используемая литература
Берков, А.В. и др. Самое полное издание типовых вариантов реальных
Касьянов, В.А. Физика, 11 класс [Текст]: учебник для общеобразовательных школ / В.А. Касьянов. – ООО "Дрофа", 2004. – 116 с.
Мякишев, Г.Я. и др. Физика. 11 класс [Текст]: учебник для общеобразовательных школ / учебник для общеобразовательных школ Г.Я. Мякишев, Б.Б. Буховцев . –" Просвещение ", 2009. – 166 с.
Открытая физика [текст, рисунки]/ http://www.physics.ru
Подготовка к ЕГЭ //http/http:///http://egephizika
Федеральный институт педагогических измерений. Контрольные измерительные материалы (КИМ) Физика //[Электронный ресурс]// httphttp://http://fipihttp://fipi.http://fipi.ruhttp://fipi.ru/http://fipi.ru/viewhttp://fipi.ru/view/http://fipi.ru/view/sectionshttp://fipi.ru/view/sections/92/http://fipi.ru/view/sections/92/docshttp://fipi.ru/view/sections/92/docs/
Физика в школе. Физика - 10 класс. Молекулярная физика. Молекулярно-кинетическая теория. Рисунки по физике/ http://gannalv.narod.ru/mkt/
Эта удивительная Эта удивительная физика/Эта удивительная физика/ httpЭта удивительная физика/ http://Эта удивительная физика/ http://sfizЭта удивительная физика/ http://sfiz.Эта удивительная физика/ http://sfiz.ruЭта удивительная физика/ http://sfiz.ru/Эта удивительная физика/ http://sfiz.ru/pageЭта удивительная физика/ http://sfiz.ru/page.Эта удивительная физика/ http://sfiz.ru/page.phpЭта удивительная физика/ http://sfiz.ru/page.php?Эта удивительная физика/ http://sfiz.ru/page.php?idЭта удивительная физика/ http://sfiz.ru/page.php?id=39




















![Презентация по физике к итоговому уроку по теме Молекулярная физика Основное уравнение идеального газа [формула]р - давление газаm0 Основное уравнение идеального газа [формула]р - давление газаm0 - масса молекулыv](/img/thumbs/d87ac878696b2afcd628fd61db7bdcae-800x.jpg)


























































































![Презентация по физике к итоговому уроку по теме Молекулярная физика Используемая литератураБерков, А.В. и др. Самое полное издание типовых вариантов реальных Используемая литератураБерков, А.В. и др. Самое полное издание типовых вариантов реальных заданий ЕГЭ 2010, Физика [Текст]: учебное](/img/thumbs/eba08856422dca085b1107475e9b91af-800x.jpg)





