- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Планетарная модель атома
Содержание
- 1. Планетарная модель атома
- 2. Демокрит«Мир - это система атомов в пустоте.
- 3. На основе экспериментальных фактов был сделан
- 4. Требования к создаваемой модели атомаМодель должна
- 5. Дж. Дж. Томпсон«Атомы вещества имеют сложное внутреннее
- 6. Опыт Резерфорда«Зондирование атома α – частицами». Среди опытов, описанных в курсе физики, можно выделить основополагающие. Именно к таким опытам относится опыт Эрнеста Резерфорда.
- 7. Мишень для α - частиц
- 8. Результаты опыта Резерфорда Объяснение опыта:1.
- 9. Эрнест Резерфорд Планетарная модель атома:«В центре
- 10. Вопросы: Каков заряд ядра атома He, Li,
- 11. Нильс Бор1 постулат.
- 12. От орбит к диаграмме энергетических уровней атома
- 13. Внутриатомные переходы электронов и цвета тел
- 14. Атомы излучают и поглощают свет
- 15. Задача 1При переходе атома водорода из одного
- 16. Задача 2Во сколько раз длина волны излучения
- 17. Что ты знаешь об атоме?Атом – мельчайшая
- 18. Лазер- практическое применение квантовой теорииВиды излучений:спонтанное- непроизвольное,индуцированное
- 19. Трёхуровневая система лазераПри вспышке лампы
- 20. Свойства и применение
- 21. Проверь себя!1. На рисунке представлена диаграмма
- 22. Проверь себя!1. Атомы одного элемента, находившиеся в
- 23. Проверь себя!1. Кто является автором планетарной модели
- 24. Вывод о концептуальной основе строения
- 25. Спасибо за внимание!
Слайд 1Планетарная модель
атома
ГБОУ СПО
Преподаватель Петрова Татьяна Ивановна.
Слайд 2Демокрит
«Мир - это система атомов в пустоте.
Число атомов во
Атомы движутся в пустом пространстве (Великой Пустоте) хаотично, сталкиваются и вследствие соответствия форм, размеров, положений и порядков либо сцепляются, либо разлетаются.
Образовавшиеся соединения держатся вместе
и таким образом производят возникновение сложных тел».
Основателем атомистической теории,
философии развития учения об «атоме» ,
является древнегреческий учёный Демокрит.
«Атом - неделимая частица вещества, обладающая
истинным бытием,
не разрушающаяся
и не возникающая».
Слайд 3На основе экспериментальных фактов был сделан вывод о том, что атомы имеют
Важным свидетельством сложной структуры атомов явились линейчатые спектры атомов.
Были открыты спектральные линии
в излучении атомов водорода в видимой части спектра.
Было обнаружено явление испускания атомами невидимых проникающих излучений, названное радиоактивностью.
*М.Фарадей определил минимальный заряд иона, который был назван
элементарным электрическим зарядом.
e = 1,60·10–19 Кл.
*Д. И. Менделеев разработал периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
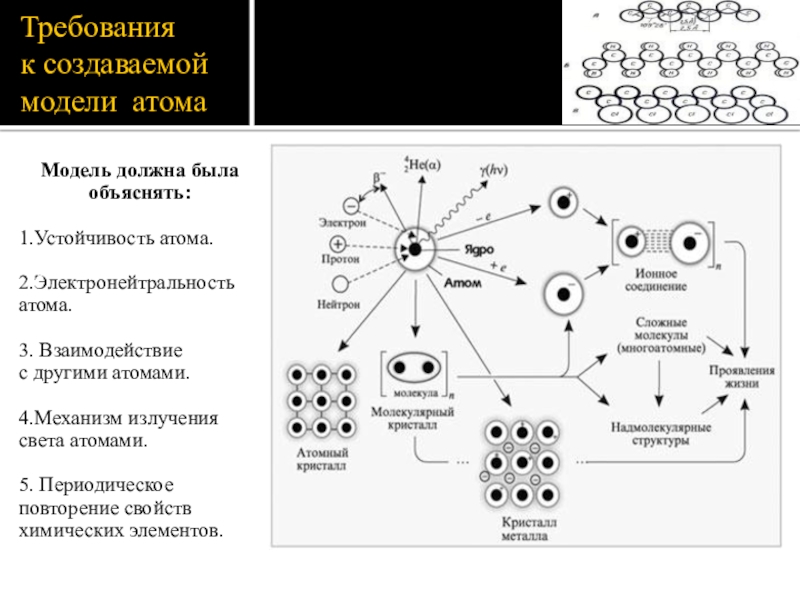
Слайд 4Требования
к создаваемой модели атома
Модель должна была объяснять:
1.Устойчивость атома.
2.Электронейтральность
3. Взаимодействие
с другими атомами.
4.Механизм излучения света атомами.
5. Периодическое повторение свойств химических элементов.
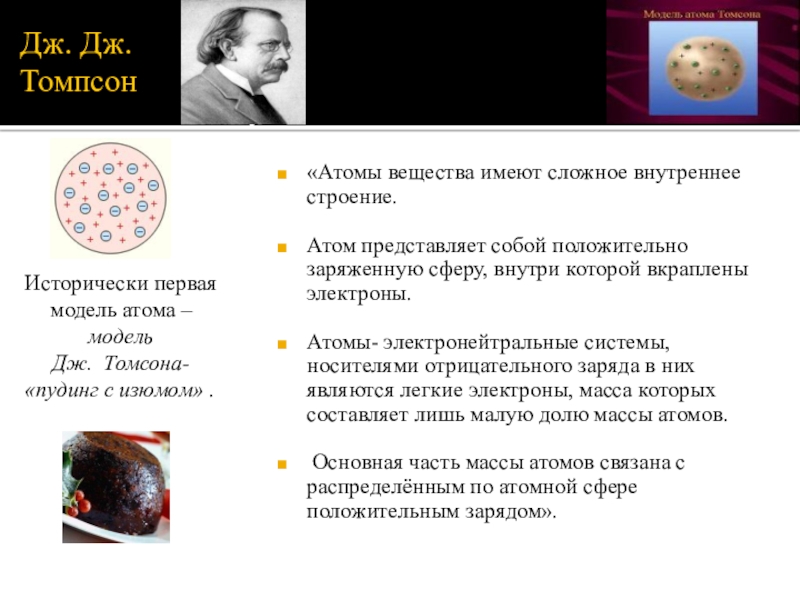
Слайд 5Дж. Дж. Томпсон
«Атомы вещества имеют сложное внутреннее строение.
Атом представляет собой
Атомы- электронейтральные системы, носителями отрицательного заряда в них являются легкие электроны, масса которых составляет лишь малую долю массы атомов.
Основная часть массы атомов связана с распределённым по атомной сфере положительным зарядом».
Исторически первая модель атома –модель
Дж. Томсона-
«пудинг с изюмом» .
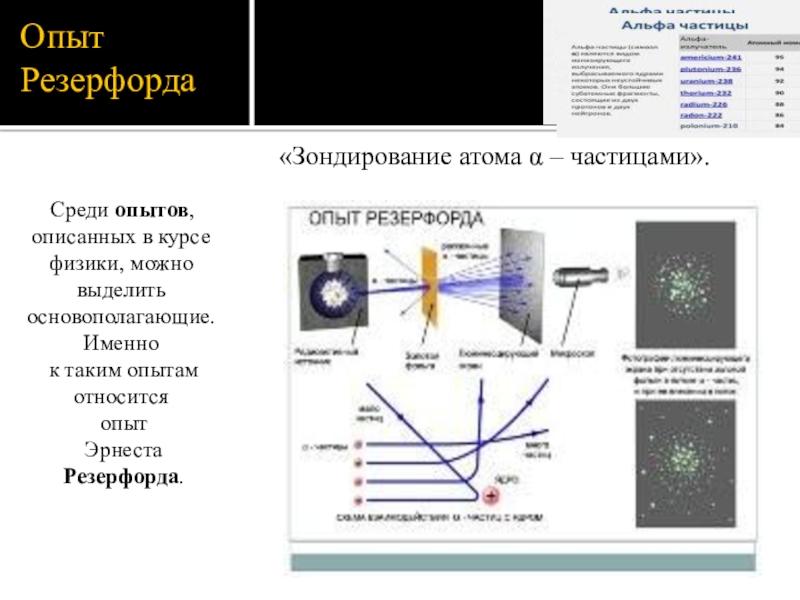
Слайд 6Опыт Резерфорда
«Зондирование атома α – частицами».
Среди опытов, описанных в курсе физики, можно
к таким опытам
относится
опыт
Эрнеста
Резерфорда.
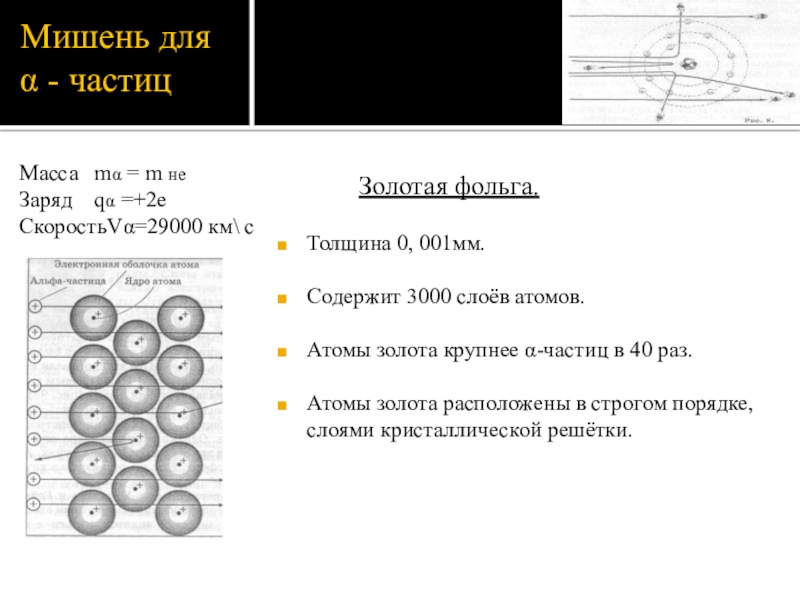
Слайд 7Мишень для α - частиц
Золотая фольга.
Толщина
Содержит 3000 слоёв атомов.
Атомы золота крупнее α-частиц в 40 раз.
Атомы золота расположены в строгом порядке, слоями кристаллической решётки.
Масса mα = m нe
Заряд qα =+2e
СкоростьVα=29000 км\ с
Слайд 8Результаты опыта Резерфорда
Объяснение опыта:
1. Атом почти пустой.
2. В
3. В центре атома находится массивная положительно заряженная частица.
1. α-частицы прошли фольгу.
2. α- частицы отклонились от прямолинейного распространения.
3. 8 из 1000
α- частиц повернули назад.
Слайд 9Эрнест Резерфорд
Планетарная модель атома:
«В центре атома - положительно заряженное
ядро занимает 10–12 часть объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы;
вещество, составляющее ядро атома, имеет колоссальную плотность ρ ≈ 1015 г/см3;
заряд ядра равен суммарному заряду всех электронов, входящих в состав атома;
заряд ядра в электронных единицах в точности равен номеру данного элемента в таблице Менделеева».
Эрнест Резерфорд -титан
физики 20 века,
оказал огромное влияние не только на науку и технику 20 века,
но и на жизнь
миллионов людей.
Слайд 10Вопросы:
Каков заряд ядра атома He, Li, Be?
Сколько электронов в атоме He,
Чем отличаются друг от друга атомы различных химических элементов?
Что является главной характеристикой определенного химического элемента?
В чем сущность планетарной модели строения атома?
Слайд 11Нильс
Бор
1 постулат.
Атомная система может находиться только
в особых стационарных или квантовых состояниях, каждому из которых соответствует
определенная энергия Еn и Еm,
где n и m- целые числа, причём n > m.
2 постулат.
При переходе атома
из одного стационарного состояния в другое излучается или поглощается
квант энергии,
величина которого
Создал теорию строения атома,
в основу которой легли
* планетарная модель атома,
*квантовые представления
и
*предложенные им постулаты.
Слайд 13Внутриатомные переходы электронов и цвета тел
Красный-761нм
Оранжевый- 636нм
Желтый- 589нм
Зелёный- 527нм
Голубой- 486нм
Синий- 431нм
Фиолетовый- 397нм
λ=с\ν ν=с\λ
λ=hc / Еп-Еm
λ=hc / Еп-Еm
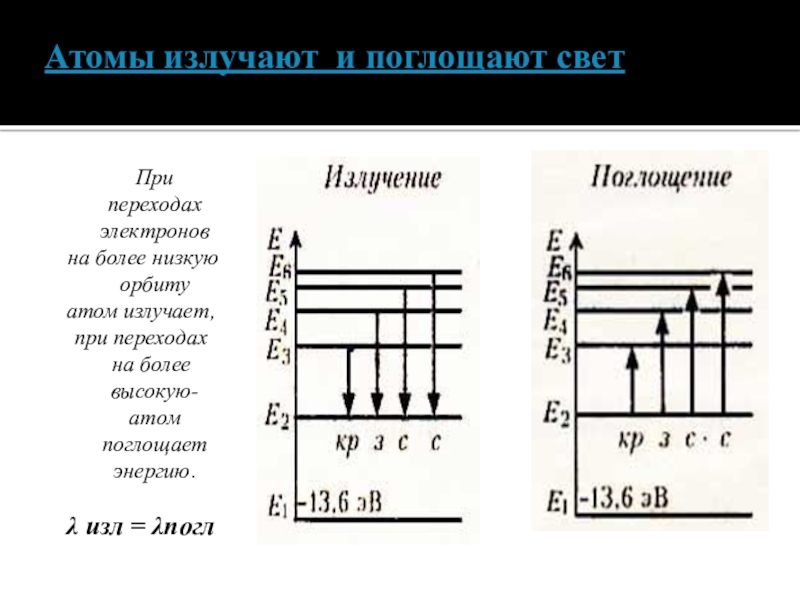
Слайд 14Атомы излучают и поглощают свет
При
на более низкую орбиту
атом излучает,
при переходах
на более высокую- атом поглощает энергию.
λ изл = λпогл
Слайд 15Задача 1
При переходе атома водорода из одного энергетического состояния в другое
Слайд 16Задача 2
Во сколько раз длина волны излучения атома водорода при переходе
Слайд 17Что ты знаешь об атоме?
Атом – мельчайшая частица вещества, называемого химическим
Атом имеет сложное строение.
Атом состоит из ядра и электронных оболочек.
Ядро заряжено положительно, в нём сосредоточена основная масса атома.
Электроны движутся по так называемым разрешённым орбитам, образуя К, L , M, N уровни и s p, d , f под уровни.
Радиусы электронных орбит
R=R1*n2
Энергия атомной системы
E=E1 \n2
Основное энергетическое состояние –при n = 1.
R1 = 0,5 • 10 -11 м,
Е1=-13, 56 эВ.
Возбужденные, неустойчивые энергетические состояния-
при n >1 .
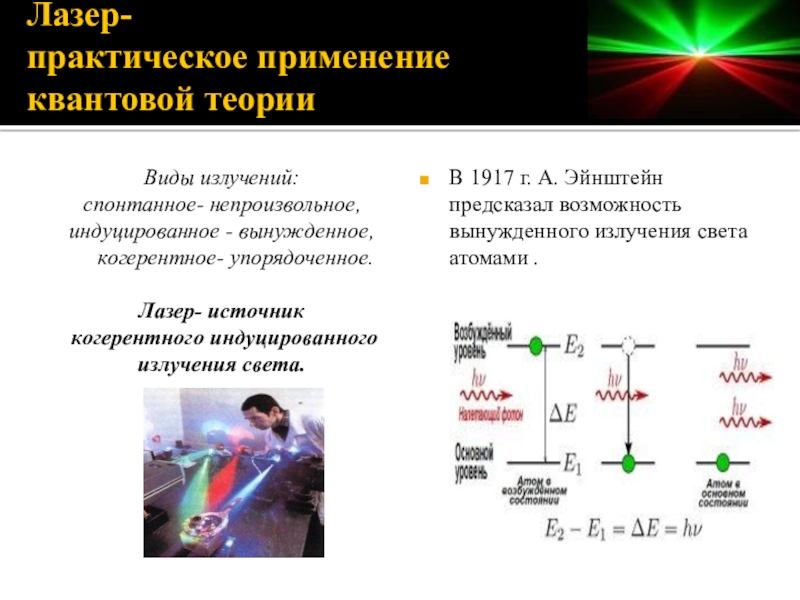
Слайд 18Лазер-
практическое применение
квантовой теории
Виды излучений:
спонтанное- непроизвольное,
индуцированное - вынужденное, когерентное- упорядоченное.
Лазер- источник
когерентного
излучения света.
В 1917 г. А. Эйнштейн предсказал возможность вынужденного излучения света атомами .
Слайд 19 Трёхуровневая
система лазера
При вспышке лампы накачивания на рубиновый стержень падают
Атомы, поглотив часть фотонов, переходят в возбужденное состояние, а затем на промежуточный уровень . С него – на основной.
Возникает вынужденное излучение, которое распространяется строго вдоль оси стержня и усиливается при многократном отражении от зеркал.
В результате возникает мощное монохроматическое излучение — пучок света, часть которого выходит через полупрозрачное зеркало.
Длительность излучения пучка 10-3 с.
Слайд 20 Свойства и применение
лазерного излучения
Малый угол расхождения
Исключительная монохроматичность, т.е. определённый цвет.
Невероятная мощность лазерного луча света — 1014 Вт/с, прожигает, режет, сваривает.
КПД около 100 %.
Первым квантовым генератором был рубиновый, твердотельный лазер.
Созданы: газовые, полупроводниковые, жидкостные,
газодинамические, кольцевые лазеры.
Лазеры нашли широкое применение в науке и технике как основной инструмент в нелинейной оптике, локации, медицине.
Слайд 21
Проверь себя!
1. На рисунке представлена диаграмма энергетических уровней атома. Стрелкой с
А. 1;
Б. 2;
В. 3;
Г. 4.
2. При переходе электрона в атоме водорода с одной орбиты на другую, более близкую к ядру, излучаются фотоны с энергией
3, 03*10-19 Дж. Определите частоту излучения атома.
Слайд 22Проверь себя!
1. Атомы одного элемента, находившиеся в состояниях с энергиями Е1
А. Е1 > Е2
Б. Е1 < Е2
В. Е1 = Е2
Г. | Е1 | < | Е2 | .
2.При переходе электрона в атоме водорода с третьей стационарной орбиты на вторую излучаются фотоны, соответствующие длине волны 0,652 мкм (красная линия водородного спектра). Какую энергию теряет при этом атом водорода?
Слайд 23Проверь себя!
1. Кто является автором планетарной модели атома?
А. Э. Резерфорд.
В. Ф. Жолио Кюри.
Г. И. В.Курчатов.
2. Какое из приведенных ниже высказываний правильно описывает способность атомов к излучению и поглощению энергии при переходе между двумя различными стационарными состояниями:
А. может излучать и поглощать фотоны любой энергии;
Б. может излучать и поглощать фотоны лишь с некоторыми значениями энергии;
В. может излучать фотоны любой энергии, а поглощать лишь с некоторыми значениями энергии;
Г. может поглощать фотоны любой энергии, а излучать лишь с некоторыми значениями энергии.
3. Какое из этих явлений используется в оптических квантовых генераторах- лазерах?
I. Спонтанное излучение.
II. Индуцированное излучение.
А. I;
Б. II;
В. I и II4
;Г. Ни I, ни II.
Слайд 24Вывод
о концептуальной
основе строения атома.
Атом в XX в. предстал как сложная
Концептуальной основой такого понимания явились корпускулярные представления о строении вещества.
Модель строения атома явилась синтезом экспериментальных фактов Э. Резерфорда
и физической теории
Н. Бора.
В единое целое были связаны
эмпирические закономерности линейчатых спектров,
ядерная модель атома Резерфорда ,
квантовый характер излучения и поглощения света.