- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Кристалдық торлардың түрлері. Презентация
Содержание
- 1. Кристалдық торлардың түрлері. Презентация
- 2. Кристалдық тордың түйіндеріӘрбір қатты денеге бөлшектерінің
- 3. Белгілі балқу температурасы болады.Затты құрап тұрған бөлшектердің (атом, ион, молекула) белгілі бір ретпен орналасуымен сипатталады.Кристалды заттар
- 4. Кристалдар – атомдары, иондары және молекулалары периодты
- 5. Слайд 5
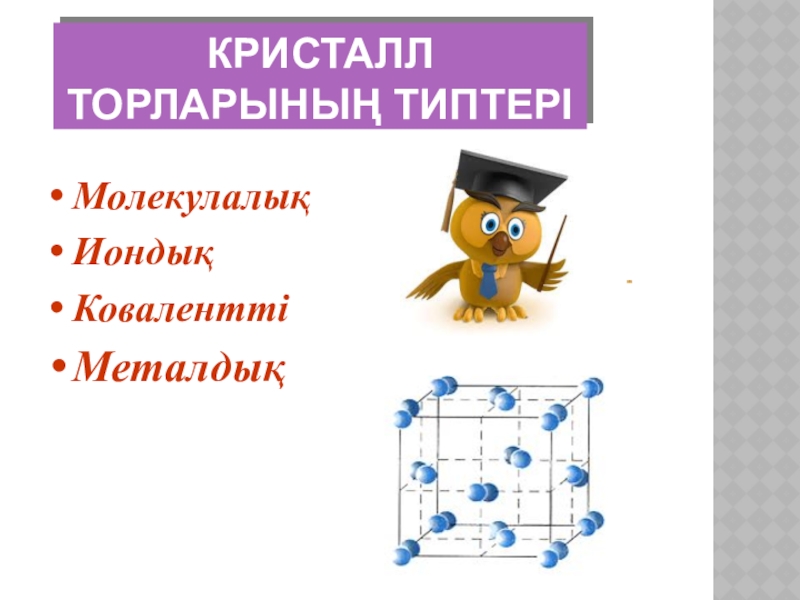
- 6. Кристалл торларының типтері МолекулалықИондықКоваленттіМеталдық
- 7. Кристалдық тордың типтері және заттардың қасиеттері.
- 8. Молекулалық кристалл тор Йодтың кристалл торы
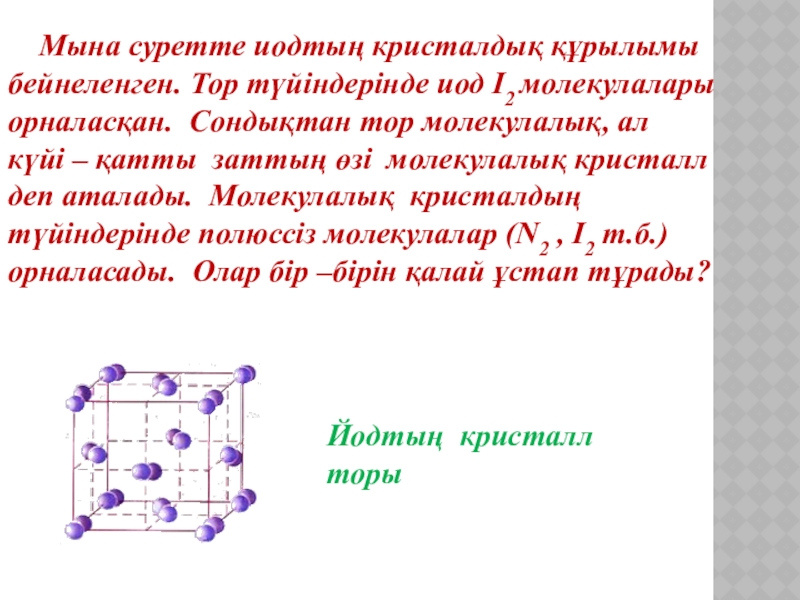
- 9. Мына суретте иодтың кристалдық құрылымы
- 10. Молекулалық кристалл торы бар күрделі заттар. Мұндай
- 11. Иондық кристалдарИондық кристалдар аттас зарядталған иондардың электростатикалық
- 12. Кристалдық тордағы катион мен анионды қоршайтын аттас
- 13. Слайд 13
- 14. Иондық кристалл торы бар күрделі заттар. Бұрын
- 15. Иондық кристалдардың екі ерекшелігіне назар аударсақ.Біріншіден,кристалда бір
- 16. +++00000---Металдық кристалдар Металдық байланыс деп металдық
- 17. Металды кристалды заттарға: мыс, алюминий, қорғасын, темір
- 18. Ковалентті кристалдарға заттарға мысал ретінде алмаз және
- 19. Ковалентті кристалды заттарға мысал ретінде
- 20. Кристалдағы ақаулар (дефектілер)Құрамы тұрақты заттар - дальтонидтер
- 21. Кристалдардың дислокациялануыКристалдардың дислокациялануы дегеніміз жазықты, бойлай, жақын
- 22. Назарларыңызға рахмет!
Слайд 2Кристалдық тордың
түйіндері
Әрбір қатты денеге бөлшектерінің кеңістікте геометриялық дұрыс орналасуы
қилы – қарапайымдарынан бастап өте ғажайып және күрделілері кездеседі.
Слайд 3Белгілі балқу температурасы болады.
Затты құрап тұрған
бөлшектердің (атом, ион, молекула) белгілі
орналасуымен сипатталады.
Кристалды заттар
Слайд 4Кристалдар – атомдары, иондары және молекулалары периодты түрде құрылым түзіп, реттілікпен
Кристалдық тор – кристалдағы атомдар, молекула немесе иондардың кеңістікте периодты түрде реттілікпен орналасуы. Заттың кристалдық күйі бөлшектердің ретпен орналасуына байланысты сипатталады.
Слайд 5 Кристалдар
Белгілі балқу температурасы бар, кристалдық құрылымы бар, физикалық денелер.
Кристалдар – анизотропты, яғни физикалық қасиеттері бағытқа тәуелді;
Кристалда жарықтың таралуы жылдамдығы, жылу өткізгіштігі, серпімділігі бағытқа тәуелді болады;
Кристалл атомдары кеңістікте қатаң тәртіппен орналасып кристалл торын құрайды.
Кристалдар белгілі бір бұрыштармен орналасқан жазық бұрыштардан тұратын болса, монокристалл деп аталады;
Егер кристалл өте ұсақ кристалл жиынтығынан тұратын болса, поликристалл деп аталады.
Слайд 9 Мына суретте иодтың кристалдық құрылымы бейнеленген. Тор түйіндерінде иод
күйі – қатты заттың өзі молекулалық кристалл
деп аталады. Молекулалық кристалдың түйіндерінде полюссіз молекулалар (N2 , I2 т.б.) орналасады. Олар бір –бірін қалай ұстап тұрады?
Йодтың кристалл торы
Слайд 10Молекулалық кристалл торы бар күрделі заттар.
Мұндай құрылысы бар күрделі заттарды
Слайд 11Иондық кристалдар
Иондық кристалдар аттас зарядталған иондардың электростатикалық әсерінің нәтижесінде түзіледі. Кристалдың
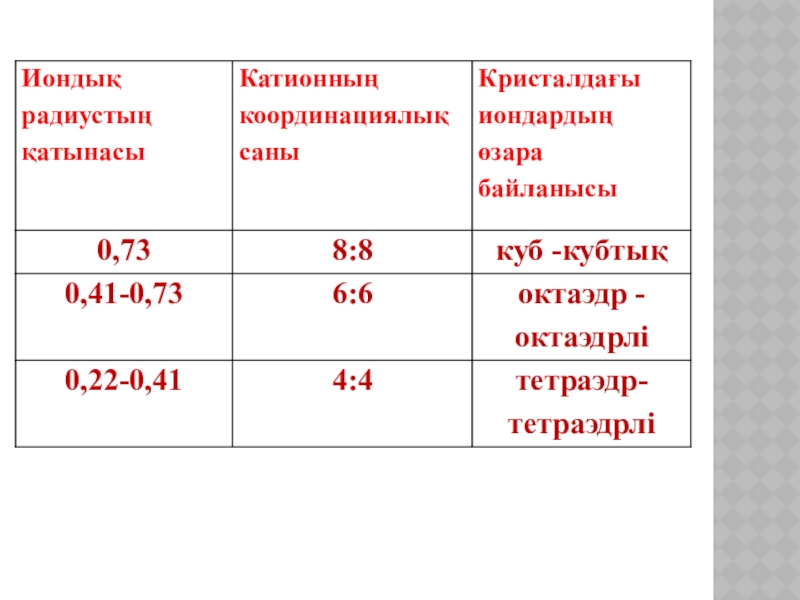
Слайд 12Кристалдық тордағы катион мен анионды қоршайтын аттас емес иондар саны координация
Слайд 14
Иондық кристалл торы бар күрделі заттар.
Бұрын біз типтік металдық элемент
Не болады? Барлық атомдар өзара 1:1 қатынасына сәйкес араласады
және түзілген (Na+) катиондары ретсіз емес, белгілі бір ретпен заңды түрде орналасады.
Неліктен?
Слайд 15Иондық кристалдардың екі ерекшелігіне назар аударсақ.Біріншіден,кристалда бір ионның екінші ионмен байланысының
Слайд 16+
+
+
0
0
0
0
0
-
-
-
Металдық кристалдар
Металдық байланыс деп металдық торда металдардың оң зарядталған иондары
Слайд 17Металды кристалды заттарға: мыс, алюминий, қорғасын, темір жатады. Олардың пішіні төмендегідей
Слайд 18Ковалентті кристалдарға заттарға мысал ретінде алмаз және кварц кристалдарын жатқызуға болады.
Ковалентті кристалдар
Слайд 19 Ковалентті кристалды заттарға мысал ретінде алмаз және кварц кристалдарын
Ковалентті кристалдар
Слайд 20Кристалдағы ақаулар (дефектілер)
Құрамы тұрақты заттар - дальтонидтер деп, ал құрамы ауыспалы
себебі молекуланың құрамына қарай ондағы атомдардың құрылысын анықтауға болады.
Атомды және ионды құрылысты заттарды анағұрлым тұрақты немесе ауыспалы құрамды заттарға жатқызуға болады. Мұның басты себебі кристалдағы нүктелік ақаулар. Ол энтропиялық фактор T ∆ S > 0 қосылыстың құрамының ауыспалы болуының әсерінен жүзеге асады.
Слайд 21Кристалдардың дислокациялануы
Кристалдардың дислокациялануы дегеніміз жазықты, бойлай, жақын маңда орналасқан атомдардың сипаттының
Барлық атомдары минималды энергиялық жағдайда болатын идеалды кристалдар ешуақытта кездеспейді. Кристалдардың идеал торларында ауытқулардың екі түрі бар: тұрақты және уақытша түрі болады. Уақытша ауытқулар кристалдарға механикалық, жылулық және электромагниттік ауытқулардың әсерінен кристалдар арқылы тез бөлшектердің ағыны арқылы жүзеге асады.