- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Изменение агрегатных состояний вещества.
Содержание
- 1. Изменение агрегатных состояний вещества.
- 2. «Физические явления могут быть понятны лишь
- 3. Слайд 3
- 4. Слайд 4
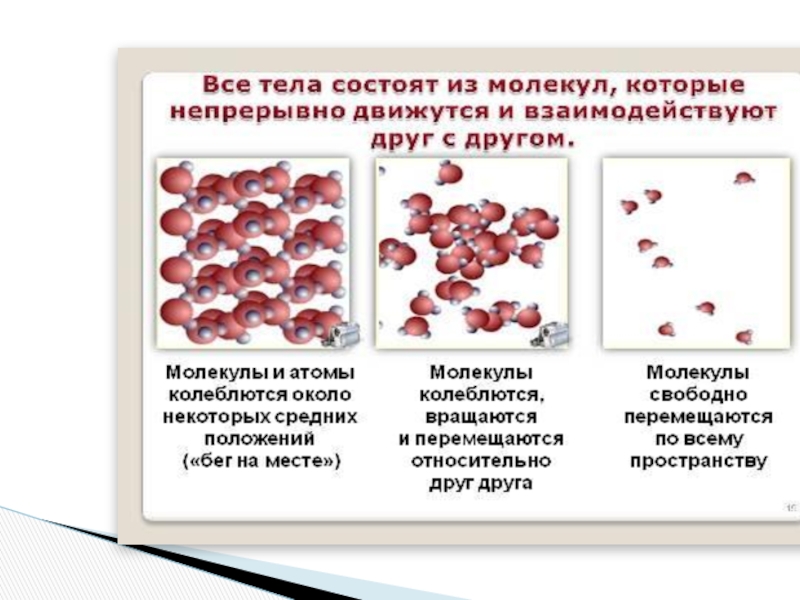
- 5. Любое вещество может находитьсяв трёх состояниях:-твердом-жидком-газообразномМолекулы одного
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
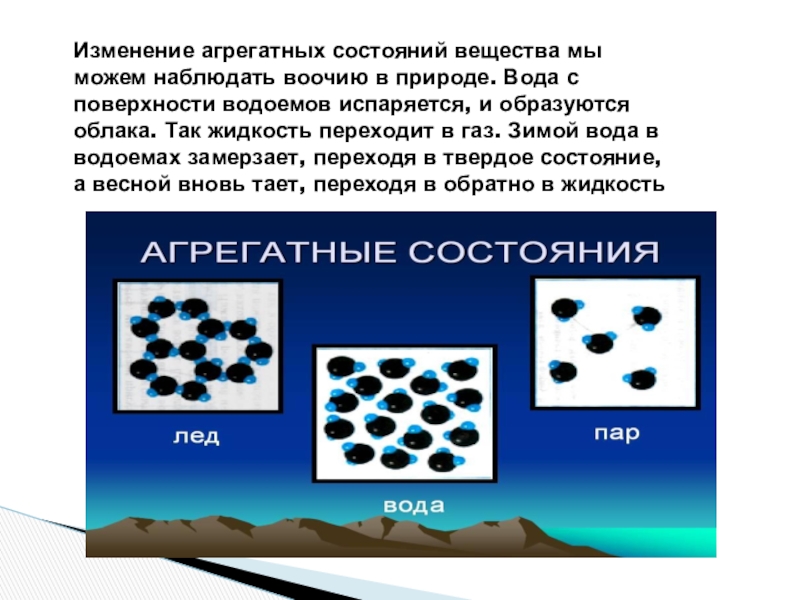
- 9. Изменение агрегатных состояний вещества мы можем наблюдать
- 10. В разных агрегатных состояниях расположение атомов и
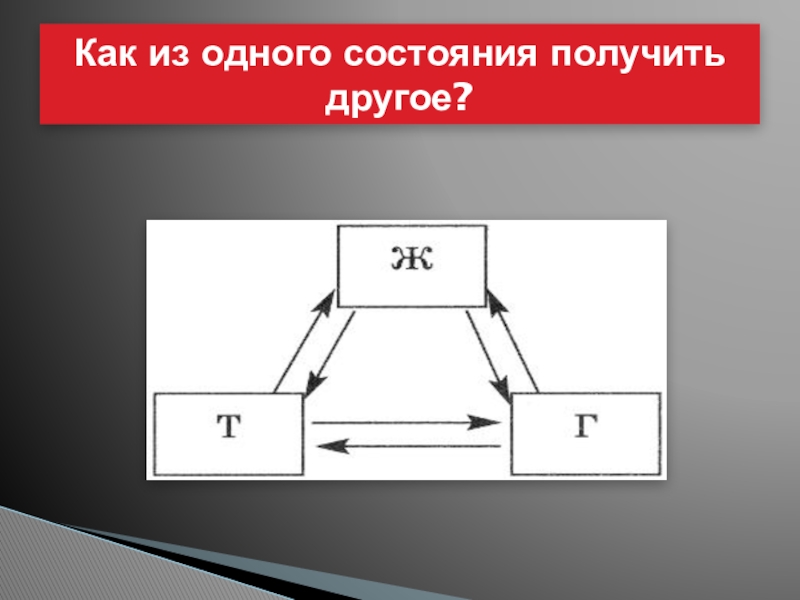
- 11. Как из одного состояния получить другое?
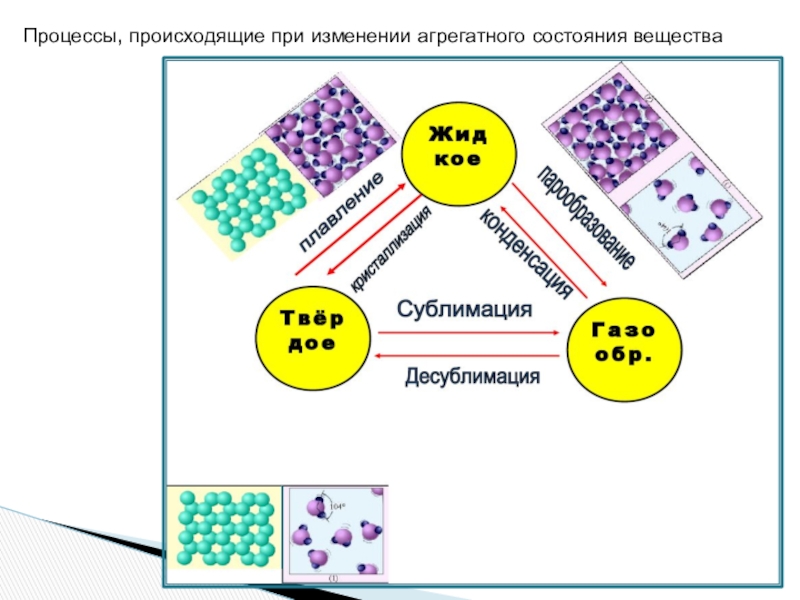
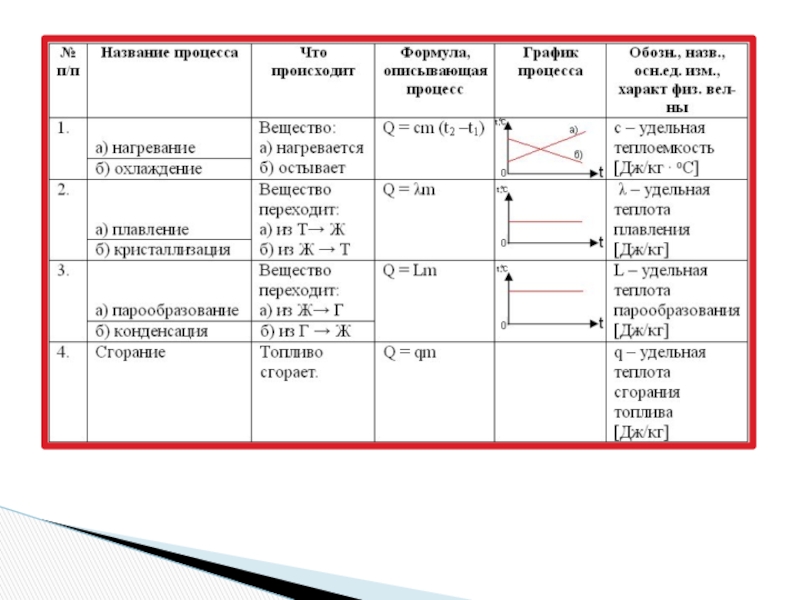
- 12. ШЕСТЬ процессов, в которых происходит изменение агрегатных состояний
- 13. Процессы, происходящие при изменении агрегатного состояния вещества
- 14. Лед плавится, образуя воду, вода испаряется, образуя
- 15. Слайд 15
- 16. Плавление и отвердевание
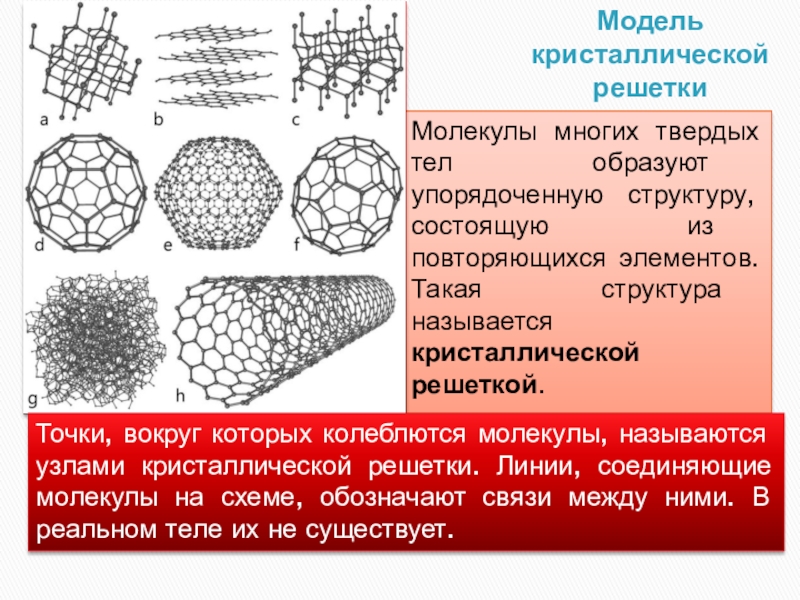
- 17. Модель кристаллической решеткиМолекулы многих твердых тел образуют
- 18. Модель плавления и кристаллизацииПроцесс плавления кристаллического тела,
- 19. Процесс перехода вещества из жидкого состояния в
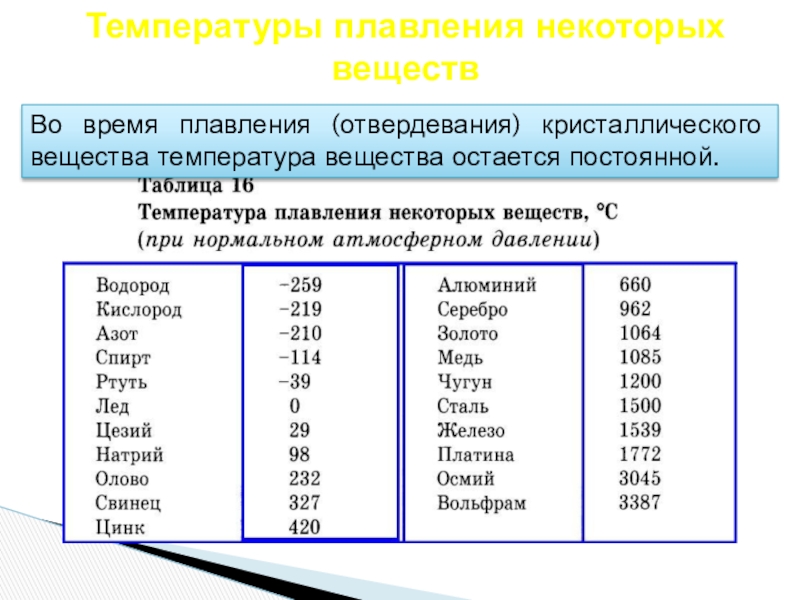
- 20. Температуры плавления некоторых веществВо время плавления (отвердевания) кристаллического вещества температура вещества остается постоянной.
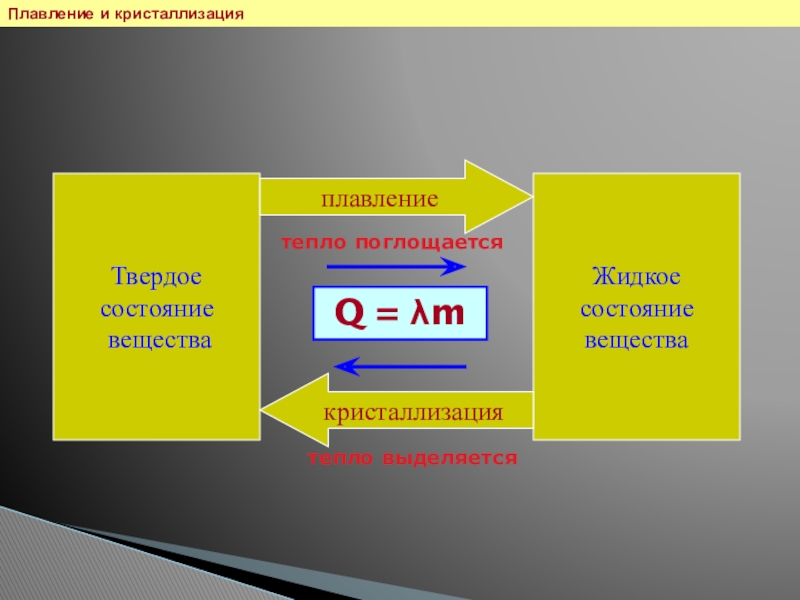
- 21. Плавление и кристаллизация Твердое состояние веществаЖидкое состояние веществаплавлениекристаллизациятепло поглощаетсятепло выделяетсяQ = λm
- 22. График плавления и отвердевания кристаллических тел. AB
- 23. Слайд 23
- 24. Количество теплоты, необходимое для плавления кристаллического
- 25. Физический смысл удельной теплоты плавленияУдельная теплота плавления
- 26. Процесс перехода вещества из жидкого состояния в
- 27. Слайд 27
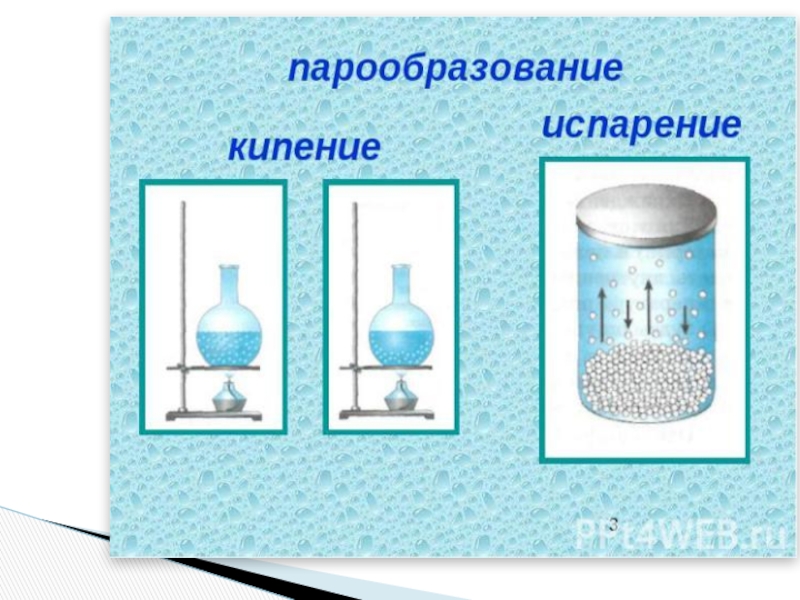
- 28. Способы перехода жидкости в газообразное состояние:испарение
- 29. Слайд 29
- 30. Слайд 30
- 31. При кипении жидкость испаряется не только со
- 32. Таблица кипения некоторых веществ. Температура кипения.
- 33. Испарением называется фазовый переход из жидкого состояния
- 34. Слайд 34
- 35. Вода в бутылке, плотно закрытой пробкой, не
- 36. Слайд 36
- 37. Слайд 37
- 38. Слайд 38
- 39. Процесс перехода вещества из газообразного состояния
- 40. Слайд 40
- 41. Конденсация – это процесс, обратный процессу испарения.Роса на паутинкеКонденсация на бутылке холодной воды
- 42. Слайд 42
- 43. ПАР, НАХОДЯЩИЙСЯ В ДИНАМИЧЕСКОМ РАВНОВЕСИИ СО СВОЕЙ
- 44. Атмосферный воздух из-за непрерывного испарения водысодержит водяные пары и бывает различной степени влажности
- 45. Слайд 45
- 46. Слайд 46
- 47. Слайд 47
- 48. Слайд 48
- 49. 3.КОНДЕНСАЦИОННЫЙГИГРОМЕТР.2.ПСИХРОМЕТР1.ВОЛОСНОЙГИГРОМЕТР
- 50. Слайд 50
- 51. Точка росыТемпература, при которой пар,находящийся в воздухе,становится
- 52. Процесс перехода вещества из твердого состояния в
- 53. Бабушкин сундук с запахом нафталинаСублимация-
- 54. Процесс перехода вещества из газообразногосостояния в твердое
- 55. Узор на окне (десублимация)
- 56. ЛитератураФизика. 8 кл.: Учебник для общеобразоват. школ
Слайд 2
«Физические явления могут быть понятны лишь после того, как изучены
Т. Гоббс (англ. философ)
Слайд 5Любое вещество может находиться
в трёх состояниях:
-твердом
-жидком
-газообразном
Молекулы одного и того же вещества
Слайд 9Изменение агрегатных состояний вещества мы можем наблюдать воочию в природе. Вода
Слайд 10В разных агрегатных состояниях расположение атомов и молекул различно
Внутренняя энергия одинаковых
Слайд 12
ШЕСТЬ процессов, в которых происходит изменение агрегатных состояний веществ.
1.Переход вещества из твердого
2.Обратный процесс – кристаллизацией.
3.Когда вещество переходит из жидкости в газ, это называется парообразованием,
4.Из газа в жидкость – конденсацией.
5.Переход из твердого состояния сразу в газ, минуя жидкое, называют сублимацией,
6.Обратный процесс – десублимацией.
Слайд 14Лед плавится, образуя воду, вода испаряется, образуя пар.
В обратную сторону
а вода, замерзая, становится льдом..
Запах любого твердого тела – это и есть сублимация. Часть молекул вырывается из тела, образуя газ, который мы и можем унюхать.
А пример обратного процесса – это узоры на стеклах зимой, когда пар в воздухе, замерзая, оседает на стекле и образует причудливые узоры.
Слайд 17Модель кристаллической решетки
Молекулы многих твердых тел образуют упорядоченную структуру, состоящую из
Точки, вокруг которых колеблются молекулы, называются узлами кристаллической решетки. Линии, соединяющие молекулы на схеме, обозначают связи между ними. В реальном теле их не существует.
Слайд 18Модель плавления и кристаллизации
Процесс плавления кристаллического тела, это процесс разрушения его
Плавление происходит с поглощением тепла, но температура тела при этом не изменяется.
Процесс кристаллизации - процесс обратный плавлению - происходит с выделением тепла. Температура тела при этом также остается постоянной.
Слайд 19Процесс перехода вещества из жидкого состояния в твердое называется отвердеванием или
Вещества отвердевают при той же тем температуре, при которой плавятся.
Процесс перехода вещества из твердого состояния в жидкое называется плавлением. Температура, при которой вещество плавится, называется температурой плавления вещества.
Плавление
Отвердевание (кристаллизация)
Слайд 20Температуры плавления некоторых веществ
Во время плавления (отвердевания) кристаллического вещества температура вещества
Слайд 21Плавление и кристаллизация
Твердое
состояние
вещества
Жидкое
состояние
вещества
плавление
кристаллизация
тепло поглощается
тепло выделяется
Q =
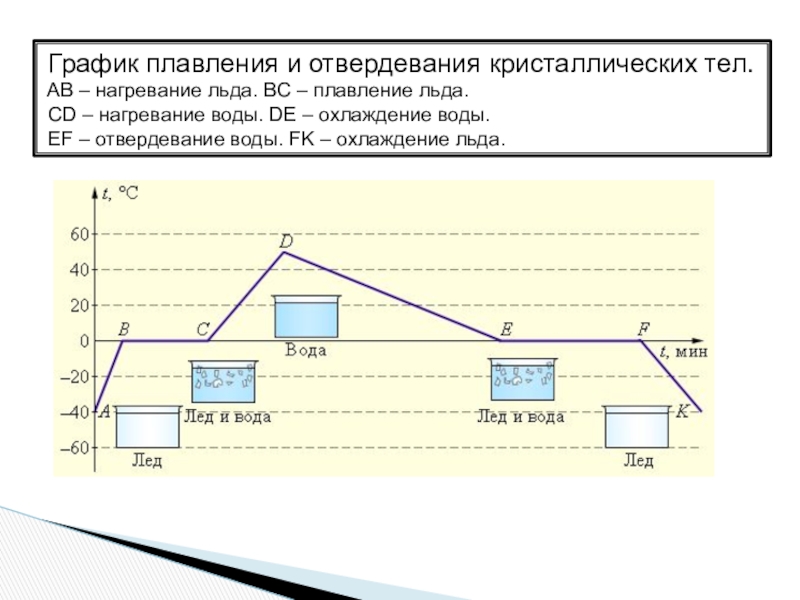
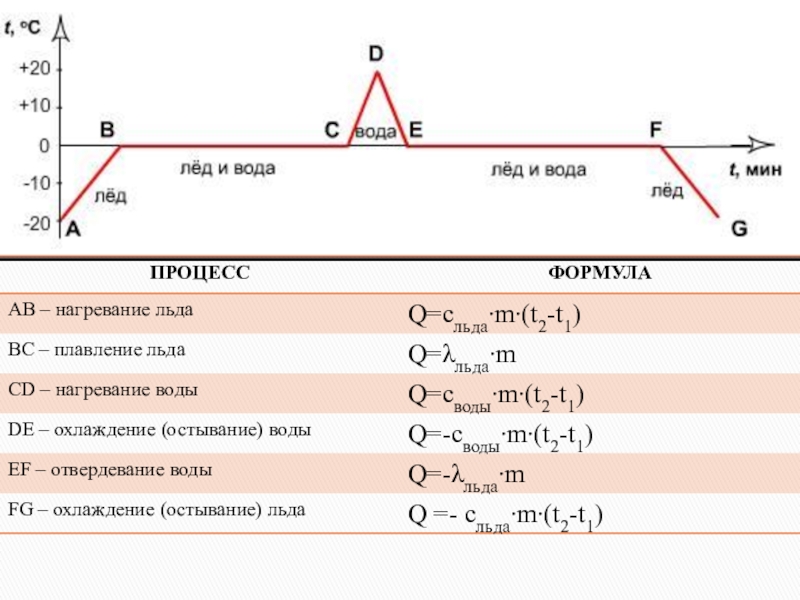
Слайд 22 График плавления и отвердевания кристаллических тел.
AB – нагревание льда. BC
CD – нагревание воды. DE – охлаждение воды.
EF – отвердевание воды. FK – охлаждение льда.
Слайд 24
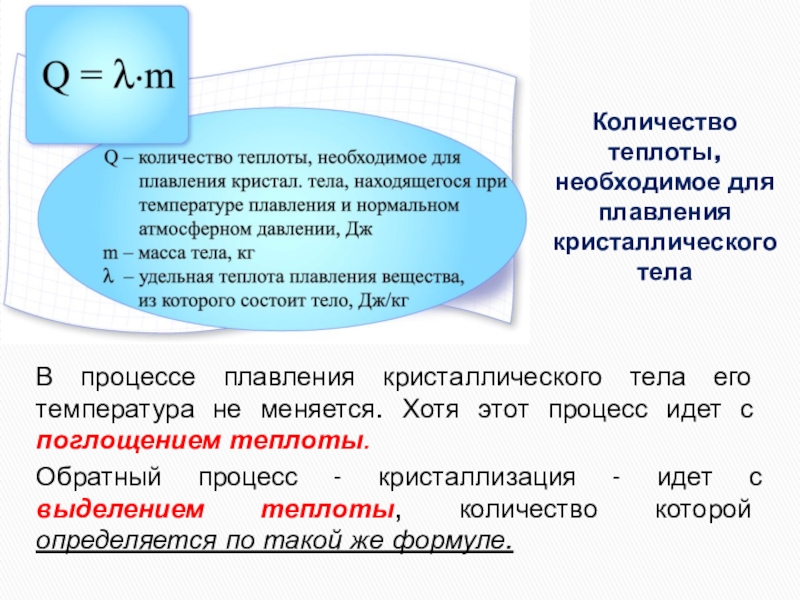
Количество теплоты, необходимое для плавления кристаллического тела
В процессе плавления кристаллического тела
Обратный процесс - кристаллизация - идет с выделением теплоты, количество которой определяется по такой же формуле.
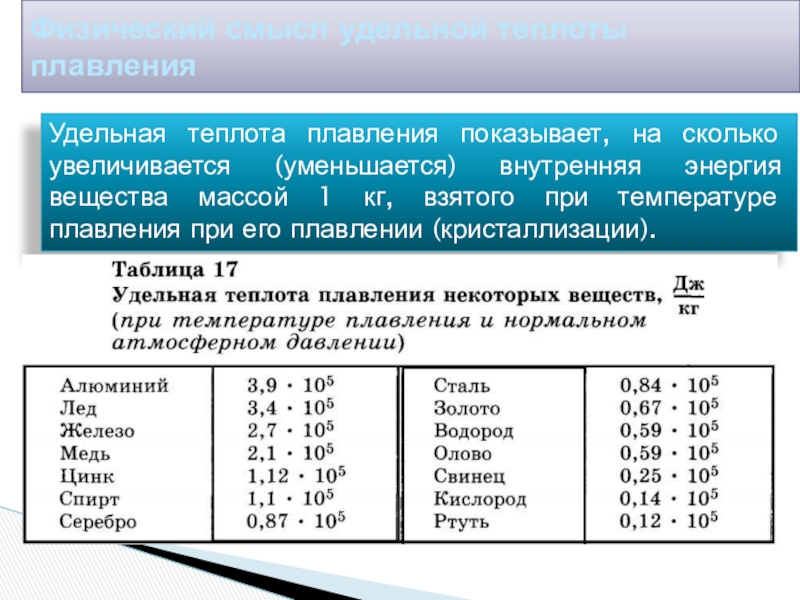
Слайд 25Физический смысл удельной теплоты плавления
Удельная теплота плавления показывает, на сколько увеличивается
Слайд 26
Процесс перехода вещества из жидкого состояния в газообразное называется парообразованием.
Жидкость
Слайд 28
Способы перехода жидкости в газообразное состояние:
испарение
ИСПАРЕНИЕ – парообразование с открытой поверхности
Зависит от: 1) S поверхности ---- ПО
2) «ветер» ---- ВО
3) Род жидкости --- РО
4) t0 (чем > t0 , тем > V…) ---- T
t0 понижается!
Слайд 31При кипении жидкость испаряется не только со свободной поверхности, но и
Кипение происходит при определенной для каждой жидкости температуре, температуре кипения.
Для продолжения кипения необходимо подводить энергию к кипящей жидкости.
Слайд 33Испарением называется фазовый переход из жидкого состояния в газообразное.
С точки
Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Скорость испарения жидкости зависит от площади ее поверхности.
Слайд 35Вода в бутылке, плотно закрытой пробкой, не испаряется- возникает динамическое равновесие
Молекулы переходят их жидкости в пар и обратно. Сначала число молекул , вылетевших из жидкости больше числа молекул, возвратившихся обратно-плотность пара в сосуде увеличивается. Затем их количество выравнивается- динамическое равновесие.
Слайд 39
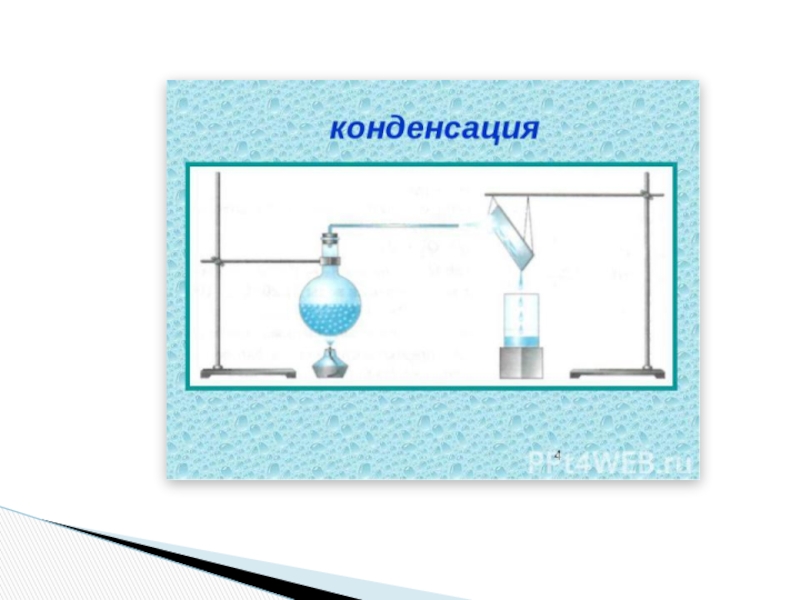
Процесс перехода вещества из газообразного состояния в жидкое называется конденсацией.
При конденсации происходит выделение некоторого количества теплоты в окружающую среду.
Газ жидкость
Слайд 41Конденсация – это процесс, обратный процессу испарения.
Роса на паутинке
Конденсация на бутылке
Слайд 43ПАР, НАХОДЯЩИЙСЯ В ДИНАМИЧЕСКОМ РАВНОВЕСИИ
СО СВОЕЙ ЖИДКОСТЬЮ, НАЗЫВАЕТСМЯ НАСЫЩЕННЫМ ПАРОМ.
ПАР,
СО СВОЕЙ ЖИДКОСТЬЮ, НАЗЫВАЕТСМЯ НЕНАСЫЩЕННЫМ ПАРОМ.
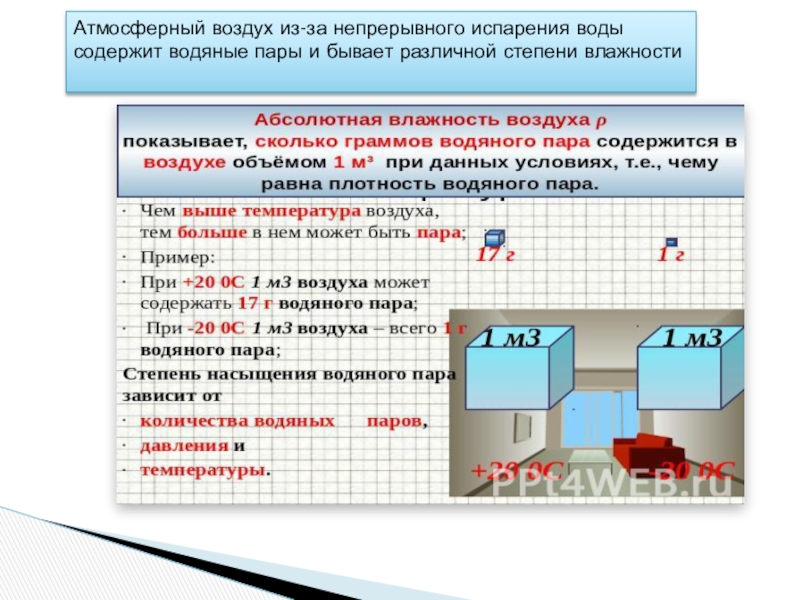
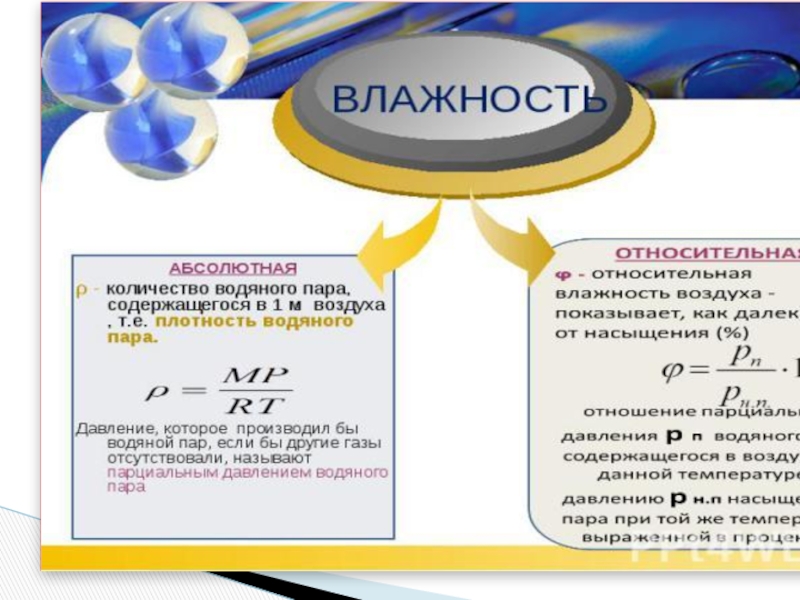
Слайд 44Атмосферный воздух из-за непрерывного испарения воды
содержит водяные пары и бывает различной
Слайд 51Точка росы
Температура, при которой пар,
находящийся в воздухе,
становится насыщенным,
называется точкой
-выпадение росы под утро,
-запотевание холодного стекла, если на него подышать,
-образование капли воды на холодной
водопроводной трубе,
-сырость в подвалах дома
Слайд 52
Процесс перехода вещества из твердого состояния в газообразное
называется
сублимацией
Твердое тело
Слайд 54Процесс перехода вещества из газообразного
состояния в твердое называется
десублимацией
Газ
Слайд 56Литература
Физика. 8 кл.: Учебник для общеобразоват. школ / А.В.Перышкин– М.: Дрофа,
2. Физика: 7-11 классы. Библиотека электронных наглядных пособий http://school-collection.edu.ru
3.Справочник школьника. Решение задач по физике / Сост. И.Г. Власова. М. – Филологическое общество «Слово», компания «Ключ-С», АСТ, Центр гуманитарных наук при факультете журналистики МГУ им. М.В. Ломоносова. - 1996. 640 с.
4.http://ru.wikipedia.org/wiki/Углерод