- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Электрический ток в жидкостях
Содержание
- 1. Электрический ток в жидкостях
- 2. Электрический токв жидкостях
- 3. Чистая дистил-лированная вода-практически диэлектрик.Поэтому лампочка не горит!
- 4. При добавлении в дистиллированную воду-соли, вода становится хорошим проводником тока.И лампочка загорается
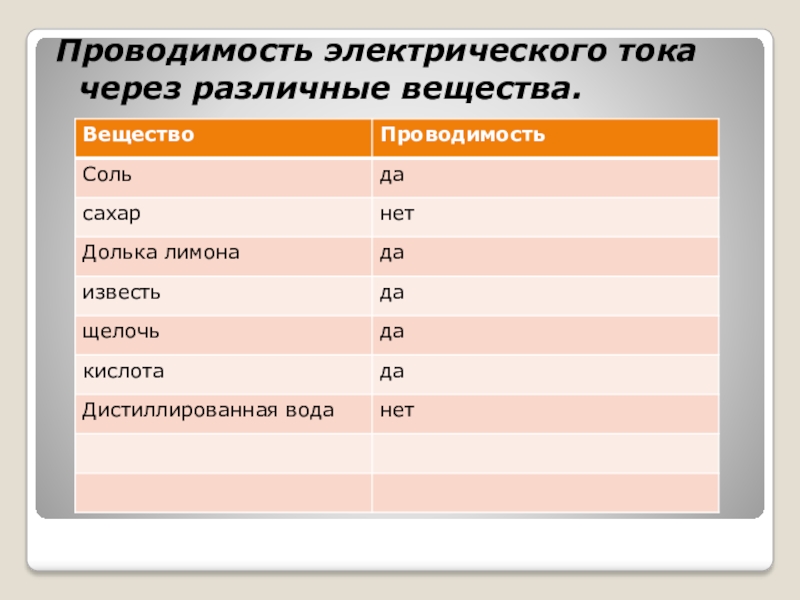
- 5. Проводимость электрического тока через различные вещества.
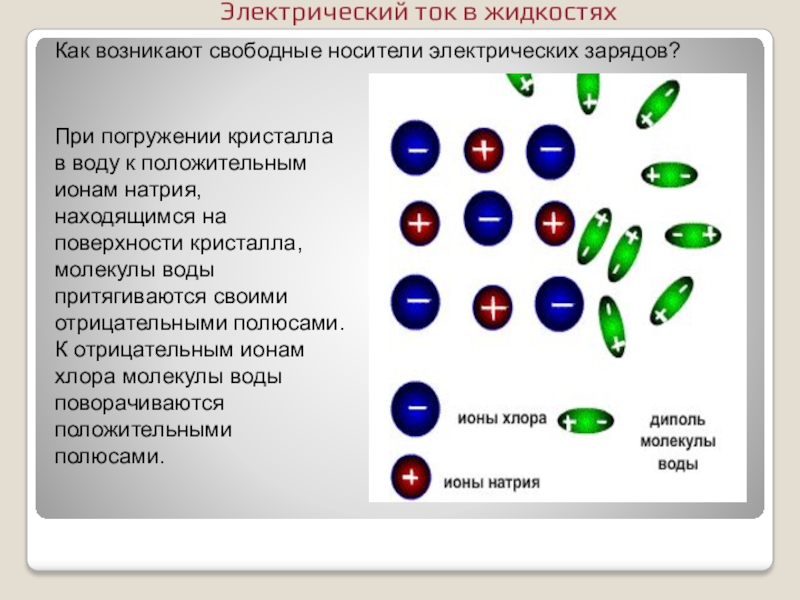
- 6. Как возникают свободные носители электрических зарядов?При погружении
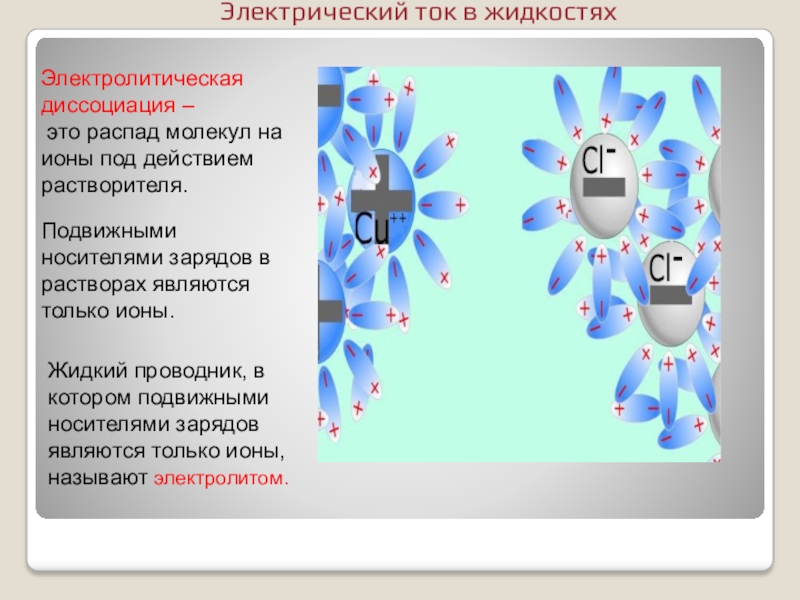
- 7. Электролитическая диссоциация – это распад молекул на
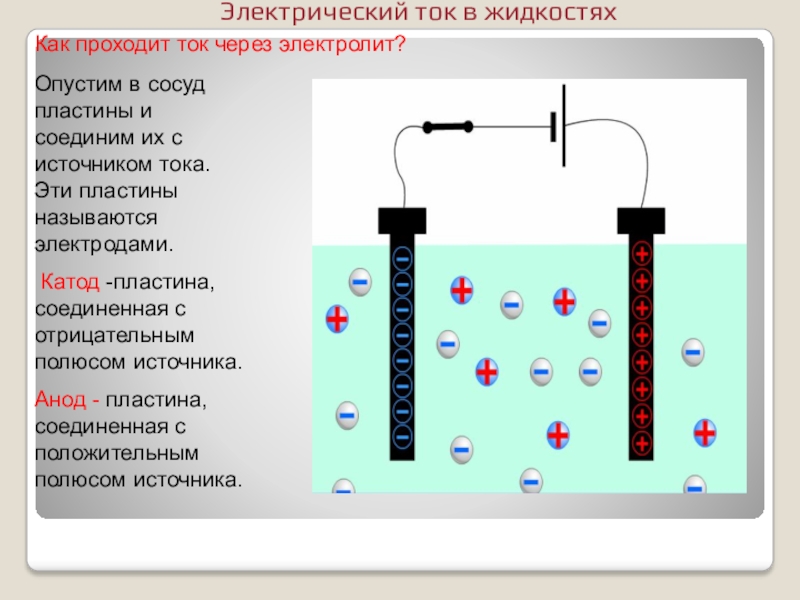
- 8. Как проходит ток через электролит? Опустим в
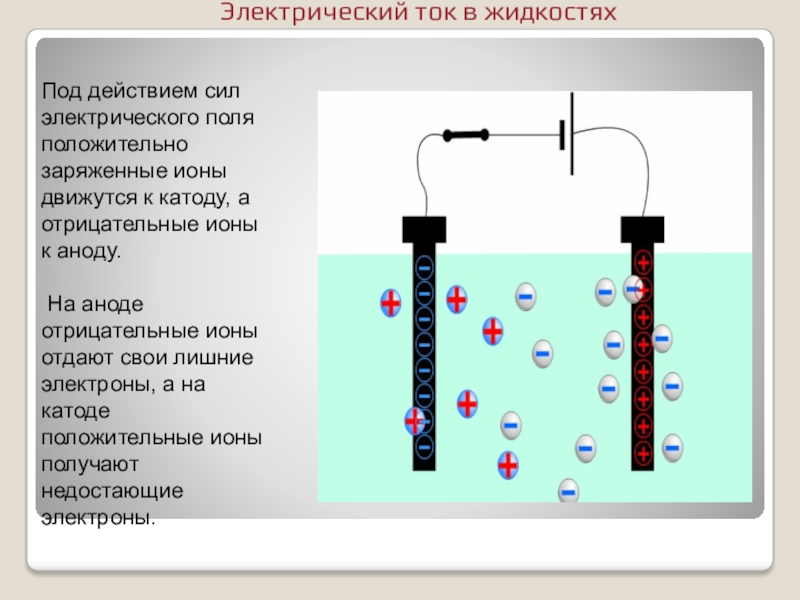
- 9. Под действием сил электрического поля положительно заряженные
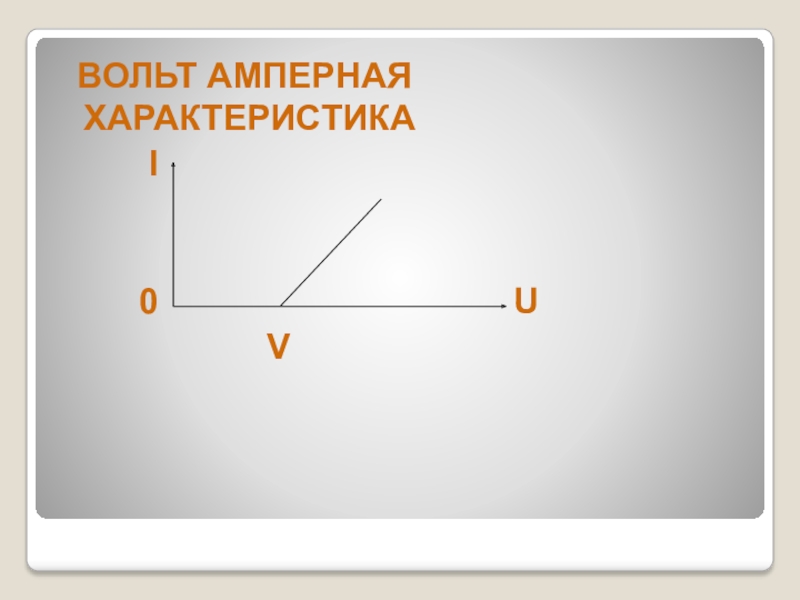
- 10. ВОЛЬТ АМПЕРНАЯ ХАРАКТЕРИСТИКА
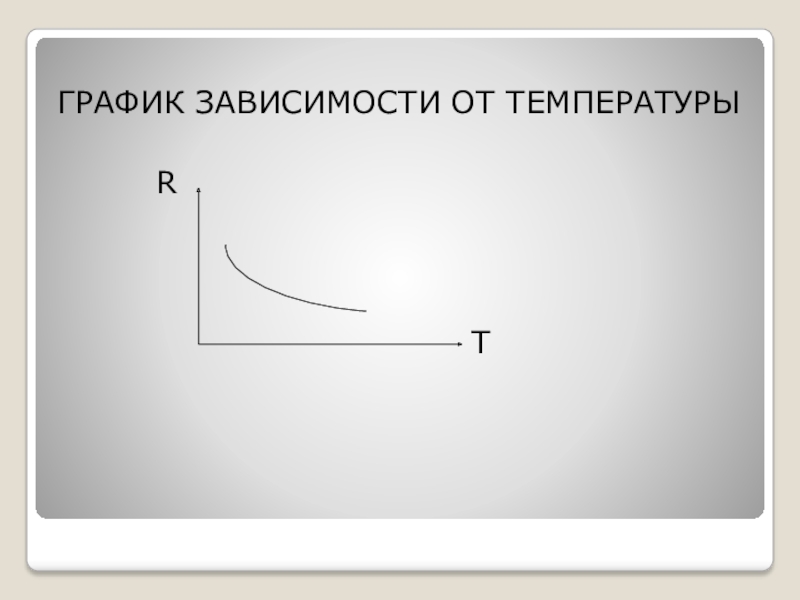
- 11. ГРАФИК ЗАВИСИМОСТИ ОТ ТЕМПЕРАТУРЫ
- 12. Применение электрического тока в жидкостях
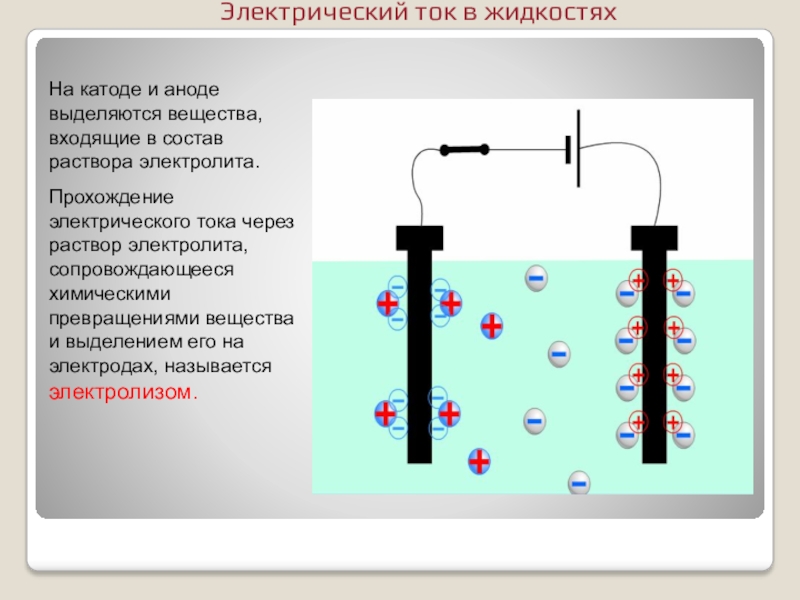
- 13. На катоде и аноде выделяются вещества, входящие
- 14. ЭЛЕКТРОМЕТАЛЛУРГИЯЯВЛЕНИЕ ЭЛЕКТРОЛИЗА ИСПОЛЬЗУЕТСЯ ДЛЯ ПОЛУЧЕНИЯ АЛЮМИНИЯ, НАТРИЯ
- 15. Электролиз- это
- 16. Масса вещества, выделившегося на электроде, прямо пропорциональна
- 17. РАФИНИРОВАНИЕ МЕТАЛЛОВМЕТАЛЛУРГИЧЕСКАЯ МЕДЬ, СОДЕРЖИТ КАК
- 18. Гальваностегия – электрический способ покрытия предметов не окисляющимися металлами.
- 19. Установка для электрохимического покрытия предметов слоем металла
- 20. Цель гальваностегии- придать предметам определенные свойства:- повышенную
- 21. Отрасли промышленности в которых используется гальваностегия:Автомобилестроение;Авиастроение;Радиотехника;Электротехника;Пищевая промышленность(производство упаковок)
- 22. ГАЛЬВАНОПЛАСТИКАИСПОЛЬЗУЯ ЯВЛЕНИЕ ЭЛЕКТРОЛИЗА, МОЖНО ПОЛУЧАТЬ АБСОЛЮТНО ТОЧНЫЕ
- 23. Старинные кружева, покрытые слоем металла.
- 24. Слайд 24
- 25. Электролиз – сложный физико-химический процесс, происходящий не
- 26. Слайд 26
Слайд 4При добавлении в дистиллированную воду-соли, вода становится хорошим проводником тока.И лампочка
Слайд 6Как возникают свободные носители электрических зарядов?
При погружении кристалла в воду к
Электрический ток в жидкостях
Слайд 7Электролитическая диссоциация –
это распад молекул на ионы под действием растворителя.
Подвижными
Жидкий проводник, в котором подвижными носителями зарядов являются только ионы, называют электролитом.
Электрический ток в жидкостях
Слайд 8Как проходит ток через электролит?
Опустим в сосуд пластины и соединим
Катод -пластина, соединенная с отрицательным полюсом источника.
Анод - пластина, соединенная с положительным полюсом источника.
Электрический ток в жидкостях
Слайд 9Под действием сил электрического поля положительно заряженные ионы движутся к катоду,
На аноде отрицательные ионы отдают свои лишние электроны, а на катоде положительные ионы получают недостающие электроны.
Электрический ток в жидкостях
Слайд 13На катоде и аноде выделяются вещества, входящие в состав раствора электролита.
Прохождение
Электрический ток в жидкостях
Слайд 14ЭЛЕКТРОМЕТАЛЛУРГИЯ
ЯВЛЕНИЕ ЭЛЕКТРОЛИЗА ИСПОЛЬЗУЕТСЯ ДЛЯ ПОЛУЧЕНИЯ АЛЮМИНИЯ, НАТРИЯ МАГНИЯ, БЕРИЛЛИЯ И ДРУГИХ
ЕСЛИ МЕЖДУ ДНОМ ВАННЫ И УГОЛЬНЫМИ ЭЛЕКТРОДАМИ ЗАЖЕЧЬ ЭЛЕКТРИЧЕСКУЮ ДУГУ, В КОТОРОЙ ТЕМПЕРАТУРА ПРЕВОСХОДИТ 2500 К. В ПЛАМЕНИ ДУГИ РУДА БУДЕТ ПЛАВИТЬСЯ И ПРОИСХОДИТЬ ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ МОЛЕКУЛ. ЧЕРЕЗ ОБРАЗУЮЩИЙСЯ ДИССОЦИИРОВАННЫЙ РАСПЛАВ ПРОПУСТИТЬ ЭЛЕКТРИЧЕСКИЙ ТОК, В РЕЗУЛЬТАТЕ ЧЕГО, НА ДНЕ ВАННЫ БУДУТ ОСЕДАТЬ МОЛЕКУЛЫ МЕТАЛЛА. РАСПЛАВЛЕННЫЙ МЕТАЛЛ БУДЕТ СТЕКАТЬ ПО НАКЛОННОМУ ДНУ ВАННЫ В СПЕЦИАЛЬНЫЕ КОВШИ.
Слайд 15 Электролиз- это совокупность процессов, протекающих в растворе или расплаве электролита, при
Слайд 16Масса вещества, выделившегося на электроде, прямо пропорциональна заряду q, прошедшему через
Закон электролиза
Электрический ток в жидкостях
Величину k называют электрохимическим эквивалентом.
Опыты Фарадея показали, что масса выделившегося при электролизе вещества зависит не только от силы тока I , времени t, но и от рода вещества.
Слайд 17 РАФИНИРОВАНИЕ МЕТАЛЛОВ
МЕТАЛЛУРГИЧЕСКАЯ МЕДЬ, СОДЕРЖИТ КАК ПРАВИЛО РАЗЛИЧНЫЕ ПРИМЕСИ.
ДЛЯ ОЧИСТКИ
ПРИ ПРОХОЖДЕНИИ ЭЛЕКТРИЧЕСКОГО ТОКА ЧЕРЕЗ ЭЛЕКТРОЛИТ ЧИСТАЯ МЕДЬ ВЫДЕЛЯЕТСЯ НА КАТОДЕ, А АНОД ПОСТЕПЕННО РАСТВОРЯЕТСЯ. ПРИМЕСИ ВЫПАДАЮТ В ОСАДОК. КОНЦЕНТРАЦИЯ МЕДНОГО КУПОРОСА ОСТАЕТСЯ ПОСТОЯННОЙ.
Слайд 20Цель гальваностегии- придать предметам определенные свойства:
- повышенную коррозийную стойкость (цинкование, кадмирование,
- износостойкость (железнение, хромирование)
- защитно-декоративные(покрытие драгоценными металлами)
Слайд 21Отрасли промышленности в которых используется гальваностегия:
Автомобилестроение;
Авиастроение;
Радиотехника;
Электротехника;
Пищевая промышленность(производство упаковок)
Слайд 22ГАЛЬВАНОПЛАСТИКА
ИСПОЛЬЗУЯ ЯВЛЕНИЕ ЭЛЕКТРОЛИЗА, МОЖНО ПОЛУЧАТЬ АБСОЛЮТНО ТОЧНЫЕ РЕЛЬЕФНЫЕ КОПИИ ПРЕДМЕТОВ. ДЛЯ
ПОДГОТОВЛЕННЫЙ СЛЕПОК ПОМЕЩАЮТ В ЭЛЕКТРОЛИТИЧЕСКУЮ ВАННУ В КАЧЕСТВЕ КАТОДА. ПРОПУСКАЯ ЧЕРЕЗ ВАННУ ЭЛЕКТРИЧЕСКИЙ ТОК, ПОКРЫВАЮТ СЛЕПОК ТОЛСТЫМ СЛОЕМ МЕТАЛЛА. С ПОМОЩЬЮ ГАЛЬВАНОПЛАСТИКИ ИЗГОТАВЛИВАЮТСЯ ТОЧНЫЕ КОПИИ ДРАГОЦЕННЫХ УКРАШЕНИЙ НАЙДЕННЫХ ПРИ АРХЕОЛОГИЧЕСКИХ РАСКОПКАХ И ДРУГЕЕ.
Слайд 24 электрохимия
Электрохимия, как наука,
Слайд 25
Электролиз – сложный физико-химический процесс, происходящий не только внутри жидкости, но
Электрический ток в жидкостях создается движением ионов (которые переносят вещество).
При создании определенных условий можно получить целевой продукт с заранее заданными свойствами и качествами.
ВЫВОД: