литературу по интересующей меня теме.
Изучить физические свойства воды.
Проанализировать состав природных примесей воды, их концентрацию в воде.
Провести практическое исследование влияния примесей на температуру кипения воды.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Домашний экспериментальное исследование по физике
Содержание
- 1. Домашний экспериментальное исследование по физике
- 2. Кипение - это интенсивный способ парообразования, происходящий как с поверхности, так и изнутри жидкости.
- 3. Кипение – это интенсивный переход жидкости в
- 4. FаFтУсловия кипения жидкости:Наличие центров парообразованияНаличие постоянного подвода
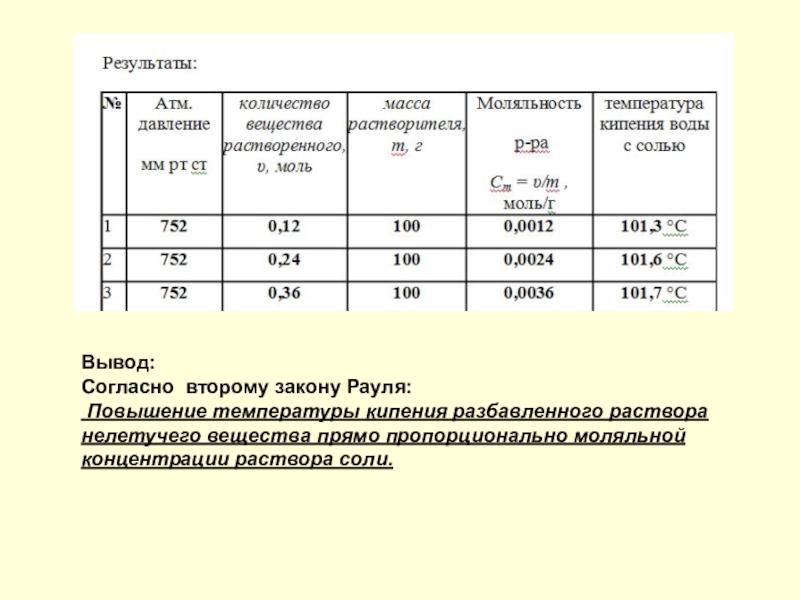
- 5. Согласно II закону Рауля: Повышение температуры кипения
- 6. Что же такое моляльная концентрация раствора? Моляльность
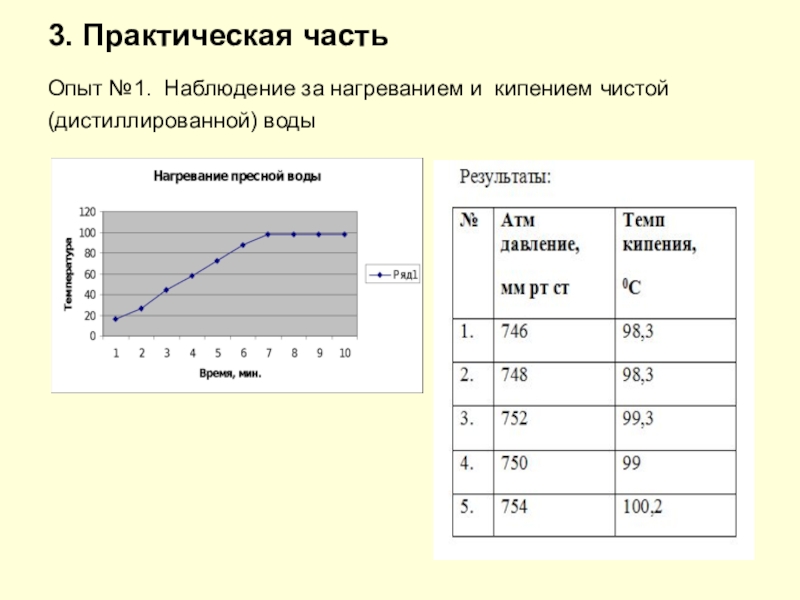
- 7. 3. Практическая часть Опыт №1. Наблюдение за нагреванием и кипением чистой (дистиллированной) воды
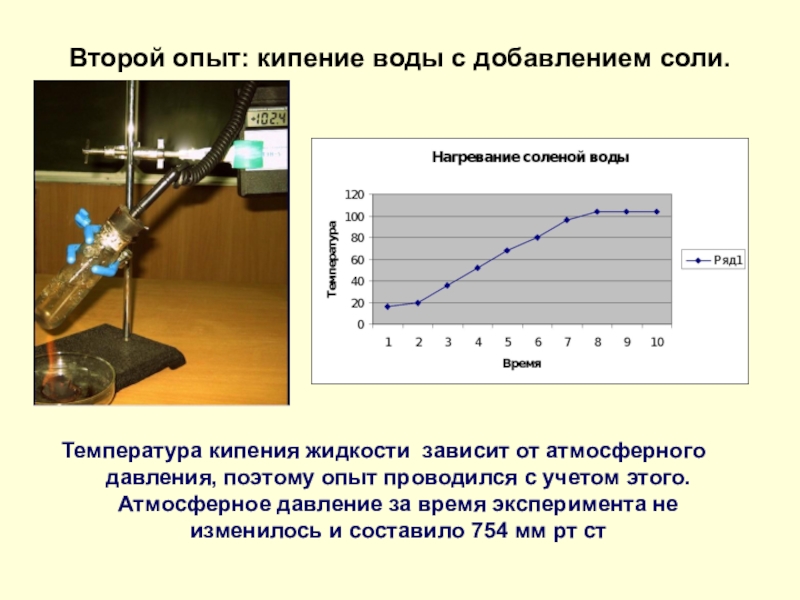
- 8. Второй опыт: кипение воды с добавлением соли.
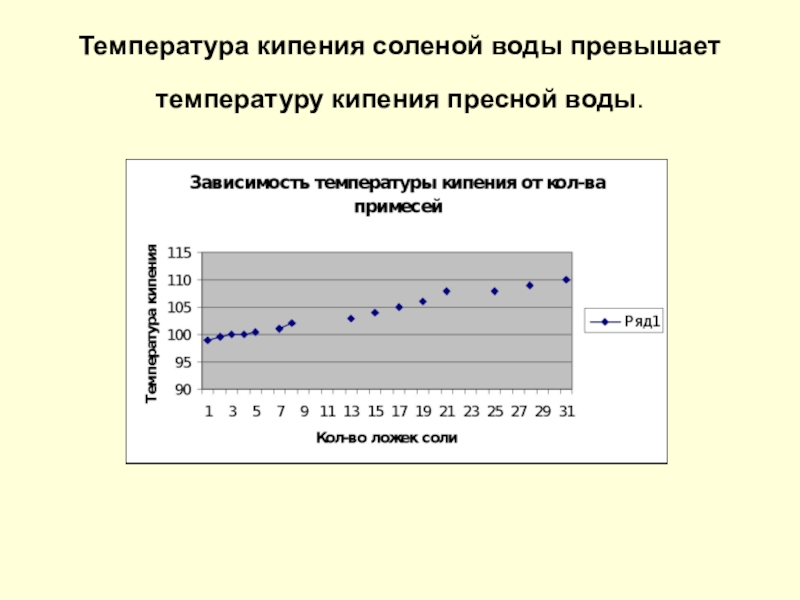
- 9. Температура кипения соленой воды превышает температуру кипения пресной воды.
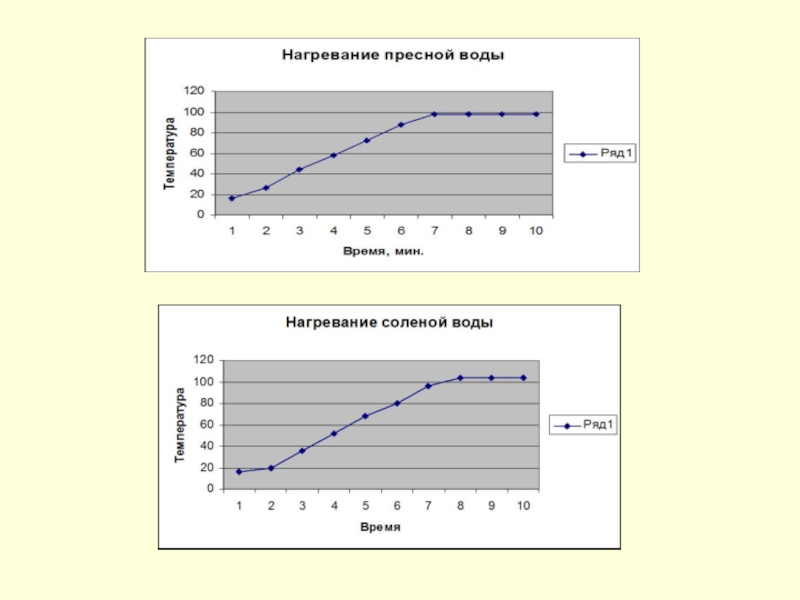
- 10. Слайд 10
- 11. Вывод:Согласно второму закону Рауля: Повышение температуры кипения
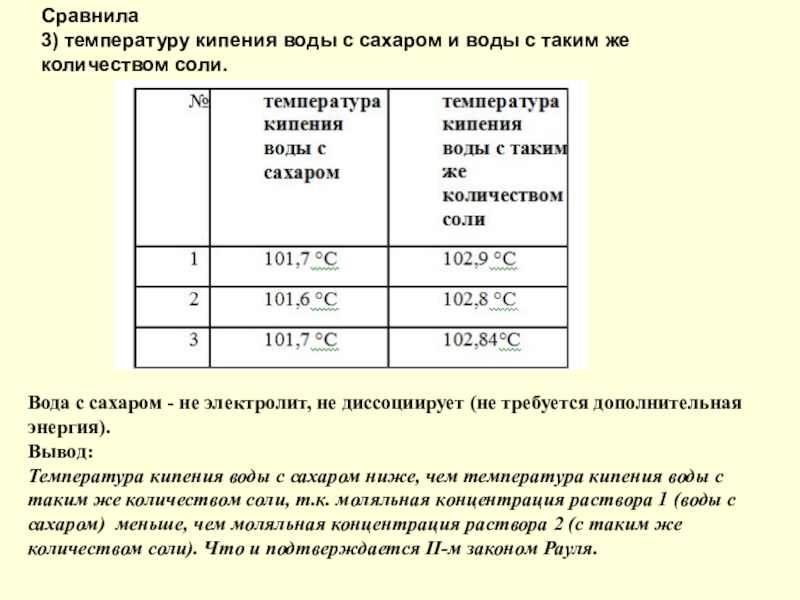
- 12. Сравнила 3) температуру кипения воды с сахаром
- 13. Слайд 13
- 14. Вывод: Следовательно, объяснить изменения
- 15. Список литературы:А. В. Перышкин «Физика-8», М. Дрофа,
Кипение - это интенсивный способ парообразования, происходящий как с поверхности, так и изнутри жидкости.
Слайд 1Цель работы: изучить влияние наличия примесей на температуру кипения воды.
Задачи:
Изучить научную
Слайд 2Кипение - это интенсивный способ парообразования, происходящий как с поверхности, так
и изнутри жидкости.
Слайд 3Кипение – это интенсивный переход жидкости в пар, происходящий с образованием
пузырьков пара по всему объёму жидкости при определённой температуре. Температура, при которой жидкость кипит, называют
температурой кипения.
Слайд 4
Fа
Fт
Условия
кипения
жидкости:
Наличие центров парообразования
Наличие постоянного подвода тепла
Давление насыщенного пара должно
быть равно давлению внутри жидкости.
рж=ρжgh +pатм
рж=ρжgh +pатм
Слайд 5Согласно II закону Рауля:
Повышение температуры кипения разбавленного раствора нелетучего вещества
прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества.
Проще говоря, чем больше масса растворённого вещества, тем сильнее ПОВЫШАЕТСЯ температура кипения раствора.
И она повышается ВСЕГДА, чтобы ни растворили.
Проще говоря, чем больше масса растворённого вещества, тем сильнее ПОВЫШАЕТСЯ температура кипения раствора.
И она повышается ВСЕГДА, чтобы ни растворили.
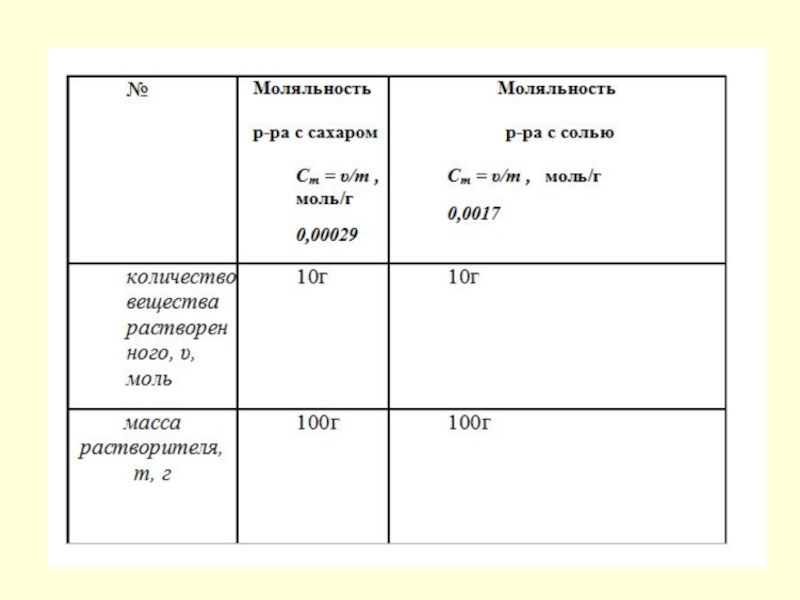
Слайд 6Что же такое моляльная концентрация раствора?
Моляльность раствора показывает количество (число моль)
растворенного вещества в 1 кг растворителя.
Моляльную концентрацию выражают в моль/кг.
Формула для ее определения такова: Cm = υ/m , где
υ – количество вещества растворенного, (моль);
m – масса растворителя, (кг)
Моляльную концентрацию выражают в моль/кг.
Формула для ее определения такова: Cm = υ/m , где
υ – количество вещества растворенного, (моль);
m – масса растворителя, (кг)
Слайд 73. Практическая часть Опыт №1. Наблюдение за нагреванием и кипением чистой (дистиллированной)
воды
Слайд 8Второй опыт: кипение воды с добавлением соли.
Температура кипения жидкости зависит
от атмосферного давления, поэтому опыт проводился с учетом этого. Атмосферное давление за время эксперимента не изменилось и составило 754 мм рт ст
Слайд 11Вывод:
Согласно второму закону Рауля:
Повышение температуры кипения разбавленного раствора нелетучего вещества
прямо пропорционально моляльной концентрации раствора соли.
Слайд 12Сравнила 3) температуру кипения воды с сахаром и воды с таким же
количеством соли.
Вода с сахаром - не электролит, не диссоциирует (не требуется дополнительная энергия).
Вывод:
Температура кипения воды с сахаром ниже, чем температура кипения воды с таким же количеством соли, т.к. моляльная концентрация раствора 1 (воды с сахаром) меньше, чем моляльная концентрация раствора 2 (с таким же количеством соли). Что и подтверждается II-м законом Рауля.
Слайд 14Вывод:
Следовательно, объяснить изменения температуры кипения воды можно на
основании химических связей
Вода с солью- это электролит в отличие от воды с сахаром. Наблюдается гидратация с разрушением молекул воды, а на это требуется дополнительная энергия. Температура кипения повышается.
Температура кипения зависит от моляльной концентрации раствора (II закон Рауля).
Вода с солью- это электролит в отличие от воды с сахаром. Наблюдается гидратация с разрушением молекул воды, а на это требуется дополнительная энергия. Температура кипения повышается.
Температура кипения зависит от моляльной концентрации раствора (II закон Рауля).
Слайд 15Список литературы:
А. В. Перышкин «Физика-8», М. Дрофа, 2006г.
А. А. Равдель, А.
М. Пономарева Краткий справочник физико-химических величин. Ленинград, «Химия», 1983г.
Физический энциклопедический словарь. М. Советская энциклопедия,1968г.
А. С. Енохович Справочник по физике. М.Просвещение,1978г.
www. wikiznanie ru/ru «Кипение»
Физический энциклопедический словарь. М. Советская энциклопедия,1968г.
А. С. Енохович Справочник по физике. М.Просвещение,1978г.
www. wikiznanie ru/ru «Кипение»