- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему 10 фактов о воде. Много информации о воде
Содержание
- 1. 10 фактов о воде. Много информации о воде
- 2. Определение.Вода́ (оксид водорода) — химическое вещество в
- 3. Общая информация.Является хорошим сильнополярным растворителем. В природных
- 4. Виды воды.По особенностям происхождения, состава или применения,
- 5. Химические названия воды.С формальной точки зрения вода
- 6. Физические свойства.Вода обладает рядом необычных особенностей:При таянии
- 7. Физические свойства.Все эти особенности связаны с наличием
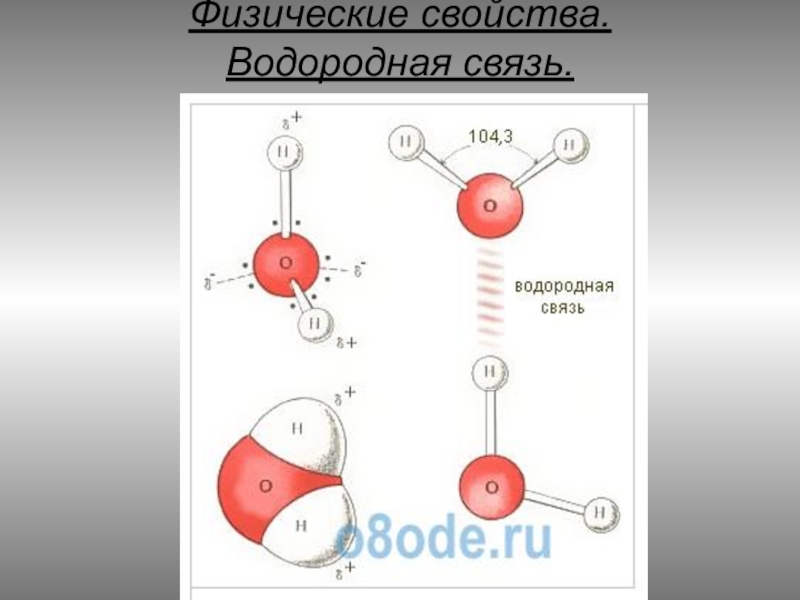
- 8. Физические свойства. Водородная связь.
- 9. Физические свойства.Вода имеет показатель преломления n=1,33 в
- 10. Агрегатные состояния.По состоянию различают:Твёрдое — лёдЖидкое — водаГазообразное — водяной пар.
- 11. Агрегатные состояния.При нормальном атмосферном давлении (760 мм
- 12. Агрегатные состояния.При росте давления температура кипения воды
- 13. Изотопные модификации воды.И кислород, и водород имеют
- 14. Химические свойства.Вода является наиболее распространённым растворителем на
- 15. Химические свойства.Сама по себе вода относительно инертна
- 16. Вода в природе.В атмосфере нашей планеты вода
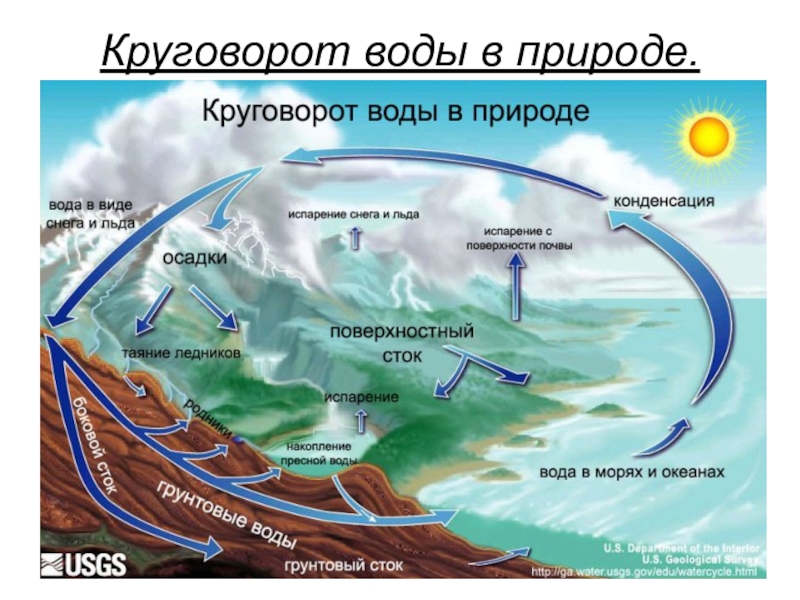
- 17. Круговорот воды в природе.
- 18. Вода за пределами Земли.Одним из наиболее важных
- 19. ГидрологияГидроло́гия — наука, изучающая природные воды, их
- 20. Биологическая роль.Вода играет уникальную роль как вещество,
- 21. Применение.Земледелие;Питьё и приготовление пищи;Растворитель;Теплоноситель;Замедлитель;Пожаротушение;Спорт;Инструмент.
- 22. Вода-разрушительная сила.Вода нередко может приносить с собой не только созидание, но и разрушение.Провокаторы ненастий:половодье.горные ледники.землетрясения.Последствия:наводнения;цунами;
- 23. Интересные фактыВ среднем в организме растений и
- 24. Интересные фактыПри определённых условиях (внутри нанотрубок) молекулы
- 25. Источники информации.http://ru.wikipedia.org/wiki/H2Ohttp://belrodnik.by/voda_0011.htmlhttp://www.seapeace.ru/oceanology/water/12.html
Определение.Вода́ (оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях). Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном —
Слайд 2Определение.
Вода́ (оксид водорода) — химическое вещество в виде прозрачной жидкости, не
имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях).
Химическая формула: Н2O.
В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром.
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).
Химическая формула: Н2O.
В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром.
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).
Слайд 3Общая информация.
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые
вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Слайд 4Виды воды.
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Мягкая
вода и жёсткая вода — по содержанию катионов кальция и магния
По изотопам молекулы:
Лёгкая вода (обычная)
Тяжёлая вода (дейтериевая)
Сверхтяжёлая вода (тритиевая)
По изотопам молекулы:
Лёгкая вода (обычная)
Тяжёлая вода (дейтериевая)
Сверхтяжёлая вода (тритиевая)
Слайд 5Химические названия воды.
С формальной точки зрения вода имеет несколько различных корректных
химических названий:
Оксид водорода
Гидроксид водорода
Монооксид дигидрогена
Гидроксильная кислота
англ. hydroxic acid
Оксидан (англ. oxidane)
Дигидромонооксид
Оксид водорода
Гидроксид водорода
Монооксид дигидрогена
Гидроксильная кислота
англ. hydroxic acid
Оксидан (англ. oxidane)
Дигидромонооксид
Слайд 6Физические свойства.
Вода обладает рядом необычных особенностей:
При таянии льда его плотность увеличивается
(с 0,9 до 1 г/см³). Почти у всех остальных веществ при плавлении плотность уменьшается.
При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Соответственно, при остывании - плотность падает. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
При нагревании от 0 °C до 4 °C (точнее, 3,98 °C) вода сжимается. Соответственно, при остывании - плотность падает. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4 °C, более холодная вода как менее плотная остаётся на поверхности и замерзает, а подо льдом сохраняется положительная температура.
Слайд 7Физические свойства.
Все эти особенности связаны с наличием водородных связей. Из-за большой
разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
Слайд 9Физические свойства.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она
сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
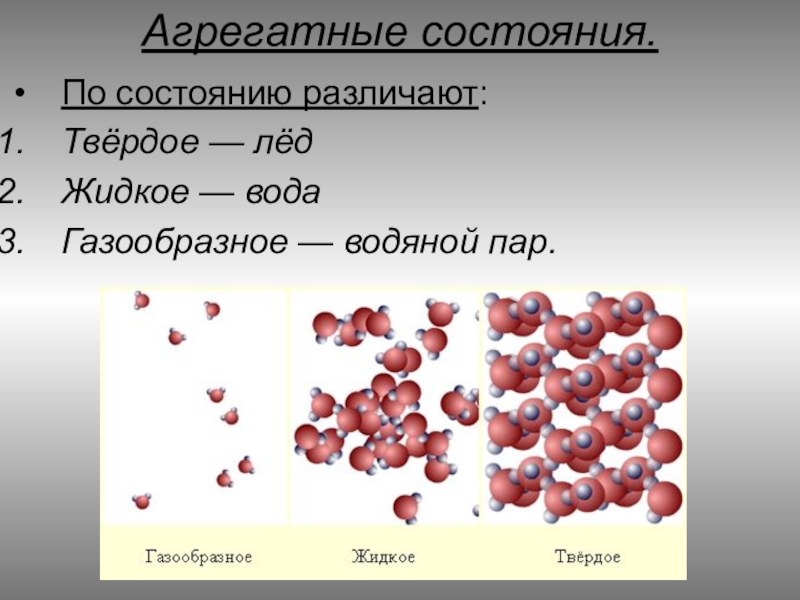
Слайд 10Агрегатные состояния.
По состоянию различают:
Твёрдое — лёд
Жидкое — вода
Газообразное — водяной пар.
Слайд 11Агрегатные состояния.
При нормальном атмосферном давлении (760 мм рт. ст., 101 325
Па) вода тает (плавится) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния и кипения воды при создании температурной шкалы "по Цельсию"). При снижении давления температура таяния (плавления) воды медленно растёт, а температура кипения — падает.
Слайд 12Агрегатные состояния.
При росте давления температура кипения воды растёт, плотность водяного пара
в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Слайд 13Изотопные модификации воды.
И кислород, и водород имеют природные и искусственные изотопы.
В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды:
Лёгкая вода (просто вода).
Тяжёлая вода (дейтериевая).
Сверхтяжёлая вода (тритиевая).
Известно, что тяжёлая вода не поддерживает жизни, то есть, большинство живых организмов (за исключением некоторых микроорганизмов и грибов) в такой воде умирает.
Лёгкая вода (просто вода).
Тяжёлая вода (дейтериевая).
Сверхтяжёлая вода (тритиевая).
Известно, что тяжёлая вода не поддерживает жизни, то есть, большинство живых организмов (за исключением некоторых микроорганизмов и грибов) в такой воде умирает.
Слайд 14Химические свойства.
Вода является наиболее распространённым растворителем на планете Земля, во многом
определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония)
Слайд 15Химические свойства.
Сама по себе вода относительно инертна в обычных условиях, но
её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Слайд 16Вода в природе.
В атмосфере нашей планеты вода находится в виде капель
малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса).
В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая-криосферой.
Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая-криосферой.
Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Слайд 18Вода за пределами Земли.
Одним из наиболее важных вопросов, связанных с освоением
космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда.
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет.
Были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объемах.
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет.
Были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объемах.
Слайд 19Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и
литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Слайд 20Биологическая роль.
Вода играет уникальную роль как вещество, определяющее возможность существования и
саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
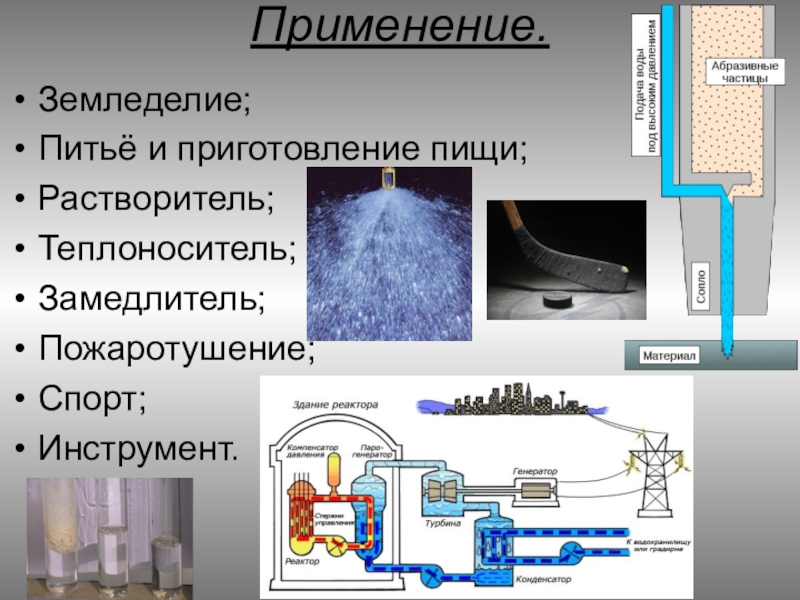
Слайд 21Применение.
Земледелие;
Питьё и приготовление пищи;
Растворитель;
Теплоноситель;
Замедлитель;
Пожаротушение;
Спорт;
Инструмент.
Слайд 22Вода-разрушительная сила.
Вода нередко может приносить с собой не только созидание, но
и разрушение.
Провокаторы ненастий:
половодье.
горные ледники.
землетрясения.
Последствия:
наводнения;
цунами;
Провокаторы ненастий:
половодье.
горные ледники.
землетрясения.
Последствия:
наводнения;
цунами;
Слайд 23Интересные факты
В среднем в организме растений и животных содержится более 50
% воды.
В составе мантии Земли воды содержится в 10-12 раз больше, чем количество воды в Мировом океане.
При средней глубине в 4 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю, и её толщина была бы 3 км.
Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой.
Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C.
Иногда вода замерзает при положительной температуре.
В составе мантии Земли воды содержится в 10-12 раз больше, чем количество воды в Мировом океане.
При средней глубине в 4 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.
Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю, и её толщина была бы 3 км.
Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой.
Морская вода при обычной её солёности 35 ‰ замерзает при температуре −1,91 °C.
Иногда вода замерзает при положительной температуре.
Слайд 24Интересные факты
При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние,
при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю.
Среди существующих в природе жидкостей поверхностное натяжение воды уступает только ртути.
Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде.
С помощью капель воды из кранов можно накопить заряд 10 киловольт, опыт называется «Капельница Кельвина».
Вода — это одно из немногих веществ на Земле, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают висмут, галлий, свинец и некоторые соединения и смеси).
Вода может гореть, если ее поместить в атмосферу с фтором, иногда даже со взрывом.
Среди существующих в природе жидкостей поверхностное натяжение воды уступает только ртути.
Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде.
С помощью капель воды из кранов можно накопить заряд 10 киловольт, опыт называется «Капельница Кельвина».
Вода — это одно из немногих веществ на Земле, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают висмут, галлий, свинец и некоторые соединения и смеси).
Вода может гореть, если ее поместить в атмосферу с фтором, иногда даже со взрывом.