веществ в различных физических состояниях
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Взаимодействия между частицами веществ в различных физических состояниях
Содержание
- 1. Взаимодействия между частицами веществ в различных физических состояниях
- 2. Учебные цели занятия В результате проведенного лекционного занятия
- 3. План лекцииВведениеУчебные вопросы 2.1.Химическая связь. Определение и характеристики
- 4. ВведениеВ предыдущей главе было рассмотрено электронное строение
- 5. 2.1. Химическая связь. Определение и
- 6. 2.1.1.
- 7. Различают обменный и донорно-акцепторный механизм образования ковалентной
- 8. Если электронная плотность расположена симметрично между атомами,
- 9. Пространственное строение молекулКовалентная связь направленная, т.е. молекулы
- 10. Слайд 10
- 11. Гибридизация орбиталей Гибридизация орбиталей -
- 12. 2.1.2. Ионная связьИоны - это заряженные частицы,
- 13. 2.1.3. Водородная связь Водородная связь –
- 14. 2.1.4. Металлическая связь Валентные электроны металлов
- 15. 2.2. Физические состояния веществ В зависимости
- 16. 2.3. Химические системы Системой называется совокупность
- 17. 2.4. Комплиментарность Комплиментарность — в общем
- 18. ЗаключениеНа основании, рассмотренного в лекции, материала установлено,
- 19. Задание на самостоятельную работу Изучить материал лекции по
Учебные цели занятия В результате проведенного лекционного занятия курсант должен:иметь представление:- о фундаментальном единстве естественных наук, незавершенности естествознания и возможности его дальнейшего развития;-о новейших открытиях естествознания, перспективах их использования,знать:- основные понятия, современные теории, законы,уметь:использовать основные понятия, законы
Слайд 2Учебные цели занятия
В результате проведенного лекционного занятия курсант должен:
иметь представление:
- о
фундаментальном единстве естественных наук, незавершенности естествознания и возможности его дальнейшего развития;
-о новейших открытиях естествознания, перспективах их использования,
знать:
- основные понятия, современные теории, законы,
уметь:
использовать основные понятия, законы для решения задач.
Воспитательные цели
На занятии необходимо формировать и развивать у курсантов:
- любовь к Отечеству, гордость и ответственность за принадлежность к Вооруженным Силам Российской Федерации и их офицерскому корпусу;
- офицерскую честь и достоинство, дисциплинированность;
-общую культуру, стремление к самосовершенствованию.
-о новейших открытиях естествознания, перспективах их использования,
знать:
- основные понятия, современные теории, законы,
уметь:
использовать основные понятия, законы для решения задач.
Воспитательные цели
На занятии необходимо формировать и развивать у курсантов:
- любовь к Отечеству, гордость и ответственность за принадлежность к Вооруженным Силам Российской Федерации и их офицерскому корпусу;
- офицерскую честь и достоинство, дисциплинированность;
-общую культуру, стремление к самосовершенствованию.
Слайд 3План лекции
Введение
Учебные вопросы
2.1.Химическая связь. Определение и характеристики химической связи
2.1.1. Ковалентная
связь
2.1.2. Ионная связь
2.1.3. Водородная связь
2.1.4. Металлическая связь
2.2. Физические состояния веществ
2.3. Химические системы
2.4. Комплиментарность
Заключение
2.1.2. Ионная связь
2.1.3. Водородная связь
2.1.4. Металлическая связь
2.2. Физические состояния веществ
2.3. Химические системы
2.4. Комплиментарность
Заключение
Слайд 4Введение
В предыдущей главе было рассмотрено электронное строение атомов и периодическая система
элементов Д.И. Менделеева.
Следующим шагом в понимании строения вещества служит выявление взаимодействия между атомами. В данной главе мы выясним такое понятие как химическая связь.
Следующим шагом в понимании строения вещества служит выявление взаимодействия между атомами. В данной главе мы выясним такое понятие как химическая связь.
Слайд 5
2.1. Химическая связь. Определение и характеристики химической связи
Химическая связь - это
взаимодействие двух атомов, осуществляемое путем обмена электронами.
Различают следующие виды химической связи: ковалентная, ионная, металлическая.
Энергия связи – количество энергии, выделяемой при образовании химической связи (Есв).
Длина связи – расстояние между ядрами в соединении (lсв).
Направленность связи – характеризуется углом между воображаемыми линиями, проходящими через ядра химически связанных атомов.
Различают следующие виды химической связи: ковалентная, ионная, металлическая.
Энергия связи – количество энергии, выделяемой при образовании химической связи (Есв).
Длина связи – расстояние между ядрами в соединении (lсв).
Направленность связи – характеризуется углом между воображаемыми линиями, проходящими через ядра химически связанных атомов.
Слайд 6
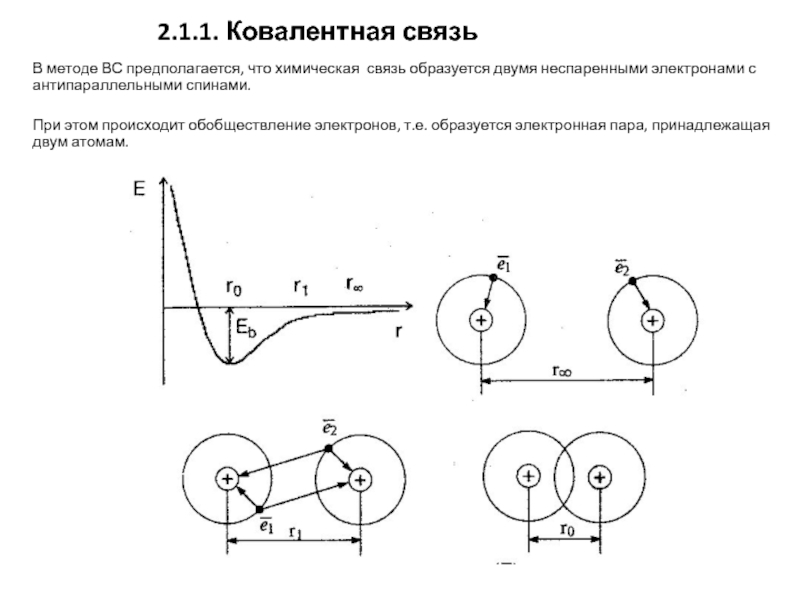
2.1.1. Ковалентная связь
В методе ВС предполагается, что химическая связь образуется двумя
неспаренными электронами с антипараллельными спинами.
При этом происходит обобществление электронов, т.е. образуется электронная пара, принадлежащая двум атомам.
При этом происходит обобществление электронов, т.е. образуется электронная пара, принадлежащая двум атомам.
Слайд 7Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
Обменный механизм. Каждый атом
дает по одному неспаренному электрону в общую электронную пару.
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Слайд 8Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной.
Если
электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Слайд 9Пространственное строение молекул
Ковалентная связь направленная, т.е. молекулы имеют строго определенное геометрическое
строение.
По симметрии возможны разные типы перекрывания:
– связь, здесь область перекрывания находится на линии, соединяющей ядра атомов
–связь, здесь двукратное перекрывание электронных атомов по обе стороны от линии, соединяющей центры атомов
По симметрии возможны разные типы перекрывания:
– связь, здесь область перекрывания находится на линии, соединяющей ядра атомов
–связь, здесь двукратное перекрывание электронных атомов по обе стороны от линии, соединяющей центры атомов
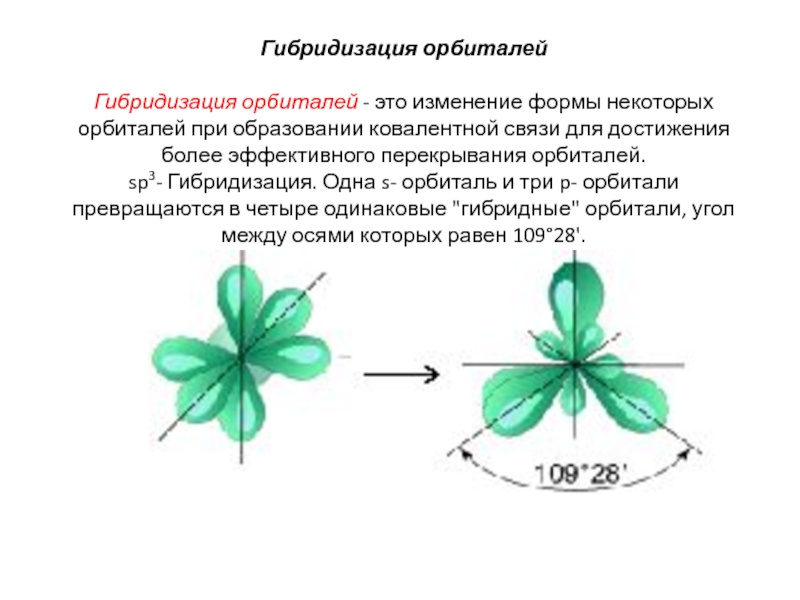
Слайд 11 Гибридизация орбиталей Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании
ковалентной связи для достижения более эффективного перекрывания орбиталей.
sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 10928'.
Слайд 122.1.2. Ионная связь
Ионы - это заряженные частицы, в которые превращаются атомы
в результате отдачи или присоединения электронов.
Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью.
Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью.
Слайд 13
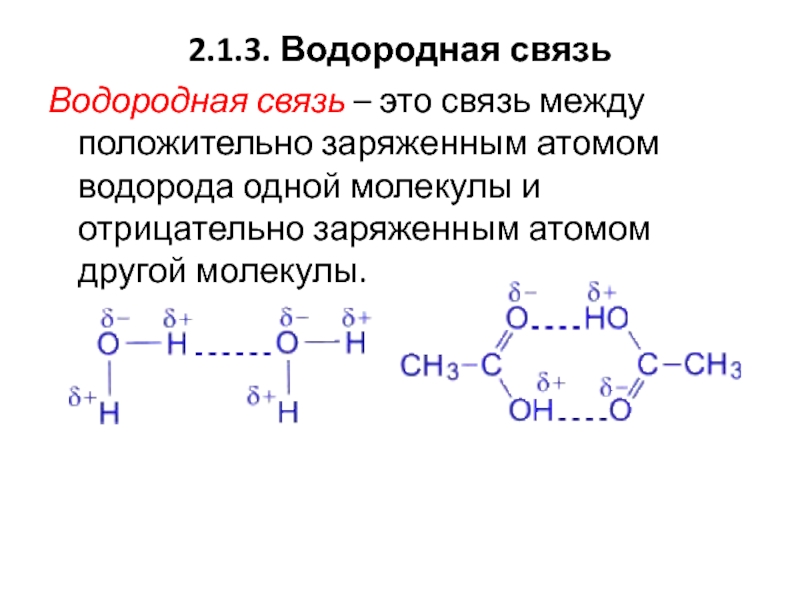
2.1.3. Водородная связь
Водородная связь – это связь между положительно заряженным атомом
водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Слайд 14
2.1.4. Металлическая связь
Валентные электроны металлов достаточно слабо связаны со своими ядрами
и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу.
Электроны в металле осуществляют связь между всеми атомами металла.
Электроны в металле осуществляют связь между всеми атомами металла.
Слайд 15
2.2. Физические состояния веществ
В зависимости от условий окружающей среды и в
первую очередь от температуры и давления химические вещества могут находиться в различных агрегатных состояниях.
Эти агрегатные состояния отличаются друг от друга величиной и природой сил, действующих между частицами, а также характером движения самих частиц.
Различают твердое, жидкое, газообразное и плазменное состояние веществ.
Эти агрегатные состояния отличаются друг от друга величиной и природой сил, действующих между частицами, а также характером движения самих частиц.
Различают твердое, жидкое, газообразное и плазменное состояние веществ.
Слайд 16
2.3. Химические системы
Системой называется совокупность находящихся во взаимодействии веществ или частиц,
мысленно или фактически обособленная от окружающей среды. Все что находится вне системы, называется внешней средой.
Различают гомогенные и гетерогенные системы.
Гомогенные системы состоят из одной фазы, гетерогенные системы – из двух или более фаз.
Фаза – это часть системы, однородная во всех ее точках по химическому составу и свойствам, и отделенная от других фаз системы поверхностью раздела.
Если в состав системы входят вещества или частицы, способные к химическому взаимодействию, то эти системы являются химическими системами. Химическая система характеризуется определенными параметрами и существует при определенных условиях.
К параметрам системы относятся температура, давление, объем, масса и концентрация.
Различают гомогенные и гетерогенные системы.
Гомогенные системы состоят из одной фазы, гетерогенные системы – из двух или более фаз.
Фаза – это часть системы, однородная во всех ее точках по химическому составу и свойствам, и отделенная от других фаз системы поверхностью раздела.
Если в состав системы входят вещества или частицы, способные к химическому взаимодействию, то эти системы являются химическими системами. Химическая система характеризуется определенными параметрами и существует при определенных условиях.
К параметрам системы относятся температура, давление, объем, масса и концентрация.
Слайд 17
2.4. Комплиментарность
Комплиментарность — в общем смысле отношение соответствия каких-либо объектов чему-либо.
( Комплиментарность в литературе — соответствие литературных произведений одной теме.)
Комплиментарность в химии, пространственное соответствие структур двух молекул (разных или одинаковых), благодаря которому возможно образование между ними водородных связей и осуществление межмолекулярных взаимодействий.
Комплиментарность (биохимия) - взаимное соответствие в химическом строении двух макромолекул, обеспечивающее их взаимодействие – спаривание двух нитей ДНК, соединение фермента с субстрактом, антигена с антителом.
Комплиментарные структуры подходят друг к другу как ключ к замку, рука к перчатке.
Слайд 18Заключение
На основании, рассмотренного в лекции, материала установлено, что следующим шагом в
понимании строения вещества служит выявление взаимодействия между атомами.
Установлено важное понятие химии – химическая связь.
Установлено важное понятие химии – химическая связь.
Слайд 19Задание на самостоятельную работу
Изучить материал лекции по конспекту и литературе:
1.
Коровин Н.В. Общая химия: Учеб. для технических направлений и специальностей вузов - 2 изд., – М.: Высшая школа, 2000. (с. 35…38, с. 68…71, с. 82…106).
2. Кривко В.М. Химия. Курс лекций. Учебное пособие.– Ейск: филиал ВВА им. Ю.А.Гагарина, 2001.(с. 16…33).
Дополнительная литература
1. Глинка Н.Л. Общая химия. Учебное пособие для вузов. – Л.: Химия, 1979. (с. 115…164).
2. Кривко В.М. Химия. Курс лекций. Учебное пособие.– Ейск: филиал ВВА им. Ю.А.Гагарина, 2001.(с. 16…33).
Дополнительная литература
1. Глинка Н.Л. Общая химия. Учебное пособие для вузов. – Л.: Химия, 1979. (с. 115…164).