- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Удивительные металлы: Галлий, Цезий
Содержание
- 1. Презентация Удивительные металлы: Галлий, Цезий
- 2. ГАЛЛИЙ
- 3. Слайд 3
- 4. Галлий - мягкий металл серебристо-белого цвета.
- 5. Слайд 5
- 6. Существование Галлия ("экаалюминия") и основные его свойства
- 7. В периодической системе Д.И.Менделеева галлий занимает 31-е
- 8. Первые 50 килограммов галлия получили в Германии
- 9. Главным источником получения галлия служат... отходы алюминиевого
- 10. Благодаря низкой температуре плавления галлий используют во
- 11. Солнечные батареи на основе арсенида галлия (предназначены
- 12. В сплавах с никелем и кобальтом галлий
- 13. В медицине широко применяют лампы ультрафиолетового излучения,
- 14. Сплав алюминия с Галлием предложен вместо ртути
- 15. Баксанская нейтринная обсерватория. Расположена глубоко под горой.На
- 16. Расплавленный галлий начинает кипеть лишь после того,
- 17. ЦЕЗИЙ
- 18. Це́зий (от латинского Caesium, обозначается символом Cs) — элемент главной подгруппы первой группы
- 19. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой).
- 20. Цезий — мягкий металл, из-за низкой температуры плавления
- 21. Расплав представляет подвижную жидкость, при этом его цвет становится более
- 22. Слайд 22
- 23. Цезий был открыт в 1860 году немецкими
- 24. Густав Роберт Кирхгоф 12 марта 1824, один из великих физиков XIX века.Роберт Вильгельм Бу́нзен 31 марта 1811 года, Гёттинген немецкий химик-экспериментатор.
- 25. Дюрхгеймский источник
- 26. Реакция цезия с водой.
- 27. Природный цезий — мононуклидный элемент, состоящий из единственного
- 28. Поллуцит – минерал цезия.
- 29. Цезий нашёл применение только в начале XX
- 30. В основном применяется стабильный природный цезий-133, и
- 31. Цезий — самый мягкий металл при комнатной температуре. Также,
- 32. Атомные часы.
ГАЛЛИЙ
Слайд 4Галлий - мягкий металл серебристо-белого цвета. Он очень токсичен (токсичнее ртути)
- и общение с ним может привести к не очень приятным последствиям.
Слайд 6Существование Галлия ("экаалюминия") и основные его свойства были предсказаны в 1870
году Д. И. Менделеевым.
Элемент был открыт спектральным анализом и выделен в 1875 году французским химиком П. Э. Лекоком де Буабодраном; назван в честь Франции (лат. Gallia).
Элемент был открыт спектральным анализом и выделен в 1875 году французским химиком П. Э. Лекоком де Буабодраном; назван в честь Франции (лат. Gallia).
Цинковая обманка, из которой был получен галлий.
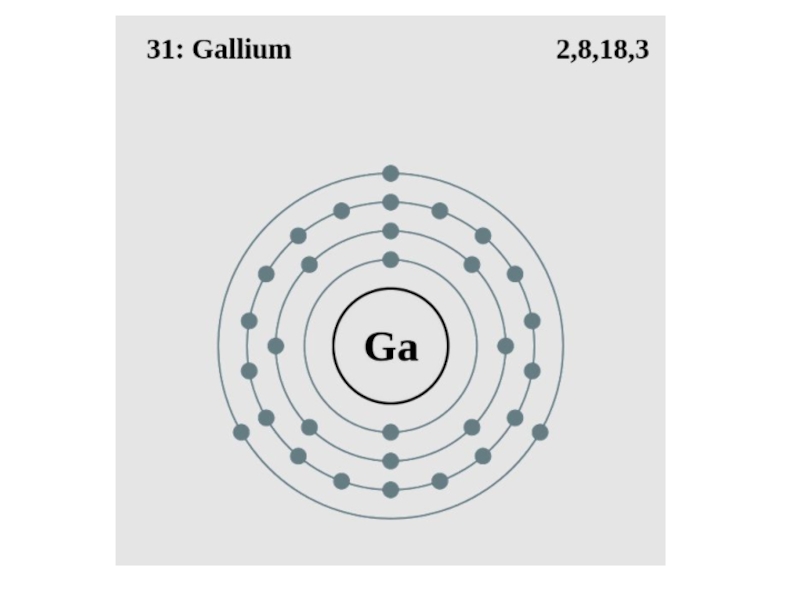
Слайд 7В периодической системе Д.И.Менделеева галлий занимает 31-е место. Обозначается символом Ga
(лат. Gallium).
В отличие от привычных металлов, галлий плавится при температуре всего 29,8 °C.
Если взять его в руку, он растает.
Слайд 8
Первые 50 килограммов галлия получили в Германии в 1932 году.
Спустя
примерно четверть века производство галлия возросло лишь до 350 килограммов.
Слайд 9Главным источником получения галлия служат... отходы алюминиевого производства.
Процесс извлечения галлия
один из самых дорогих металлов на мировом рынке.
В середине 50-х годов 1 килограмм галлия стоил 3000 долларов - почти в три раза дороже золота!
В середине 50-х годов 1 килограмм галлия стоил 3000 долларов - почти в три раза дороже золота!
П. Э. Лекок де Буабодран
Слайд 10Благодаря низкой температуре плавления галлий используют во многих легкоплавких сплавах. Создан,
например, сплав галлия (67%) с индием (20,5%) и оловом (12,5%.), который даже при комнатной температуре не может остаться твердым: он плавится при 10,6°С.
Такие сплавы широко используют в технике, в частности в устройствах пожарной сигнализации. Стоит воздуху в помещении слегка нагреться, как столбик галлиевого сплава, вмонтированный в реле, начинает таять - жидкий металл замыкает электрические контакты и звуковой или световой сигнал возвещает об опасности. Такой прибор надежнее любого вахтера.
Такие сплавы широко используют в технике, в частности в устройствах пожарной сигнализации. Стоит воздуху в помещении слегка нагреться, как столбик галлиевого сплава, вмонтированный в реле, начинает таять - жидкий металл замыкает электрические контакты и звуковой или световой сигнал возвещает об опасности. Такой прибор надежнее любого вахтера.
Слайд 11Солнечные батареи на основе арсенида галлия (предназначены для спутника MidSTAR-1)
Ультрафиолетовый светодиод
на основе нитрида индия и галлия InxGa1-xN
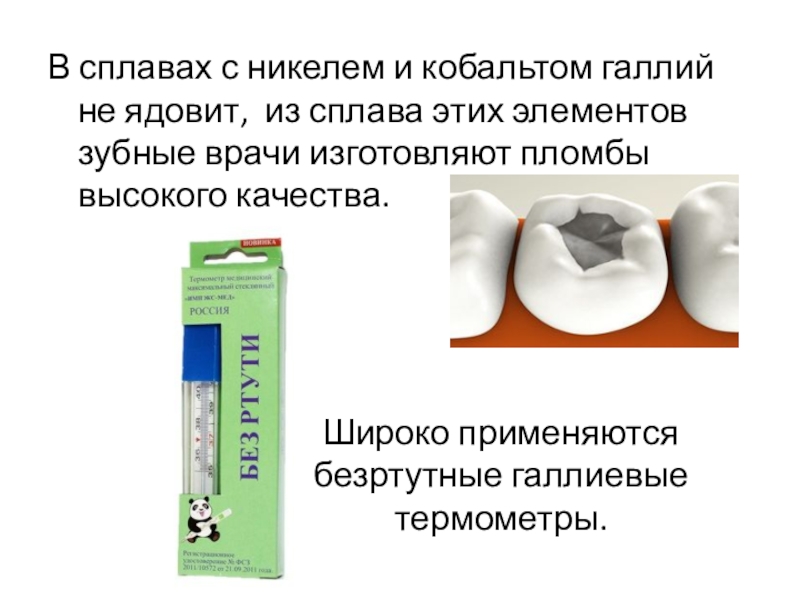
Слайд 12В сплавах с никелем и кобальтом галлий не ядовит, из сплава
этих элементов зубные врачи изготовляют пломбы высокого качества.
Широко применяются безртутные галлиевые термометры.
Слайд 13В медицине широко применяют лампы ультрафиолетового излучения, катоды которых раньше обычно
делали из ртути. Сплав алюминия с галлием лучше ртути справляется с этой работой: излучаемый лампами свет богаче целебными лучами.
Слайд 14Сплав алюминия с Галлием предложен вместо ртути в качестве катода ламп
ультрафиолетового излучения, применяемых в медицине.
Жидкий Галлий и его сплавы предложено использовать для изготовления высокотемпературных термометров (600-1300°С) и манометров.
Жидкий Галлий и его сплавы предложено использовать для изготовления высокотемпературных термометров (600-1300°С) и манометров.
Слайд 15Баксанская нейтринная обсерватория.
Расположена глубоко под горой.
На нижней фотографии показан галлий-германиевый
нейтринный телескоп. Внутри емкостей 60 тонн металлического галлия. При поглощении нейтрино атом галлия-71 переходит в германий, однако, нейтрино взаимодействует с веществом очень слабо: каждый месяц удается зарегистрировать всего 30 таких превращений. Благодаря этому мы получаем информацию о процессах, которые протекают глубоко в недрах Солнца.
Слайд 16Расплавленный галлий начинает кипеть лишь после того, как температура достигнет 2230°С.
Именно
эта удивительная способность галлия предопределила его важнейшее применение в технике - изготовление высокотемпературных термометров и манометров.
Галлиевые термометры позволяют измерять температуру более 1000°С, при которой ртутным термометрам нечего делать: ведь ртуть закипает уже при 357°С.
Галлиевые термометры позволяют измерять температуру более 1000°С, при которой ртутным термометрам нечего делать: ведь ртуть закипает уже при 357°С.
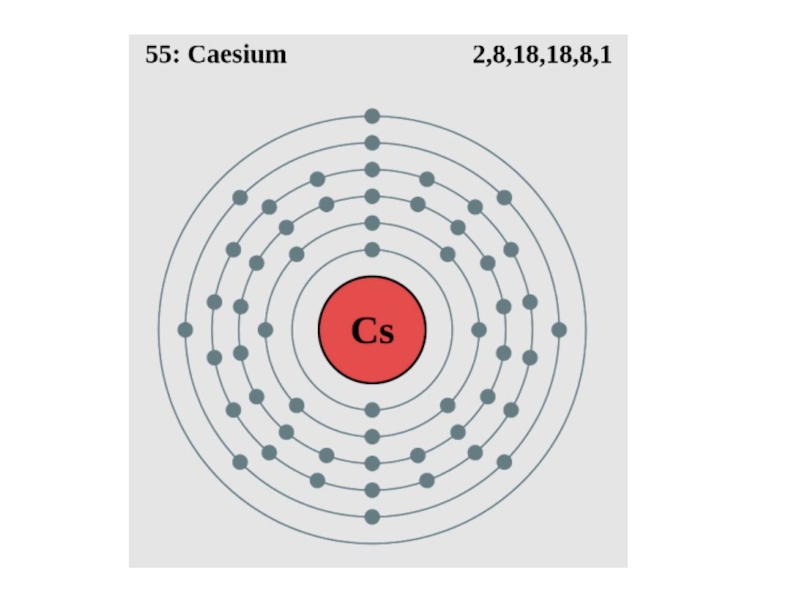
Слайд 18Це́зий (от латинского Caesium, обозначается символом Cs) — элемент главной подгруппы
первой группы шестого периода системы химических элементов
Д. И. Менделеева, атомный номер 55.
Простое вещество цезий — мягкий щелочной металл серебристо-жёлтого цвета.
Простое вещество цезий — мягкий щелочной металл серебристо-жёлтого цвета.
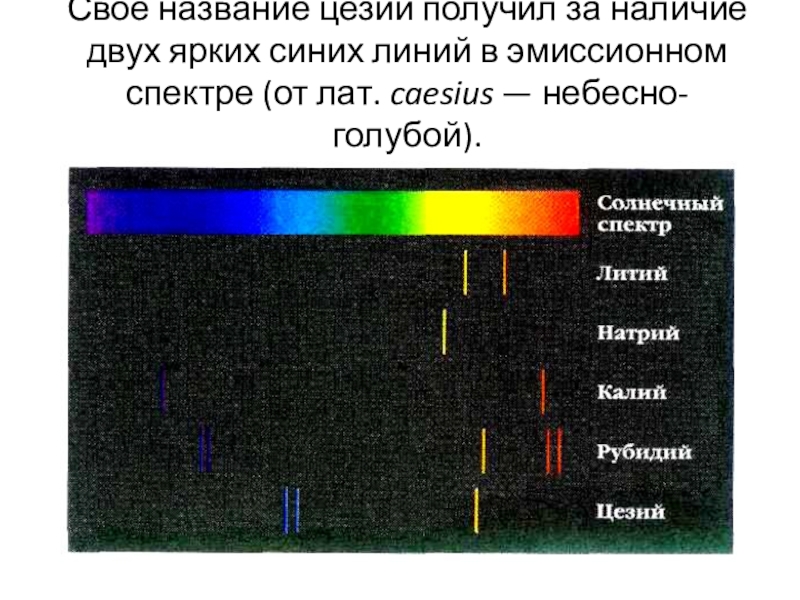
Слайд 19Своё название цезий получил за наличие двух ярких синих линий в эмиссионном
спектре (от лат. caesius — небесно-голубой).
Слайд 20Цезий — мягкий металл, из-за низкой температуры плавления (Tпл=28,6 °C) при комнатной температуре
находится в полужидком состоянии.
Металлический цезий представляет собой вещество золотисто-белого цвета, по внешнему виду похожее на золото, но светлее.
Металлический цезий представляет собой вещество золотисто-белого цвета, по внешнему виду похожее на золото, но светлее.
Слайд 21Расплав представляет подвижную жидкость, при этом его цвет становится более серебристым. Жидкий цезий хорошо
отражает свет.
Пары цезия окрашены в зеленовато-синий цвет.
Кристаллизуется цезий в объёмноцентрированную кубическую решётку (тип α-железа). Цезий — парамагнетик.
Пары цезия окрашены в зеленовато-синий цвет.
Кристаллизуется цезий в объёмноцентрированную кубическую решётку (тип α-железа). Цезий — парамагнетик.
Слайд 23Цезий был открыт в 1860 году немецкими учёными Р.В. Бунзеном и
Г.Р. Кирхгофом.
В лабораторию Бунзена прислали минеральную воду из Дюрхгеймского источника.
Врачи, приславшие воду, просили проанализировать состав, чтобы узнать, чем обусловлены ее лечебные свойства.
Бунзен подверг воду спектральному анализу и неожиданно обнаружил две голубые линии, которые не соответствовали ни одному известному тогда элементу.
Так впервые благодаря методу спектрального анализа был открыт новый элемент, который назвали цезием - от латинского "небесно-голубой". В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
В лабораторию Бунзена прислали минеральную воду из Дюрхгеймского источника.
Врачи, приславшие воду, просили проанализировать состав, чтобы узнать, чем обусловлены ее лечебные свойства.
Бунзен подверг воду спектральному анализу и неожиданно обнаружил две голубые линии, которые не соответствовали ни одному известному тогда элементу.
Так впервые благодаря методу спектрального анализа был открыт новый элемент, который назвали цезием - от латинского "небесно-голубой". В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
Слайд 24Густав Роберт Кирхгоф
12 марта 1824, один из великих физиков XIX века.
Роберт Вильгельм Бу́нзен 31 марта
1811 года, Гёттинген немецкий химик-экспериментатор.
Слайд 27Природный цезий — мононуклидный элемент, состоящий из единственного стабильного нуклида 133Cs. На сегодняшний
день известно 39 искусственных радиоактивных изотопов цезия.
Самым долгоживущим искусственным радиоактивным нуклидом цезия является 135Cs с периодом полураспада T1/2 около 2,3 миллиона лет.
Другой относительно долгоживущий изотоп 137Cs (T1/2=30,17 года). Оба эти долгоживущих радионуклида являются продуктами ядерного распада. Цезий-137 является одним из виновников радиоактивного загрязнения биосферы, так как образуется при делении ядер.
Самым долгоживущим искусственным радиоактивным нуклидом цезия является 135Cs с периодом полураспада T1/2 около 2,3 миллиона лет.
Другой относительно долгоживущий изотоп 137Cs (T1/2=30,17 года). Оба эти долгоживущих радионуклида являются продуктами ядерного распада. Цезий-137 является одним из виновников радиоактивного загрязнения биосферы, так как образуется при делении ядер.
Слайд 29Цезий нашёл применение только в начале XX века, когда были обнаружены
его минералы и разработана технология получения в чистом виде.
В настоящее время цезий и его соединения используются в электронике, радио-, электро- рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике.
В настоящее время цезий и его соединения используются в электронике, радио-, электро- рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике.
Слайд 30В основном применяется стабильный природный цезий-133, и ограниченно — его радиоактивный изотоп
цезий-137, выделяемый из суммы осколков деления урана, плутония, тория в реакторах атомных электростанций.
Слайд 31Цезий — самый мягкий металл при комнатной температуре.
Также, как и галлий, его можно
расплавить в руках (однако, это можно сделать только при условии, что цезий запаян в стеклянную ампулу, иначе происходит его возгорание).