- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по ОБЖ на тему Сероводород
Содержание
- 1. Презентация по ОБЖ на тему Сероводород
- 2. Сероводород (сульфид водорода) - бесцветный газ со
- 3. Химические свойства1)В воде сероводород мало растворим, водный
- 4. Физические свойства Термически
- 5. В природе встречается редко в составе попутных
- 6. Использование
- 7. Отравления сероводородом могут иногда пpoисходить в местах,
- 8. Опасность сероводорода для человекаСероводород – очень токсичный
- 9. Первая помощь и лечение при отравлении сероводородом
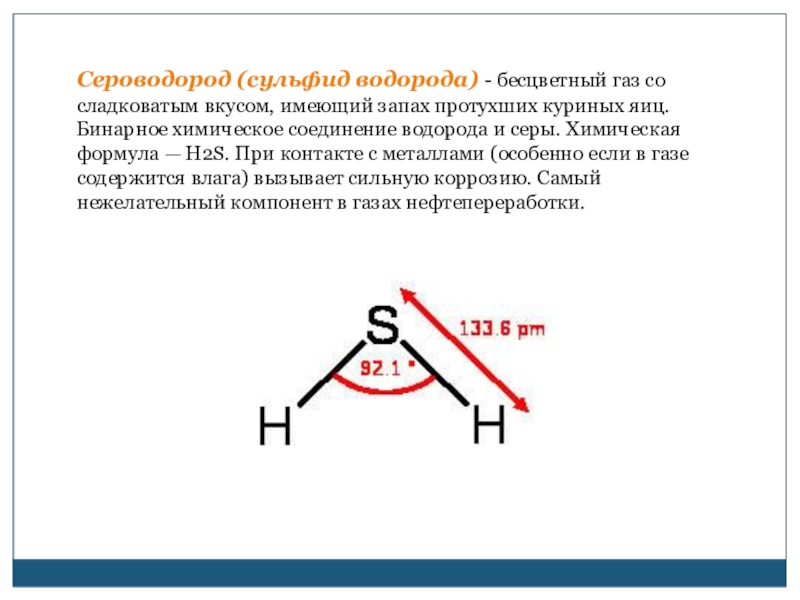
Сероводород (сульфид водорода) - бесцветный газ со сладковатым вкусом, имеющий запах протухших куриных яиц. Бинарное химическое соединение водорода и серы. Химическая формула — H2S. При контакте с металлами (особенно если в газе содержится влага) вызывает сильную
Слайд 2Сероводород (сульфид водорода) - бесцветный газ со сладковатым вкусом, имеющий запах
протухших куриных яиц. Бинарное химическое соединение водорода и серы. Химическая формула — H2S. При контакте с металлами (особенно если в газе содержится влага) вызывает сильную коррозию. Самый нежелательный компонент в газах нефтепереработки.
Слайд 3Химические свойства
1)В воде сероводород мало растворим, водный раствор H2S является очень
слабой кислотой:
2) Реагирует со щелочами:
3) Сероводород — сильный восстановитель. Окислительно-восстановительные потенциалы:
4) В воздухе горит синим пламенем
5) Качественной реакцией на сероводород, сероводородную кислоту и её соли является их взаимодействие с солями свинца, при котором образуется чёрный осадок сульфида свинца, например:
При пропускании сероводорода через человеческую кровь она чернеет, поскольку гемоглобин разрушается, и железо, входящее в его состав, вступает в реакцию с сероводородом и образует чёрный сульфид железа.
2) Реагирует со щелочами:
3) Сероводород — сильный восстановитель. Окислительно-восстановительные потенциалы:
4) В воздухе горит синим пламенем
5) Качественной реакцией на сероводород, сероводородную кислоту и её соли является их взаимодействие с солями свинца, при котором образуется чёрный осадок сульфида свинца, например:
При пропускании сероводорода через человеческую кровь она чернеет, поскольку гемоглобин разрушается, и железо, входящее в его состав, вступает в реакцию с сероводородом и образует чёрный сульфид железа.
Слайд 4Физические свойства
Термически неустойчив (при температурах больше
400 °C разлагается на простые вещества — S и H2). Молекула сероводорода имеет изогнутую форму, поэтому она полярна (μ = 0,34·10−29 Кл·м). В отличие от молекул воды, атомы водорода в молекуле не образуют прочных водородных связей, поэтому сероводород является газом. Раствор сероводорода в воде — очень слабая сероводородная кислота. Является сверхпроводником при температуре 203 К (-70°C) и давлении 100 ГПа.
Слайд 5В природе встречается редко в составе попутных нефтяных газов, природного газа,
вулканических газах, в растворённом виде в природных водах (например, в Чёрном море слои воды, расположенные глубже 150—200 м содержат растворённый сероводород). Образуется при гниении белков (только тех, которые содержат в составе серосодержащие аминокислоты (метионин и/или цистеин)
Нахождение в природе
Слайд 7Отравления сероводородом могут иногда пpoисходить в местах, где происходит гниение: в
отхожих местах, выгребных и помойных ямах, водяных стоках, мочильнях для льна, илистых прудах, на сахарных заводах, при выработке светильного газа и на заводах с доменными печами. (Знаменский сахарный завод, доменные печи используются в Тульском, Судаковском и Липецком заводах).
Слайд 8Опасность сероводорода для человека
Сероводород – очень токсичный газ, действующий непосредственно на
нервную систему. По шкале опасности он отнесён к 3 классу. Особенно опасно его свойство притуплять обонятельный нерв, из-за чего человек просто перестаёт различать окружающие его ядовитые пары, и интоксикация может произойти внезапно. Смертельная концентрация этого газа в воздухе очень мала – всего 0,1%. Такое количество сероводорода может привести человека к летальному исходу за 10 минут. Стоит лишь немного увеличить концентрацию – и смерть наступает мгновенно, после первого же вдоха. Для примера: в канализационной системе концентрация сероводорода иногда достигает 16%.
Наиболее заметные признаки сильного отравления сероводородом: отёк лёгких, судороги, паралич нервов, последующая кома. Если в атмосфере сероводород содержится в меньших количествах (от 0,02%), симптомы не столь фатальны, но очень неприятны: головокружение и головная боль, тошнота и быстрое привыкание к запаху «тухлых яиц».
Люди, работающие или живущие в непосредственной близости от заводов с сероводородными выбросами, испытывают так называемое хроническое отравление H2S. При этом они начинают хуже себя чувствовать, испытывают головные боли, стремительно теряют вес, учащаются случаи обмороков, а во рту появляется привкус металла. Сероводород также отрицательно действует на зрение, поражая слизистую оболочку глаза и вызывая конъюнктивит, светобоязнь.
Наиболее заметные признаки сильного отравления сероводородом: отёк лёгких, судороги, паралич нервов, последующая кома. Если в атмосфере сероводород содержится в меньших количествах (от 0,02%), симптомы не столь фатальны, но очень неприятны: головокружение и головная боль, тошнота и быстрое привыкание к запаху «тухлых яиц».
Люди, работающие или живущие в непосредственной близости от заводов с сероводородными выбросами, испытывают так называемое хроническое отравление H2S. При этом они начинают хуже себя чувствовать, испытывают головные боли, стремительно теряют вес, учащаются случаи обмороков, а во рту появляется привкус металла. Сероводород также отрицательно действует на зрение, поражая слизистую оболочку глаза и вызывая конъюнктивит, светобоязнь.
Слайд 9Первая помощь и лечение при отравлении сероводородом
Вывести пострадавшего на чистый
воздух и освободить от стесняющей дыхание одежды.
Лечение легких отравлений направлено на ликвидацию явлений раздражения слизистых оболочек — промывание глаз чистой водой, закапывание прокипяченного и остуженного вазелинового масла, а также холодные примочки. При боли и рези в глазах закапывают 0,5% раствор дикаина или новокаина с добавлением адреналина гидрохлорида (1 : 1000), надевают темные очки.
При раздражении носоглотки и верхних дыхательных путей ре комендуют полоскание горла содовой водой, ингаляции аэрозоля раствора новокаина или масляные, внутрь дают кодеин. В случае нарушения дыхания показана длительная ингаляция кислорода. При бронхопневмонии применяют антибиотики и сульфаниламидные пре параты, по показаниям — сердечные средства. Двигательное возбуж дение снимают бромидами.
Лечение легких отравлений направлено на ликвидацию явлений раздражения слизистых оболочек — промывание глаз чистой водой, закапывание прокипяченного и остуженного вазелинового масла, а также холодные примочки. При боли и рези в глазах закапывают 0,5% раствор дикаина или новокаина с добавлением адреналина гидрохлорида (1 : 1000), надевают темные очки.
При раздражении носоглотки и верхних дыхательных путей ре комендуют полоскание горла содовой водой, ингаляции аэрозоля раствора новокаина или масляные, внутрь дают кодеин. В случае нарушения дыхания показана длительная ингаляция кислорода. При бронхопневмонии применяют антибиотики и сульфаниламидные пре параты, по показаниям — сердечные средства. Двигательное возбуж дение снимают бромидами.