- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к работе Химический источник электрического тока (7-9 класс)
Содержание
- 1. Презентация к работе Химический источник электрического тока (7-9 класс)
- 2. Актуальность темыВ технике и быту постоянно растет
- 3. Принцип работы Растворы солей, кислот, щелочей в
- 4. В 1786 итальянский профессор медицины, физиолог Луиджи
- 5. Гальванические элементы сегодня - батарейки. Широко распространены
- 6. Ряд напряжений металлов – необходим в нашем
- 7. Изготовление гальванического элементаПервоначально мы собрали такую батареюЗдесь
Слайд 1Муниципальное бюджетное учреждение дополнительного образования Первомайского района города Ростова-на-Дону «Дом детского
Тема: «Химический источник электрического тока»
Бобыльченко Валерий Юрьевич
Педагог дополнительного образования
МБУ ДО ДДТ Первомайского р-на
2019 г.
Слайд 2Актуальность темы
В технике и быту постоянно растет число таких приборов и
Цель
Изготовить простейший гальванический элемент
Задачи
- Ознакомление с историей создания первых гальванических элементов.
- Изучить устройство и принцип действия гальванических элементов.
- Гальванические элементы сегодня.
- Самостоятельно изготовить рабочий гальванический элемент с подключением нагрузки.
Слайд 3Принцип работы
Растворы солей, кислот, щелочей в воде или другом растворителе называются электролитами.
Поместим в ёмкость с электролитом медную и цинковую пластинку. На первой образовались пузырьки газа, вторая начинала растворяться. Принцип работы заключается в том, что два вида металла в электролитической среде вступают во взаимодействие, в результате которого по внешней цепи начинает проходить ток.
Характер электродных процессов в гальваническом элементе определяется значениями электродных потенциалов. Окисление протекает на поверхности металлического проводника электрода, содержащего наиболее сильный восстановитель, т.е. анодом является электрод с меньшим значением электродного потенциала; электрод с большим значением электродного потенциалаявляется катодом.Соответственно относительным величинам электродных потенциалов анод в гальванических элементах маркируется знаком“”, катод – знаком“+”.
Гальванический элемент — это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Таким образом, в гальванических элементах химическая энергия переходит в электрическую.
Слайд 4В 1786 итальянский профессор медицины, физиолог Луиджи Алоизио Гальвани обнаружил: мышцы
В 1800 году придет к однозначному выводу о том, что: «проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления».
Им был изобретён «элемент Вольта» — первый гальванический элемент, в форме вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой.
1802 - русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги.
1836 - английский химик Джон Дэниель поместил цинковый и медный электроды в раствор серной кислоты («элемент Даниэля»).
1859 - французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор.
1865 - французский химик Ж. Лекланше (элемент Лекланше) - цинковый стаканчик, заполненный водным раствором хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом (солевые батарейки).
1890 в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик.
Слайд 5Гальванические элементы сегодня - батарейки. Широко распространены три типа батареек:
Принцип их
Напряжение батарейки зависит как от используемых металлов, так и от количества элементов в «батарейке». Батарейки, в отличие от аккумуляторов, не способны к восстановлению своих свойств, поскольку в них происходит прямое преобразование энергии химической, то есть энергии составляющих батарейку реагентов (восстановителя и окислителя), в энергию электрическую.
Солевые (сухие)
Щелочные
(их называют еще алкалиновыми, «alkaline» в переводе с английского - «щелочной»)
Литиевые
Слайд 6Ряд напряжений металлов – необходим в нашем случае. Мы, как и
В своих опытах, как и классики, мы использовали медь и цинк. При погружении пластинок в электролит, между ним и цинковой пластинкой, происходит химическая реакция, в результате которой на пластинке скапливаются отрицательные заряды и она заряжается отрицательно. В результате реакции происходящей в гальваническом элементе, цинковый электрод постепенно растворяется.
Практическая часть
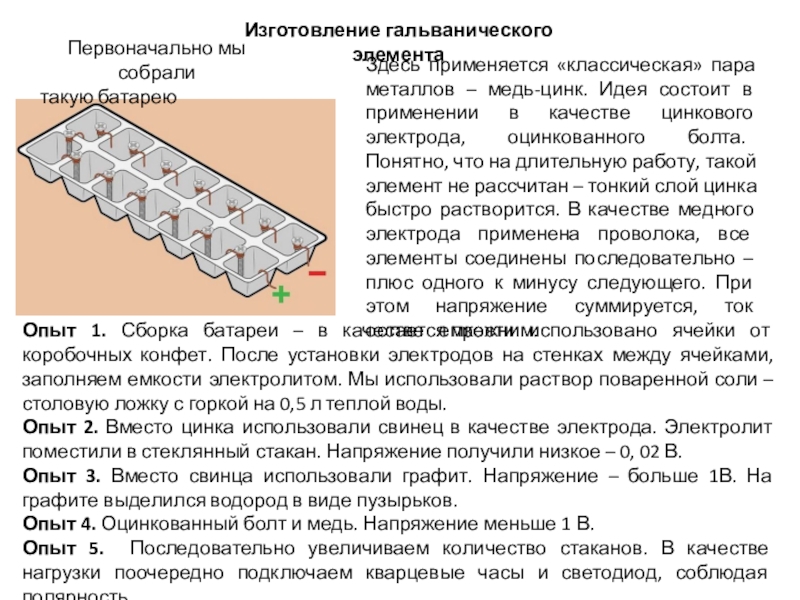
Слайд 7Изготовление гальванического элемента
Первоначально мы собрали
такую батарею
Здесь применяется «классическая» пара металлов
Опыт 1. Сборка батареи – в качестве емкости использовано ячейки от коробочных конфет. После установки электродов на стенках между ячейками, заполняем емкости электролитом. Мы использовали раствор поваренной соли – столовую ложку с горкой на 0,5 л теплой воды.
Опыт 2. Вместо цинка использовали свинец в качестве электрода. Электролит поместили в стеклянный стакан. Напряжение получили низкое – 0, 02 В.
Опыт 3. Вместо свинца использовали графит. Напряжение – больше 1В. На графите выделился водород в виде пузырьков.
Опыт 4. Оцинкованный болт и медь. Напряжение меньше 1 В.
Опыт 5. Последовательно увеличиваем количество стаканов. В качестве нагрузки поочередно подключаем кварцевые часы и светодиод, соблюдая полярность.