СШ №3 ТМР
Седова Ирина Владимировна
2019г.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Занятие-тренажёр для 8 класса по теме Химические уравнения.
Содержание
- 1. Занятие-тренажёр для 8 класса по теме Химические уравнения.
- 2. Цели занятия:Закрепить у учащихся понятие об уравнениях
- 3. Задачи занятия: 1.Образоватетельные:1) сформировать понятие
- 4. .Задание 1 Расставьте коэффициенты в уравнениях реакций:
- 5. Расставьте коэффициенты и определите типы реакций:1. Ca
- 6. Найдите ошибки и исправьте:1. Cu + S
- 7. Задание 2. Решите задачи: 1.
- 8. 5. Какое количество вещества кислорода образуется при
- 9. 8. Какое количество вещества сульфида железа (II)
- 10. 13. Какая масса кислорода выделится при разложении
- 11. Спасибо за хорошую работу!
Цели занятия:Закрепить у учащихся понятие об уравнениях химических реакций, как об условной записи, отражающей превращения веществ. Сформировать у учащихся умение составлять уравнения химических реакций и решать по ним задачи.
Слайд 1Занятие-тренажёр по темам
«Химические уравнения»,
«Расчеты по химическим уравнениям»
Подготовила учитель химии МОУ
Слайд 2Цели занятия:
Закрепить у учащихся понятие об уравнениях химических реакций, как об
условной записи, отражающей превращения веществ.
Сформировать у учащихся умение составлять уравнения химических реакций и решать по ним задачи.
Сформировать у учащихся умение составлять уравнения химических реакций и решать по ним задачи.
Слайд 3Задачи занятия:
1.Образоватетельные:1) сформировать понятие об уравнениях химических реакций;
научить самостоятельно составлять уравнения химических реакций.
2.Развивающие:1) развивать у учащихся умение наблюдать и анализировать увиденное; 2) формировать навыки самоконтроля усвоения изученного материала; 3) активизировать мышление учащихся с помощью самостоятельного поиска пути решения заданий.
3.Воспитывающие:1) содействовать профилактике утомляемости школьников в ходе урока, используя такие приемы поддержания работоспособности, как применение разнообразных видов работы, демонстрации опытов.
2.Развивающие:1) развивать у учащихся умение наблюдать и анализировать увиденное; 2) формировать навыки самоконтроля усвоения изученного материала; 3) активизировать мышление учащихся с помощью самостоятельного поиска пути решения заданий.
3.Воспитывающие:1) содействовать профилактике утомляемости школьников в ходе урока, используя такие приемы поддержания работоспособности, как применение разнообразных видов работы, демонстрации опытов.
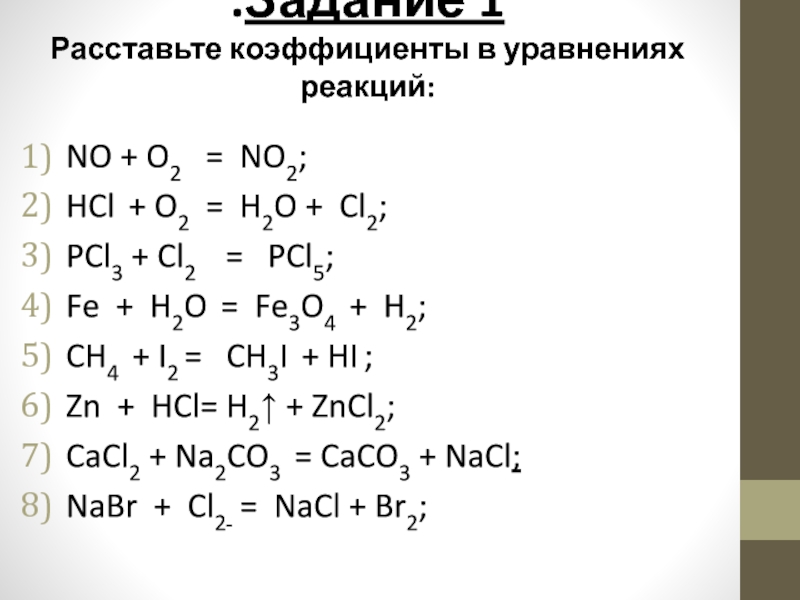
Слайд 4.Задание 1
Расставьте коэффициенты в уравнениях реакций:
NO + O2 = NO2;
HCl
+ O2 = H2O + Cl2;
PCl3 + Cl2 = PCl5;
Fe + H2O = Fe3O4 + H2;
CH4 + I2 = CH3I + HI ;
Zn + HCl= H2↑ + ZnCl2;
CaCl2 + Na2CO3 = CaCO3 + NaCl;
NaBr + Cl2 = NaCl + Br2;
PCl3 + Cl2 = PCl5;
Fe + H2O = Fe3O4 + H2;
CH4 + I2 = CH3I + HI ;
Zn + HCl= H2↑ + ZnCl2;
CaCl2 + Na2CO3 = CaCO3 + NaCl;
NaBr + Cl2 = NaCl + Br2;
Слайд 5Расставьте коэффициенты и определите типы реакций:
1. Ca + HCl = CaCl2
+ H2↑ ;
2. Mg + O2 = MgO;
3. H2S + O2 = H2O + SO2 ;
4. Fe2O3 + H2 = Fe + H2O
5. CaCl2 + NaOH = Ca(OH)2 + NaCl;
6. H2 + O2 = H2O;
7. Zn + CuCl2 = Cu + ZnCl2 ;
8. NH3 = N2 + H2 ;
2. Mg + O2 = MgO;
3. H2S + O2 = H2O + SO2 ;
4. Fe2O3 + H2 = Fe + H2O
5. CaCl2 + NaOH = Ca(OH)2 + NaCl;
6. H2 + O2 = H2O;
7. Zn + CuCl2 = Cu + ZnCl2 ;
8. NH3 = N2 + H2 ;
Слайд 6Найдите ошибки и исправьте:
1. Cu + S =CuSO4;
2. AgF +
NaCl =FCI + NaAg ;
3. CaCO3 =Ca(OH)2 + CO2↑;
4. CuBr2 + NaOH =Cu(OH)2 + NaBr3;
5. Fe + H2O = H↑ + Fe2O3 .
3. CaCO3 =Ca(OH)2 + CO2↑;
4. CuBr2 + NaOH =Cu(OH)2 + NaBr3;
5. Fe + H2O = H↑ + Fe2O3 .
Слайд 7 Задание 2. Решите задачи: 1. Какое количество вещества кислорода необходимо для сгорания 6
моль магния?
2. Какое количество вещества кислорода необходимо для получения 4 моль оксида магния?
3. Какое количество вещества кислорода необходимо для окисления 1,2 моль металла алюминия с образованием оксида алюминия?
Слайд 85. Какое количество вещества кислорода образуется при полном разложении 5 моль
оксида ртути (II)?
6. Сколько граммов оксида кальция получится при сгорании в кислороде 0,5 моль металла кальция?
7. Какое количество вещества оксида магния получится при сжигании в кислороде 480 г металла магния?
6. Сколько граммов оксида кальция получится при сгорании в кислороде 0,5 моль металла кальция?
7. Какое количество вещества оксида магния получится при сжигании в кислороде 480 г металла магния?
Слайд 98. Какое количество вещества сульфида железа (II) может быть получено при
взаимодействии 7 г железа с серой?
9. Определить массу серы, вступившей в реакцию с 0,1 моль железа, если образуется сульфид железа (II) – FeS.
10. Определить массу ртути, которая потребуется для реакции с кислородом, чтобы получить 0,1 моль оксида ртути (II) – HgO.
11. Какое количество вещества кислорода необходимо для сгорания 54 г алюминия?
12. Какая масса оксида алюминия образуется при взаимодействии алюминия с 0,5 моль кислорода?
9. Определить массу серы, вступившей в реакцию с 0,1 моль железа, если образуется сульфид железа (II) – FeS.
10. Определить массу ртути, которая потребуется для реакции с кислородом, чтобы получить 0,1 моль оксида ртути (II) – HgO.
11. Какое количество вещества кислорода необходимо для сгорания 54 г алюминия?
12. Какая масса оксида алюминия образуется при взаимодействии алюминия с 0,5 моль кислорода?
Слайд 1013. Какая масса кислорода выделится при разложении 1 моль бертоллетовой соли?
14.
Какая масса оксида магния получится при сгорании магния в 6,4 г кислорода?
15. Какова масса воды, образовавшейся при сгорании 8 г водорода в кислороде?
16. Какая масса серы в реакции с железом потребуется для образования 132 г сульфида железа FeS?
15. Какова масса воды, образовавшейся при сгорании 8 г водорода в кислороде?
16. Какая масса серы в реакции с железом потребуется для образования 132 г сульфида железа FeS?