по химии
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Внеурочная деятельность. Дидактическая игра: Умники и умницы
Содержание
- 1. Внеурочная деятельность. Дидактическая игра: Умники и умницы
- 2. Цель игры:Выявление и установление победителя игры «Умницы
- 3. Тема игры: Неорганическая химия
- 4. Условия игры:
- 5. 1 этап Выбор самых эрудированныхНа вопросы,
- 6. Вопросы 1-го этапа1. Химический элемент образует высший
- 7. Вопросы 1-го этапа2. Какие формулы различных кислот
- 8. Вопросы 1-го этапа3.Укажите в каждом из столбцов
- 9. Вопросы 1-го этапа4. Кислоты являются: А) жидкими веществами Б) твердыми веществами В) жидкими и твердыми веществами
- 10. Вопросы 1-го этапа5. Опаснее всего при приготовлении
- 11. ВНАЧАЛЕ ВОДА ПОТОМ КИСЛОТА!!!Серная кислота тяжелее воды.
- 12. Вопросы 1-го этапа6. При взаимодействии кислотного оксида
- 13. Вопросы 1-го этапа7. В трёх связанных кружочках
- 14. Вопросы 1-го этапа8. Более сильная кислота:
- 15. Вопросы 1-го этапа9. Образуйте из следующих кислот
- 16. Вопросы 1-го этапа10. Серная кислота H2SO4 в
- 17. Вопросы 1-го этапа11. Концентрированная азотная кислота:
- 18. Вопросы 1-го этапа12. Кислоты взаимодействуют с металлами:
- 19. Вопросы 1-го этапа13. Характер образующегося при взаимодействии
- 20. Вопросы 1-го этапа14. Водород выделяется при взаимодействии
- 21. Вопросы 1-го этапа15. Соляная кислота взаимодействует с: А) металлами Б) неметаллами В) металлами и неметаллами
- 22. Вопросы 1-го этапа16. Игра в «Крестики и
- 23. Вопросы 1-го этапа16. Игра в «Крестики и
- 24. Вопросы 1-го этапа17. Кислоты не взаимодействуют с:
- 25. Вопросы 1-го этапа18. При взаимодействии кислот с
- 26. Вопросы 1-го этапа19. При каком взаимодействии не
- 27. Вопросы 1-го этапа20. Какая из следующих реакций
- 28. Вопросы 1-го этапа21. Определите вещества А и
- 29. Вопросы 1-го этапа22. Игра в «Крестики и
- 30. Вопросы 1-го этапа23. Игра в «Крестики и
- 31. Вопросы 1-го этапа24. Игра в «Крестики и
- 32. II этапКонкурс 1 «Практическое задание»Конкурс 2 «Игра по трём словам»t33
- 33. II ЭТАП Конкурс 1 «Практическое задание»
- 34. II ЭТАП Конкурс 1 «Практическое задание»Na2SO4
- 35. II ЭТАП Конкурс 2 «Игра по трём
- 36. II ЭТАП Конкурс 2 «Игра по трём
- 37. II ЭТАП Конкурс 2 «Игра по трём
- 38. II ЭТАП Конкурс 2 «Игра по трём
- 39. II ЭТАП Конкурс 2 «Игра по трём
- 40. II ЭТАП Конкурс 2 «Игра по трём
- 41. II ЭТАП Конкурс 2 «Игра по трём
- 42. II ЭТАП Конкурс 2 «Игра по трём
- 43. ПОЗДРАВЛЯЕМ ПОБЕДИТЕЛЯ!!!Подведение итогов…
Цель игры:Выявление и установление победителя игры «Умницы и умники»Развитие разносторонних интеллектуальных и творческих способностей, интереса к предмету, самостоятельности, творческой активнстиКто мало знает, для того и этого многоКто много знает, тому и этого мало
Слайд 1«Умницы и умники»
Учитель химии:
Помогайбина Н.П.
ГБОУ СОШ № 7 «ОЦ» г.Новокуйбышевска
Внеклассное мероприятие
Слайд 2Цель игры:
Выявление и установление победителя игры «Умницы и умники»
Развитие разносторонних интеллектуальных
и творческих способностей, интереса к предмету, самостоятельности, творческой активнсти
Кто мало знает, для того и этого много
Кто много знает, тому и этого мало
Слайд 51 этап
Выбор самых эрудированных
На вопросы, ведущих, отвечает тот учащийся, кто
первым поднял руку
Представители жюри фиксируют:
Правильные ответы +1 балл (жетон)
Неправильные ответы -1 балл
Трое учащихся, набравшие максимальное количество баллов проходят во 2-ой этап
Набрав по 5 и более жетонов, получишь за ответы оценку «5» по химии
Представители жюри фиксируют:
Правильные ответы +1 балл (жетон)
Неправильные ответы -1 балл
Трое учащихся, набравшие максимальное количество баллов проходят во 2-ой этап
Набрав по 5 и более жетонов, получишь за ответы оценку «5» по химии
Слайд 6Вопросы 1-го этапа
1. Химический элемент образует высший оксид состава Э2О5 и
гидроксид состава НЭО3. Определите положение химического элемента в таблице периодической системы.
А) III период, III группа
Б) II период, III группа
В) II период, II группа
Г) II период, V группа
А) III период, III группа
Б) II период, III группа
В) II период, II группа
Г) II период, V группа
Слайд 7Вопросы 1-го этапа
2. Какие формулы различных кислот можно составить на основе
следующих строчек?
H2S HCl HNO3 H2SO4 H3PO4
Слайд 8Вопросы 1-го этапа
3.Укажите в каждом из столбцов одну кислоту, которая не
соответствует признаку, объединяющему их в ряд
Слайд 9Вопросы 1-го этапа
4. Кислоты являются:
А) жидкими веществами
Б) твердыми веществами
В) жидкими и твердыми веществами
Слайд 10Вопросы 1-го этапа
5. Опаснее всего при приготовлении растворов кислот:
А) кислоту
добавлять в воду
Б) воду добавлять в кислоту
В) смешивать вещества без помощи стеклянной палочки
Б) воду добавлять в кислоту
В) смешивать вещества без помощи стеклянной палочки
Слайд 11ВНАЧАЛЕ ВОДА ПОТОМ КИСЛОТА!!!
Серная кислота тяжелее воды.
При растворении её в
воде происходит сильное разогревание.
Вода, попав в массу концентрированной кислоты, разогревается до кипения – произойдёт мощный и опасный выброс кислоты!
Чтобы этого не произошло:
Вода, попав в массу концентрированной кислоты, разогревается до кипения – произойдёт мощный и опасный выброс кислоты!
Чтобы этого не произошло:
Слайд 12Вопросы 1-го этапа
6. При взаимодействии кислотного оксида с водой можно получить:
А) любую кислоту
Б) кислородосодержащую кислоту
В) безкислородную кислоту
Б) кислородосодержащую кислоту
В) безкислородную кислоту
Слайд 13Вопросы 1-го этапа
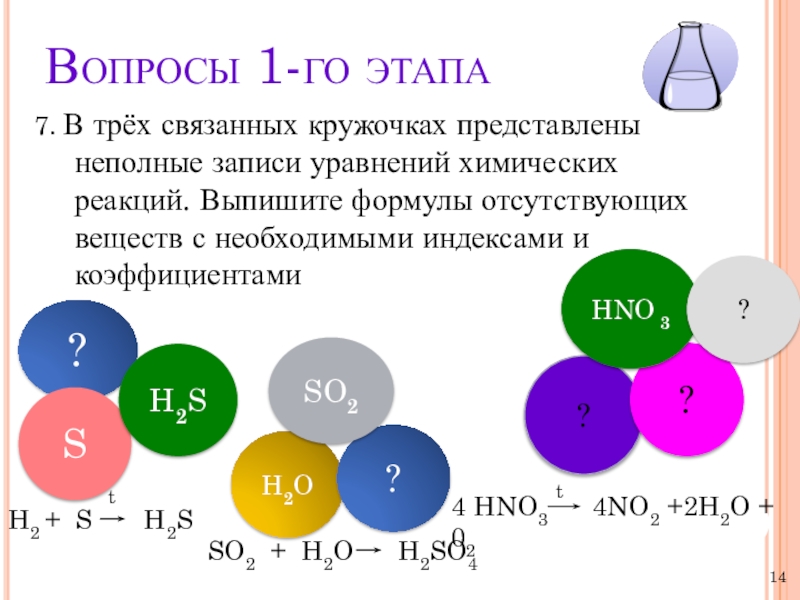
7. В трёх связанных кружочках представлены неполные записи уравнений
химических реакций. Выпишите формулы отсутствующих веществ с необходимыми индексами и коэффициентами
?
14
Слайд 15Вопросы 1-го этапа
9. Образуйте из следующих кислот ряд, который будет начинаться
с самой сильной и заканчиваться самой слабой кислотой
Фосфорная кислота (Na)
Уксусная кислота (Mg)
Азотная кислота (K)
Соляная кислота (Ca)
Угольная кислота (Al)
Если ряд определён правильно, то из металлов, заключённых в скобках, вы получите начало электрохимического ряда
Фосфорная кислота (Na)
Уксусная кислота (Mg)
Азотная кислота (K)
Соляная кислота (Ca)
Угольная кислота (Al)
Если ряд определён правильно, то из металлов, заключённых в скобках, вы получите начало электрохимического ряда
HNO3 HCl H3PO4 CH3COOH H2CO3
Слайд 16Вопросы 1-го этапа
10. Серная кислота H2SO4 в окислительно-восстановительных реакциях может быть:
А) только окислителем
Б) в зависимости от условий или окислителем, или восстановителем
В) только восстановителем
Б) в зависимости от условий или окислителем, или восстановителем
В) только восстановителем
Слайд 17Вопросы 1-го этапа
11. Концентрированная азотная кислота:
А) разлагается при нагревании
и освещении
Б) вытесняет соляную кислоту из растворов её солей
В) «растворяет» золото
Г) обугливает древесину и сахар
Б) вытесняет соляную кислоту из растворов её солей
В) «растворяет» золото
Г) обугливает древесину и сахар
Слайд 18Вопросы 1-го этапа
12. Кислоты взаимодействуют с металлами:
А) всегда
Б) если металл активный
В) если металл не активный
Б) если металл активный
В) если металл не активный
18
Слайд 19Вопросы 1-го этапа
13. Характер образующегося при взаимодействии между кислотами и металлами
веществ зависит от химической природы:
А) металла
Б) кислоты
В) металла и кислоты
А) металла
Б) кислоты
В) металла и кислоты
Слайд 20Вопросы 1-го этапа
14. Водород выделяется при взаимодействии железа:
А)
с конц. H2SO4
Б) с разб. HNO3
В) с разб. H2SO4
Г) с раствором KOH
Б) с разб. HNO3
В) с разб. H2SO4
Г) с раствором KOH
Слайд 21Вопросы 1-го этапа
15. Соляная кислота взаимодействует с:
А) металлами
Б)
неметаллами
В) металлами и неметаллами
В) металлами и неметаллами
Слайд 22Вопросы 1-го этапа
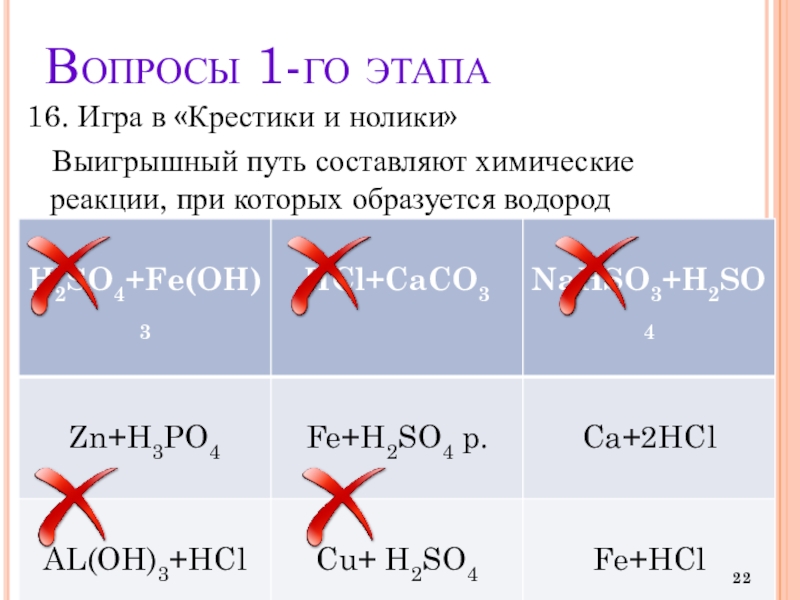
16. Игра в «Крестики и нолики»
Выигрышный путь
составляют химические реакции, при которых образуется водород
Слайд 23Вопросы 1-го этапа
16. Игра в «Крестики и нолики»
Выигрышный путь
составляют химические реакции, при которых образуется водород
Слайд 24Вопросы 1-го этапа
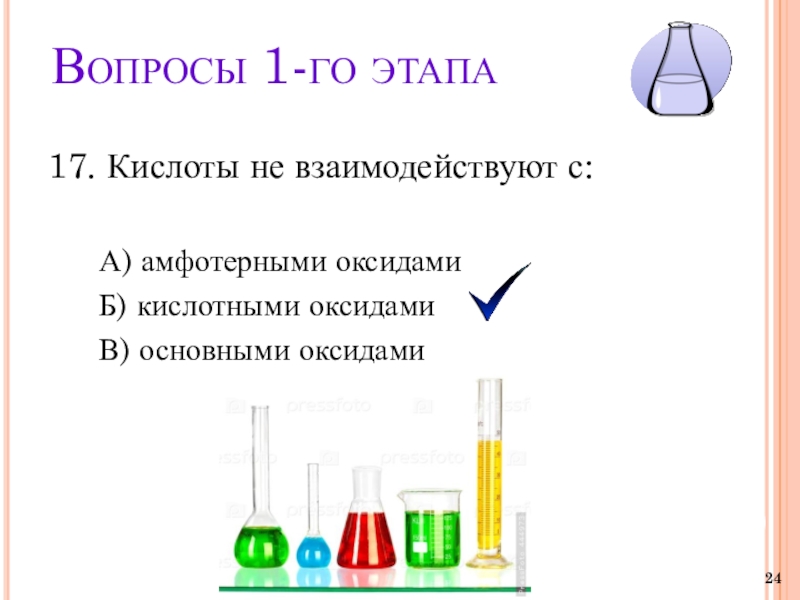
17. Кислоты не взаимодействуют с:
А) амфотерными
оксидами
Б) кислотными оксидами
В) основными оксидами
Б) кислотными оксидами
В) основными оксидами
Слайд 25Вопросы 1-го этапа
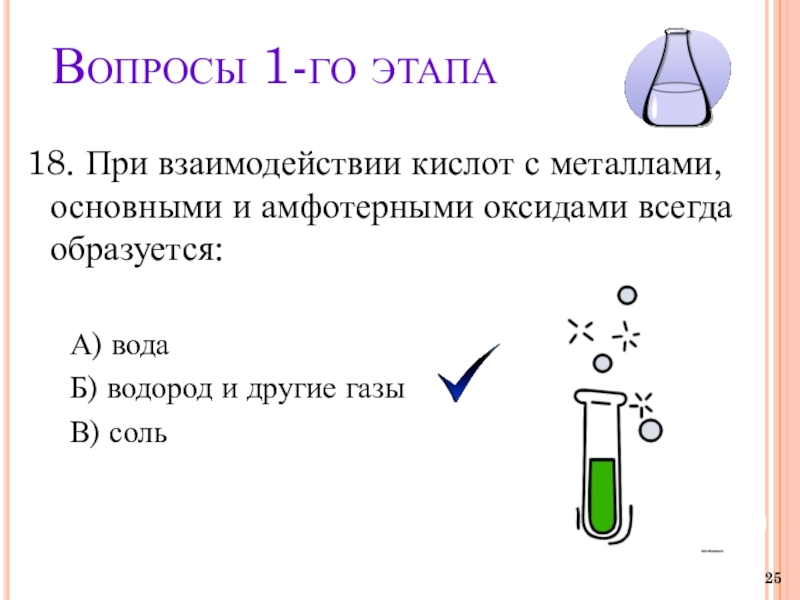
18. При взаимодействии кислот с металлами, основными и амфотерными
оксидами всегда образуется:
А) вода
Б) водород и другие газы
В) соль
А) вода
Б) водород и другие газы
В) соль
Слайд 26Вопросы 1-го этапа
19. При каком взаимодействии не образуется соль:
А)
кислоты с основным оксидом
Б) амфотерного оксида с кислотой
В) кислотного оксида с водой
Б) амфотерного оксида с кислотой
В) кислотного оксида с водой
Слайд 27Вопросы 1-го этапа
20. Какая из следующих реакций не является реакцией замещения:
А)
кислота и соль
Б) металл с кислотой
В) кислота и основание
Б) металл с кислотой
В) кислота и основание
Слайд 28Вопросы 1-го этапа
21. Определите вещества А и В и напишите уравнения
реакций
Ca + A = 2CaO CaO + B = Ca(OH)2
S + A = SO2 SO2 + B = H2SO3
Ca + A = 2CaO CaO + B = Ca(OH)2
S + A = SO2 SO2 + B = H2SO3
Слайд 29Вопросы 1-го этапа
22. Игра в «Крестики и нолики». Определите выигрышные пути
на следующих таблицах, если: они- вещества с которыми взаимодействует раствор серной кислоты:
Слайд 30Вопросы 1-го этапа
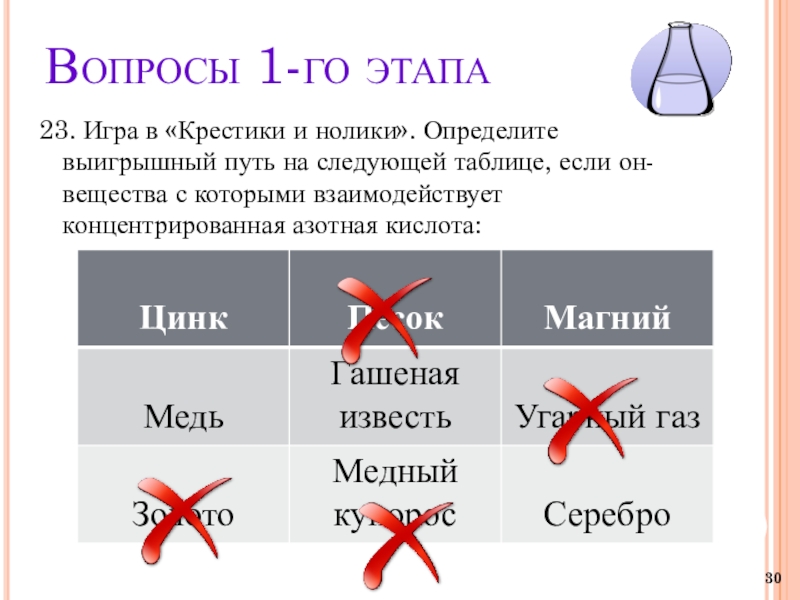
23. Игра в «Крестики и нолики». Определите выигрышный путь
на следующей таблице, если он- вещества с которыми взаимодействует концентрированная азотная кислота:
Слайд 31Вопросы 1-го этапа
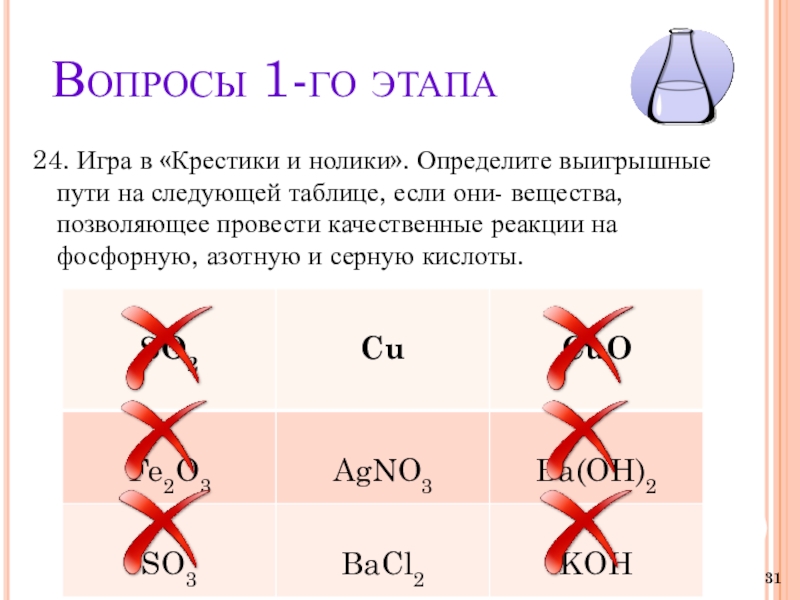
24. Игра в «Крестики и нолики». Определите выигрышные пути
на следующей таблице, если они- вещества, позволяющее провести качественные реакции на фосфорную, азотную и серную кислоты.
Слайд 33II ЭТАП
Конкурс 1 «Практическое задание»
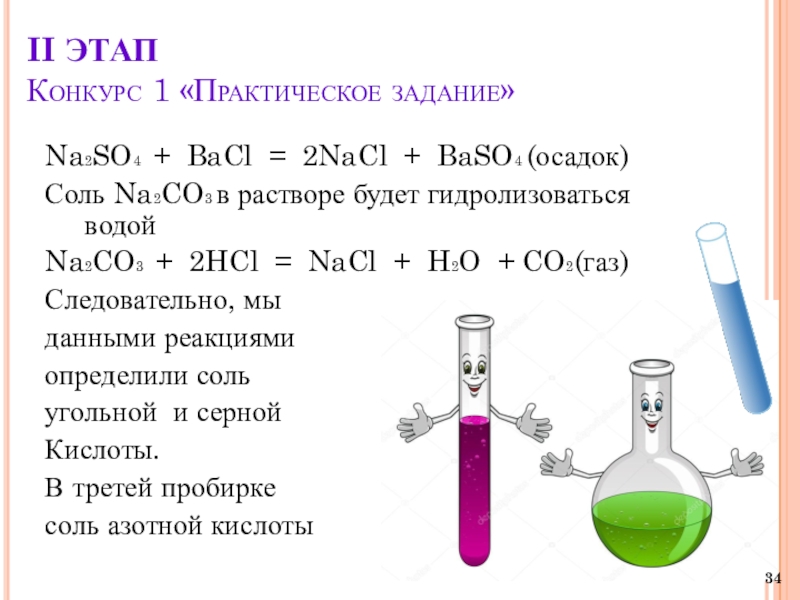
В трёх пробирках даны
растворы следующих солей: карбонат, сульфат, нитрат натрия
С помощью характерной реакции определите соль угольной кислоты
Опишите наблюдения
С помощью характерной реакции определите соль угольной кислоты
Опишите наблюдения
Слайд 34II ЭТАП
Конкурс 1 «Практическое задание»
Na2SO4 + BaCl = 2NaCl +
BaSO4 (осадок)
Соль Na2CO3 в растворе будет гидролизоваться водой
Na2CO3 + 2HCl = NaCl + H2O + CO2(газ)
Следовательно, мы
данными реакциями
определили соль
угольной и серной
Кислоты.
В третей пробирке
соль азотной кислоты
Соль Na2CO3 в растворе будет гидролизоваться водой
Na2CO3 + 2HCl = NaCl + H2O + CO2(газ)
Следовательно, мы
данными реакциями
определили соль
угольной и серной
Кислоты.
В третей пробирке
соль азотной кислоты
Слайд 35II ЭТАП
Конкурс 2 «Игра по трём словам»
2. Составьте формулы десяти различных
кислот, комбинируя нижеприведённые составные части кислот по горизонтали (слева направо) и вертикали (сверху вниз) при условии, что кислотообразующие составные части стоят рядом
H
H2 Cl H
H SO4 H2 NO3 H
H2 CO3 H2 S H3 PO4 H2
H Br H SO3 H I H4 SiO4 H
H
H2 Cl H
H SO4 H2 NO3 H
H2 CO3 H2 S H3 PO4 H2
H Br H SO3 H I H4 SiO4 H
Слайд 36II ЭТАП
Конкурс 2 «Игра по трём словам»
3. Составьте формулы девяти различных
солей, комбинируя нижеприведённые составные части солей по горизонтали (слева направо) и вертикали (сверху вниз) при условии, что солеобразующие составные части стоят рядом.
Cu
Na2 S O4
Ca S O4 S Ca
Ba Cl O4 Cu Na2 S Cu
Cu S O4 Na H S O4 S S
Cu
Na2 S O4
Ca S O4 S Ca
Ba Cl O4 Cu Na2 S Cu
Cu S O4 Na H S O4 S S
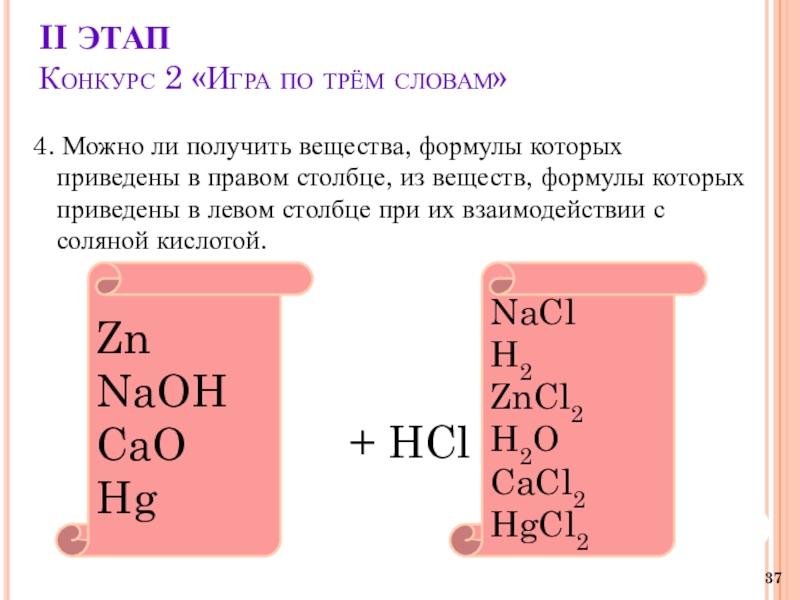
Слайд 37II ЭТАП
Конкурс 2 «Игра по трём словам»
4. Можно ли получить вещества,
формулы которых приведены в правом столбце, из веществ, формулы которых приведены в левом столбце при их взаимодействии с соляной кислотой.
+ HCl =
+ HCl =
Zn
NaOH
CaO
Hg
NaCl
H2
ZnCl2
H2O
CaCl2
HgCl2
Слайд 38II ЭТАП
Конкурс 2 «Игра по трём словам»
Zn + HCl
= ZnCl2 + H2
NaOH + HCl = NaCl + H2O
CaO + HCl = CaCl2 + H2O
Hg + HCl = реакция протекать не будет
NaOH + HCl = NaCl + H2O
CaO + HCl = CaCl2 + H2O
Hg + HCl = реакция протекать не будет
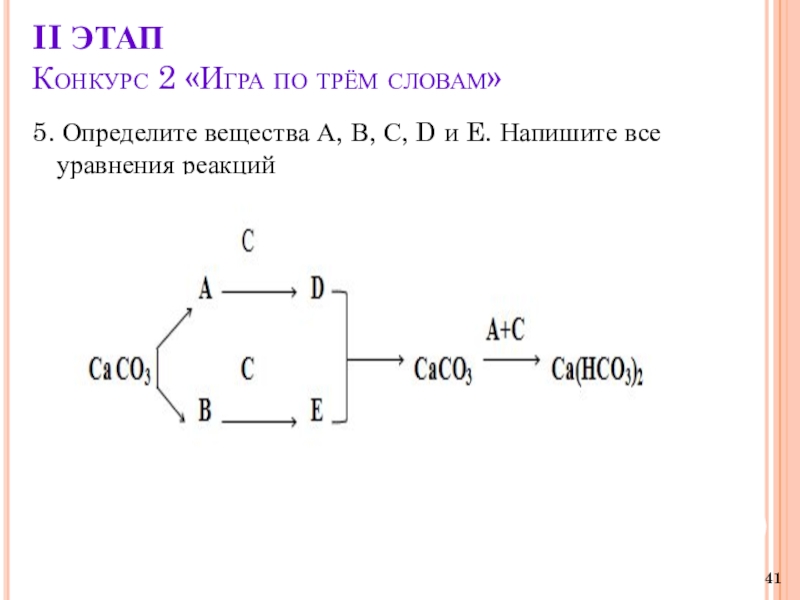
Слайд 39II ЭТАП
Конкурс 2 «Игра по трём словам»
5. Определите вещества A, B,
C, D, и E. Напишите все уравнения реакций.
2 Ba + A = 2 B
B + C = Ba(OH)2
Ba(OH)2 + 2D = BaCl2 + 2C
B + 2D = BaCl2 + C
BaCl2 + E = BaSO4 + 2D
2 Ba + A = 2 B
B + C = Ba(OH)2
Ba(OH)2 + 2D = BaCl2 + 2C
B + 2D = BaCl2 + C
BaCl2 + E = BaSO4 + 2D
Слайд 40II ЭТАП
Конкурс 2 «Игра по трём словам»
2Ba + A = 2B
2Ba
+ O2= 2BaО
B + C = Ba(OH) 2
BaО + Н2O = 2BaО
Ba(OH)2 + 2D = BaCl2 + 2C
Ba(OH)2 + 2HCl = BaCl2+2H2O
B + 2D = BaCl2 + C
Ba + 2HCl = BaCl2+ H2
BaCl2 + E = BaSO4 + 2D
BaCl2 + H2SO4 = BaSO4 + 2HCl
B + C = Ba(OH) 2
BaО + Н2O = 2BaО
Ba(OH)2 + 2D = BaCl2 + 2C
Ba(OH)2 + 2HCl = BaCl2+2H2O
B + 2D = BaCl2 + C
Ba + 2HCl = BaCl2+ H2
BaCl2 + E = BaSO4 + 2D
BaCl2 + H2SO4 = BaSO4 + 2HCl
Слайд 41II ЭТАП
Конкурс 2 «Игра по трём словам»
5. Определите вещества А, В,
С, D и E. Напишите все уравнения реакций
Слайд 42II ЭТАП
Конкурс 2 «Игра по трём словам»
6. При взаимодействии цинка массой
140 г и хлора количеством вещества 2 моль образовался хлорид цинка массой:
А) 272г,
Б)136г,
В) 68г,
Г) 55г.
А) 272г,
Б)136г,
В) 68г,
Г) 55г.