- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок-презентация Щелочноземельные металлы химия 10 класс Раджабова Сона Вахриевна
Содержание
- 1. Урок-презентация Щелочноземельные металлы химия 10 класс Раджабова Сона Вахриевна
- 2. План урока Положение щел-ных металлов в ПСХЭ
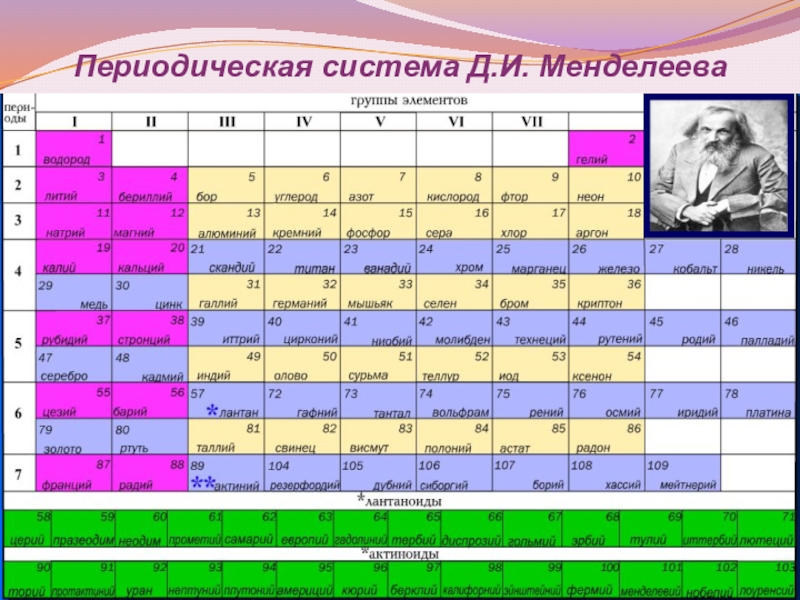
- 3. Периодическая система Д.И. Менделеева
- 4. Впервые Mg, Ca, Sr ,Ba были получены
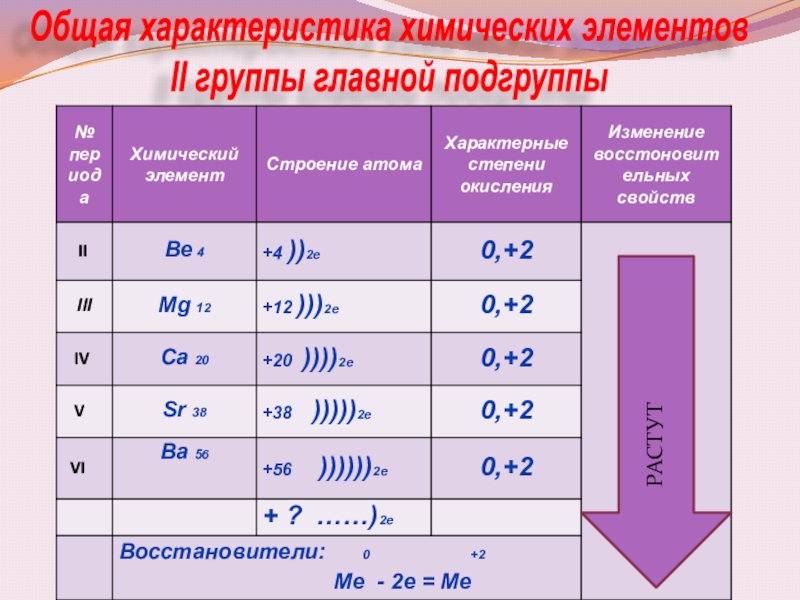
- 5. Общая характеристика химических элементов II группы главной подгруппыРАСТУТ
- 6. Выводы:
- 7. Упражнение Сравните атомы элементов, поставив знаки >,
- 8. Код ответа к
- 9. Распростарение в природеДоломит MgCO3 CaCO3 магнезит MgCO3Магний:Входит
- 10. Щел-ные металлы – простые веществаФизические свойства:
- 11. Физические свойстваМеталл светло-серого цвета, покрытый тончайшей оксидной
- 12. Химические свойства щел-ных металлов+ Н2О → гидрооксид
- 13. химические свойства щел-ных металловCaBaSrКатионы щелоч-ных металлов окрашивают пламя спиртовки
- 14. УпражнениеI вариантА) кальция с кислородомБ) бария с
- 15. Код ответа к упражнениям I вариантА) 2Сa°
- 16. Металлы в природе активныеСредней активностиблагородныеполучениеЭлектролиз расплава соли
- 17. Слайд 17
- 18. Слайд 18
- 19. Домашнее задание:Учебник: § 6.5 (стр. 159 – 162)Упражнение: №2,4,6 (стр. 162 )
Слайд 1Урок химии в 10 классе по теме:
Щелочноземельные металлы
Цель урока:
дать
металлов
Слайд 2План урока
Положение щел-ных металлов в ПСХЭ Д.И. Менделеева
Строение атомов химических
История открытия щел-ных металлов
Физические свойства щел-ных металлов
Химические свойства щел-ных металлов
Подведение итогов: тестирование
Слайд 4Впервые Mg, Ca, Sr ,Ba были получены в 1808г Гемфри Деви
Ra
Вe в виде простого вещества получил в 1828году немецкий учёный Фридрих Вёлер .
Г. Деви
История открытия
Слайд 7Упражнение
Сравните атомы элементов, поставив знаки >, < или = вместо *
I
А) заряд ядра
Mg* Ва ; Mg* Al
Б) число энергетических уровней
Mg* Ва ; Mg* Al
В) число электронов на внешнем уровне
Mg* Ва ; Mg* Al
Г) радиус атома
Mg* Ва ; Mg* Al
Д) восстановительные свойства
Mg* Ва ; Mg* Al
II вариант
А) заряд ядра
Ca* Sr ; K* Ca
Б) число энергетических уровней
Ca* Sr ; K* Ca
В) число электронов на внешнем уровне
Ca* Sr ; K* Ca
Г) радиус атома
Ca* Sr ; K* Ca
Д) восстановительные свойства
Ca* Sr ; K* Ca
Слайд 8
Код ответа к упражнениям
I вариант
А) заряд ядра
Mg < Ва ;
Б) число энергетических уровней
Mg < Ва ; Mg = Al
В) число электронов на внешнем уровне
Mg = Ва ; Mg < Al
Г) радиус атома
Mg < Ва ; Mg > Al
Д) восстановительные свойства
Mg < Ва ; Mg > Al
II вариант
А) заряд ядра
Ca < Sr ; K < Ca
Б) число энергетических уровней
Ca < Sr ; K = Ca
В) число электронов на внешнем уровне
Ca = Sr ; K < Ca
Г) радиус атома
Ca < Sr ; K > Ca
Д) восстановительные свойства
Ca < Sr ; K > Ca
Слайд 9
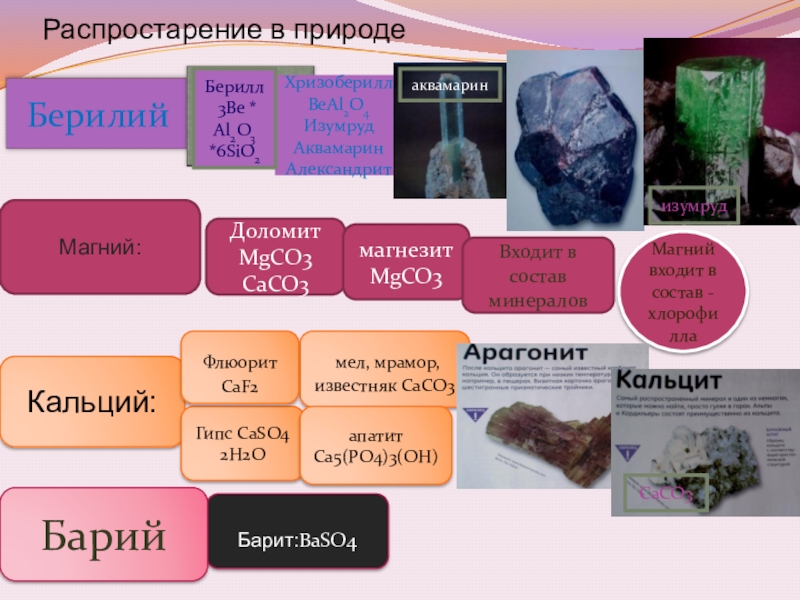
Распростарение в природе
Доломит MgCO3 CaCO3
магнезит MgCO3
Магний:
Входит в состав минералов
Магний входит
Кальций:
Гипс CaSO4 2H2O
мел, мрамор, известняк CaCO3
Флюорит CaF2
апатит Ca5(PO4)3(OH)
Барит:BaSO4
Барий
Берилл
3Be * Al2O3 *6SiO2
изумруд
аквамарин
СаСО3
Слайд 10Щел-ные металлы – простые вещества
Физические свойства:
Серебристо – белые, обладают
Слайд 11
Физические свойства
Металл светло-серого цвета, покрытый тончайшей оксидной плёнкой
Be
Тугоплав-
кий металл
t = 1287
Лёгкий, высокая твердость
Чистый пластичен , но незначительные примеси делают его хрупким
Mg
Мягкий и пластичный
Температура плавления
650 С
При комнатной тем-ре покрыт тонкой оксидной пленкой
Ca
Лёгкий, беловато-серый,
Пластичный металл
Из –за достаточной твёрдости невозможно резать ножом, как щелочные металлы
Температура плавления
С
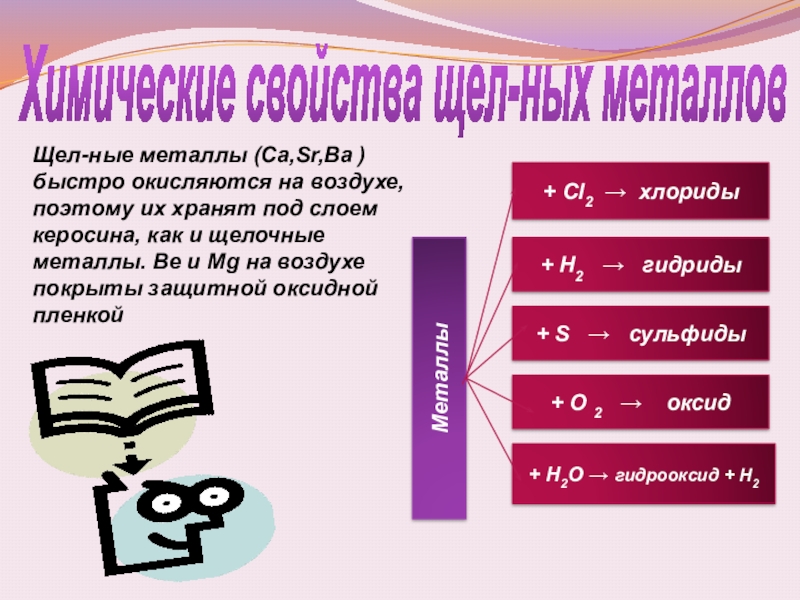
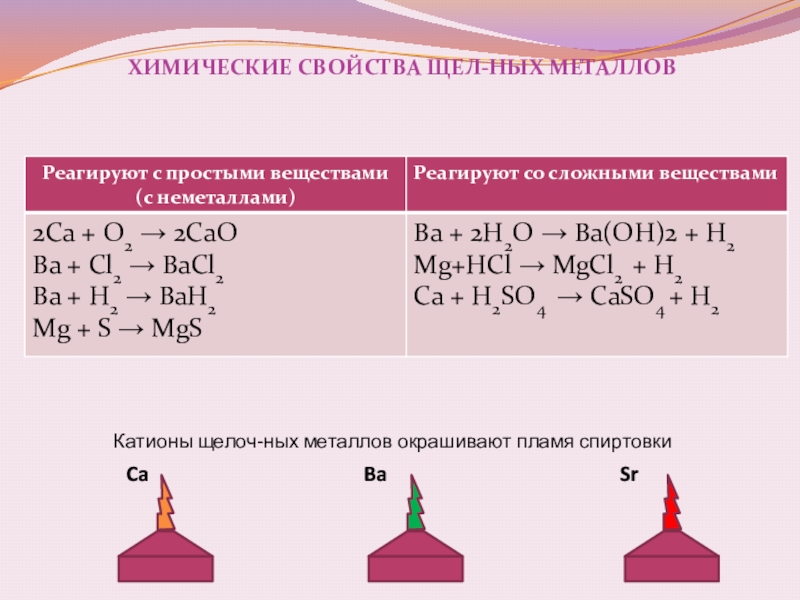
Слайд 12Химические свойства щел-ных металлов
+ Н2О → гидрооксид + Н2
+ Н2
+ S → сульфиды
+ Cl2 → хлориды
+ O 2 → оксид
Металлы
Щел-ные металлы (Ca,Sr,Ba ) быстро окисляются на воздухе, поэтому их хранят под слоем керосина, как и щелочные металлы. Be и Mg на воздухе покрыты защитной оксидной пленкой
Слайд 13химические свойства щел-ных металлов
Ca
Ba
Sr
Катионы щелоч-ных металлов окрашивают пламя спиртовки
Слайд 14Упражнение
I вариант
А) кальция с кислородом
Б) бария с водой
II вариант
А) магния с
Б) кальция с водой
Составить уравнения реакций
Реакцию а) рассмотреть как ОВР: определить степени окисления, составить электронный баланс, расставить коэффициенты
Слайд 15Код ответа к упражнениям
I вариант
А) 2Сa° + O°2 → 2Сa+2
O°2 + 4e → 2О -2 ок-ль
Б)Вa + 2Н2О→Вa(OH)2 + H2
II вариант
А) Mg° + Cl°2 → Mg+2Cl2 -
Mg° – 2e → Mg+2 вост-ль
Cl°2 – 2e → 2Cl - ок-ль
Б)Ca + 2Н2О→Ca(OH)2 + H2
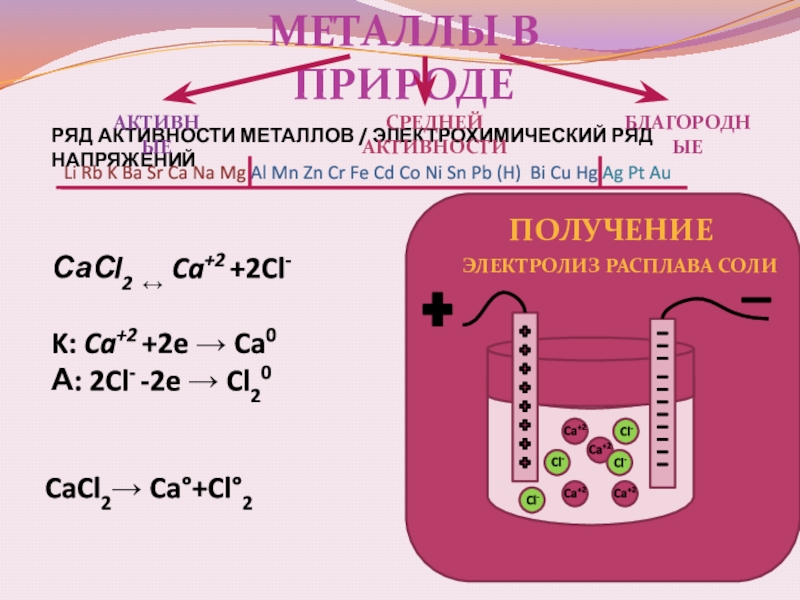
Слайд 16Металлы в природе
активные
Средней активности
благородные
получение
Электролиз расплава соли
CaCl2→ Ca°+Cl°2
СаСl2 ↔ Ca+2
K: Ca+2 +2e → Ca0
А: 2Cl- -2e → Cl20
Слайд 18
Код ответов :
1 – вариант 2 – вариант
1 – Б 1 – А
2 – Б 2 - Б
3 – А 3 - В
4 – А 4 - В
5 – В 5 – А