- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок по теме: Неметаллы (3 вар)
Содержание
- 1. Урок по теме: Неметаллы (3 вар)
- 2. НеметаллыНеметаллы - Это химические элементы, которые образуют
- 3. Бериллий
- 4. Астат
- 5. Расположение неметаллов в Пероидической системеЭлементы с типично неметаллическими свойствами занимают правый верхний угол Периодической системы.
- 6. Характерная особенность неметалловХарактерной особенностью неметаллов является большее
- 7. Агрегатные состояния неметалловНеметаллы различны по своему агрегатному
- 8. Аллотропные модификацииУ некоторых неметаллов наблюдается проявление аллотропии.
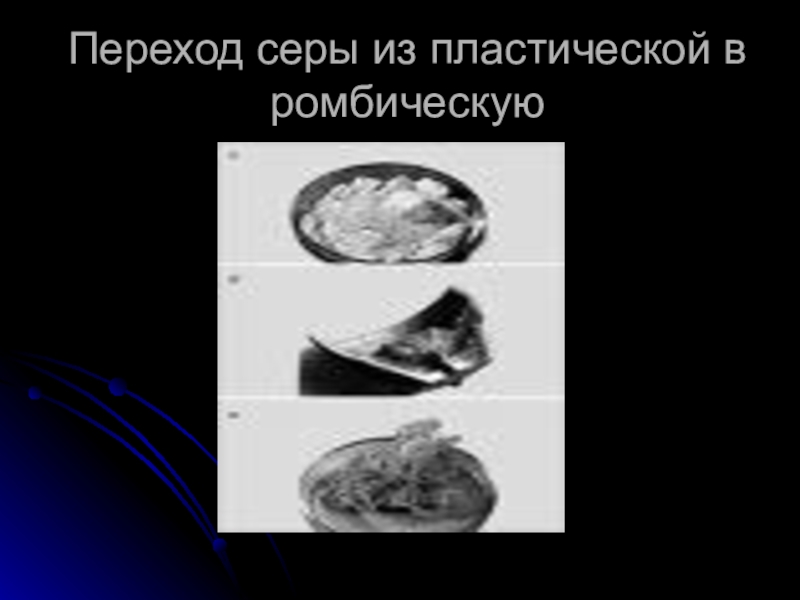
- 9. Переход серы из пластической в ромбическую
- 10. Углерод(алмаз)
- 11. Цвета неметалловЕсли для подавляющего большинства металлов характерен
- 12. Пары иода
- 13. Кристаллические решетки неметалловНеметаллы имеют различные типы кристаллической
- 14. Кристаллическая решетка иода
- 15. Свойства озонаОЗОН (от греч. ozon - пахнущий),
- 16. озонМолекула, состоящая из 3-х атомов кислорода, называется
- 17. озон
- 18. Растворимость озона в водеВ соответствии с законом
- 19. Получение озона1. УФ-облучение. Озон может образовываться вблизи
- 20. Второй способ получения озона2.Коронный разряд. Тем же
- 21. Коронный разряд
- 22. воздухВоздух — смесь газов. Основные компоненты его
- 23. Загрязненный воздух
- 24. Назначение воздухаОсновное назначение воздуха — это обеспечение
- 25. Основное назначение воздуха — это обеспечение дыхания живых организмов;
- 26. ФотосинтезВоздух — среда обитания всего живого на
- 27. растения являются основными поставщиками кислорода в атмосферу.
НеметаллыНеметаллы - Это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.Из известных химических элементов только 22 являются неметаллами. Если провести условную диагональ в переодической системе от берилия к астату, неметаллы
Слайд 1Неметаллы:
атомы и простые вещества.
Кислород, озон, воздух
Выполнила:
Ученица 91класса
Пушкарева Анжелла
Слайд 2Неметаллы
Неметаллы - Это химические элементы, которые образуют в свободном виде простые
вещества, не обладающие физическими свойствами металлов.
Из известных химических элементов только 22 являются неметаллами. Если провести условную диагональ в переодической системе от берилия к астату, неметаллы окажутся над ней т.е. они находятся в правом верхнем углу.
Из известных химических элементов только 22 являются неметаллами. Если провести условную диагональ в переодической системе от берилия к астату, неметаллы окажутся над ней т.е. они находятся в правом верхнем углу.
Слайд 5Расположение неметаллов в Пероидической системе
Элементы с типично неметаллическими свойствами занимают правый
верхний угол Периодической системы.
Слайд 6Характерная особенность неметаллов
Характерной особенностью неметаллов является большее (по сравнению с металлами)
число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Слайд 7Агрегатные состояния неметаллов
Неметаллы различны по своему агрегатному состоянию. Многие из них
газы (кислород, азот, гелий, водород, неон, ксенон, криптон и т.д.).Твердые вещества (фосфор, фтор, йод, бор и т.д.).Бром является жидкостью.
Для неметаллов характерно явление аллотропии. многие из них существуют в виде аллотропных видоизменений, например - фосфор, углерод, кислород, сера и т.д.
Для неметаллов характерно явление аллотропии. многие из них существуют в виде аллотропных видоизменений, например - фосфор, углерод, кислород, сера и т.д.
Слайд 8Аллотропные модификации
У некоторых неметаллов наблюдается проявление аллотропии. Так для газообразного кислорода
характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода четыре формы — графит, алмаз, карбин, фуллерен.
Слайд 11Цвета неметаллов
Если для подавляющего большинства металлов характерен серебристо-белый цвет, то окраска
неметаллов - простых веществ охватывает все цвета спектра: красный( красный фосфор, красно-бурый жидкий бром), желтый(сера), зеленый( хлор – желто – зеленый газ), фиолетовый (пары иода)
Слайд 13Кристаллические решетки неметаллов
Неметаллы имеют различные типы кристаллической решетки - атомную (бор,
кремний, углерод в виде алмаза) и молекулярную (йод, белый фосфор, сера кристаллическая)
Слайд 15Свойства озона
ОЗОН (от греч. ozon - пахнущий), О3, аллотропная модификация кислорода.
Газ синего цвета с резким запахом, t кип - 112 °С, сильный окислитель. При больших концентрациях разлагается со взрывом. Образуется из О2 при электрическом разряде (напр., во время грозы) и под действием ультрафиолетового излучения (напр., в стратосфере под действием ультрафиолетового излучения Солнца).
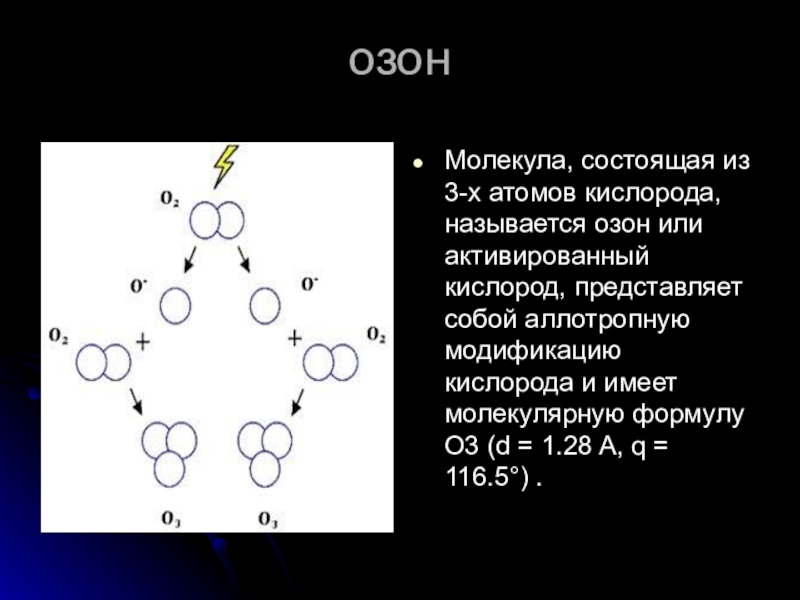
Слайд 16озон
Молекула, состоящая из 3-х атомов кислорода, называется озон или активированный кислород,
представляет собой аллотропную модификацию кислорода и имеет молекулярную формулу O3 (d = 1.28 A, q = 116.5°) .
Слайд 18Растворимость озона в воде
В соответствии с законом Генри концентрация озона в
воде возрастает с увеличением концентрации озона в газовой фазе, подмешиваемой в воду. Кроме того, чем выше температура воды, тем ниже концентрация озона в воде.
Растворимость озона в воде выше, чем кислорода, но ниже, чем хлора, в 12 раз. Если рассматривать 100% озон, то его предельная концентрация в воде составляет 570 мг/л при температуре воды 20С. Концентрация озона в газе на выходе современных озонаторных установок достигает 14% по весу. Ниже приведена зависимость концентрации озона, растворенного в дистиллированной воде, от концентрации озона в газе и температуры воды.
Растворимость озона в воде выше, чем кислорода, но ниже, чем хлора, в 12 раз. Если рассматривать 100% озон, то его предельная концентрация в воде составляет 570 мг/л при температуре воды 20С. Концентрация озона в газе на выходе современных озонаторных установок достигает 14% по весу. Ниже приведена зависимость концентрации озона, растворенного в дистиллированной воде, от концентрации озона в газе и температуры воды.
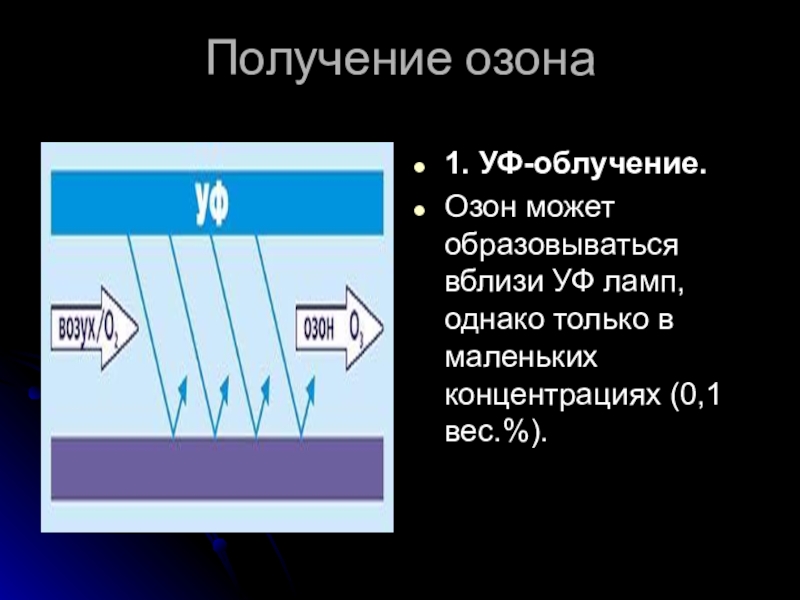
Слайд 19Получение озона
1. УФ-облучение.
Озон может образовываться вблизи УФ ламп, однако только
в маленьких концентрациях (0,1 вес.%).
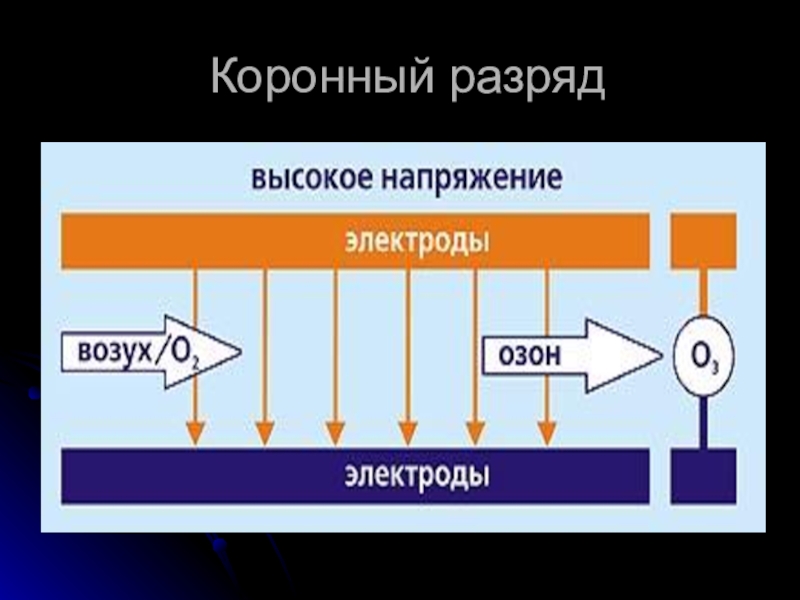
Слайд 20Второй способ получения озона
2.Коронный разряд.
Тем же способом, которым озон образуется
под действием электрических разрядов во время грозы, большое количество озона производится в современных электрических генераторах озона. Этот метод называется коронный разряд. Высокое напряжение пропускают через газовый поток, содержащий кислород. Энергия высокого напряжения разделяет молекулу кислорода О2 на 2 атома О, которые соединяются с молекулой О2 и образуют озон О3.
Чистый кислород, поступающий в генератор озона, можно заменить окружающим воздухом, содержащим большой процент кислорода.
Данный метод повышает содержание озона до 10-15 вес.%
Потребление энергии: 20 - 30 Вт/г О3 для воздуха 10 - 15 Вт/г О3 для кислорода
Чистый кислород, поступающий в генератор озона, можно заменить окружающим воздухом, содержащим большой процент кислорода.
Данный метод повышает содержание озона до 10-15 вес.%
Потребление энергии: 20 - 30 Вт/г О3 для воздуха 10 - 15 Вт/г О3 для кислорода
Слайд 22воздух
Воздух — смесь газов. Основные компоненты его — азот (78,16% по
объему), кислород (20,9%) и инертные газы (0,94%). Переменные составные части воздуха — углекислый газ и водяной пар. Пыль и различные газы, например SO2, H2S, оксиды азота и др., — примеси, наличие которых в воздухе зависит от местных условий, времени года, близости промышленных предприятий и др.
Слайд 24Назначение воздуха
Основное назначение воздуха — это обеспечение дыхания живых организмов; кроме
того, воздух используется для получения азота и кислорода, благородных газов (из сжиженного воздуха), при его наличии происходит горение топлива и многие другие природные процессы.
Слайд 26Фотосинтез
Воздух — среда обитания всего живого на Земле, поэтому охрана воздуха
— важнейшая задача человека. Первым шагом на пути к этому должно стать увеличение количества зеленых насаждений. Ведь именно растения являются основными поставщиками кислорода в атмосферу. Происходит это в процессе фотосинтеза :