- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок по теме: Неметаллы (2 вар)
Содержание
- 1. Урок по теме: Неметаллы (2 вар)
- 2. Неметаллы - химические элементы, которые образуют простые
- 3. Только два неметалла - углерод и сера
- 4. За исключением инертных газов, имеющих весьма устойчивую
- 5. В периодической системе элементов Д. И. Менделеева
- 6. При нормальных условиях кислород представляет собой бесцветный
- 7. самый легкий газообразный химический элемент – входит
- 8. Хлора в земное коре не очень много
- 9. Слайд 9
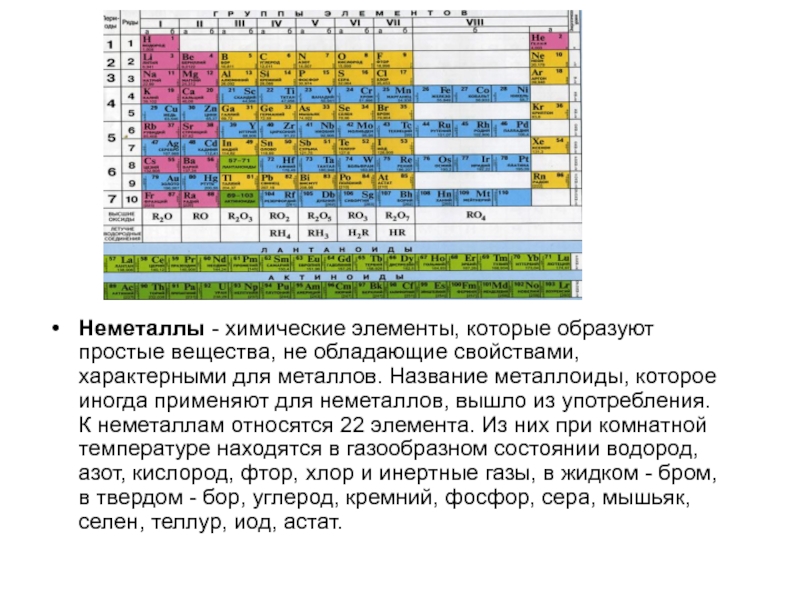
Неметаллы - химические элементы, которые образуют простые вещества, не обладающие свойствами, характерными для металлов. Название металлоиды, которое иногда применяют для неметаллов, вышло из употребления. К неметаллам относятся 22 элемента. Из них при комнатной температуре находятся в
Слайд 2
Неметаллы - химические элементы, которые образуют простые вещества, не обладающие свойствами,
характерными для металлов. Название металлоиды, которое иногда применяют для неметаллов, вышло из употребления. К неметаллам относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии водород, азот, кислород, фтор, хлор и инертные газы, в жидком - бром, в твердом - бор, углерод, кремний, фосфор, сера, мышьяк, селен, теллур, иод, астат.
Слайд 3
Только два неметалла - углерод и сера - были известны в
древности. В 13 веке был получен мышьяк, в 17 веке открыты водород и фосфор, в конце 18 века - кислород, азот, хлор, теллур. В 1789 году А. Л. Лавуазье включил эти Неметаллы в список простых веществ (кроме хлора, который тогда считали окисленной соляной кислотой). В первой половине 19 века были получены бром, иод, селен, кремний, бор. Изолировать фтор и открыть инертные газы удалось лишь в конце 19 века. Астат получен искусственно в 1940 году.
Слайд 4
За исключением инертных газов, имеющих весьма устойчивую внешнюю электронную оболочку и
потому практически неактивных химически, Неметаллы имеют высокую электроотрицательность. Атомы Неметаллов, присоединяя электроны, образуют простые анионы (например, Сl-, O2-) или сложные в сочетании с другими элементами (например, ClO4-, SO42-, PO43-).
Слайд 5
В периодической системе элементов Д. И. Менделеева электроотрицательность элементов возрастает в
пределах ряда от щелочных металлов направо, а в пределах подгрупп - снизу вверх. Наиболее электроотрицательны галогены - элементы подгруппы VIIa; их электроотрицательность убывает от фтора до астата. С кислородом Неметаллы образуют кислотные оксиды, дающие кислоты при соединении с водой; сила их убывает от подгруппы VIIa до IVa. Простейшие соединения Неметаллов с водородом при комнатной температуре газообразны; водные растворы водородных соединений Неметаллов подгруппы VIIa - сильные кислоты. Соединения неметаллов друг с другом, например фторид хлора ClF, хлорид иода ICl, дисульфид углерода (сероуглерод) CS2, характеризуются ковалентной связью. В соединениях типичных Неметаллов с металлами связь по преимуществу ионная, например, в хлориде калия KCl, оксиде магния MgO, трибромиде алюминия AlBr3.
Слайд 6
При нормальных условиях кислород представляет собой бесцветный газ, не имеющий запаха,
состоит из двухатомных молекул, имеет несколько бóльшую плотность, чем воздух, плохо растворим в воде.
Слайд 7
самый легкий газообразный химический элемент – входит в подгруппу периодической системы
элементов. В земной атмосфере водород в несвязанном состоянии существует только доли минуты, его количество составляет 1–2 части на 1 500 000 частей воздуха. Он выделяется обычно с другими газами при извержениях вулканов, из нефтяных скважин и в местах разложения больших количеств органических веществ. Водород соединяется с углеродом и(или) кислородом в органическом веществе типа углеводов, углеводородов, жиров и животных белков. В гидросфере водород входит в состав воды – наиболее распространенного соединения на Земле. В породах, грунтах, почвах водород соединяется с кислородом, образуя воду и гидроксид-ион OH
Слайд 8
Хлора в земное коре не очень много – всего 0,017%, причем
в свободном состоянии он встречается лишь в небольших количествах в вулканических газах. В списке самых распространенных элементов хлор находится в конце второго десятка. Хлора меньше, чем даже ванадия и циркония (но больше, чем хрома, никеля, цинка, меди и азота). При этом хлор очень сильно распылен: небольшие количества этого элемента входят в состав множества различных минералов и горных пород. Очень высокая химическая активность хлора приводит к тому, что в природе он встречается, как правило, в виде соединений, в сочетании с натрием, калием, магнием, кальцием.