- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Ферменты (СПО)
Содержание
- 1. Презентация по химии на тему Ферменты (СПО)
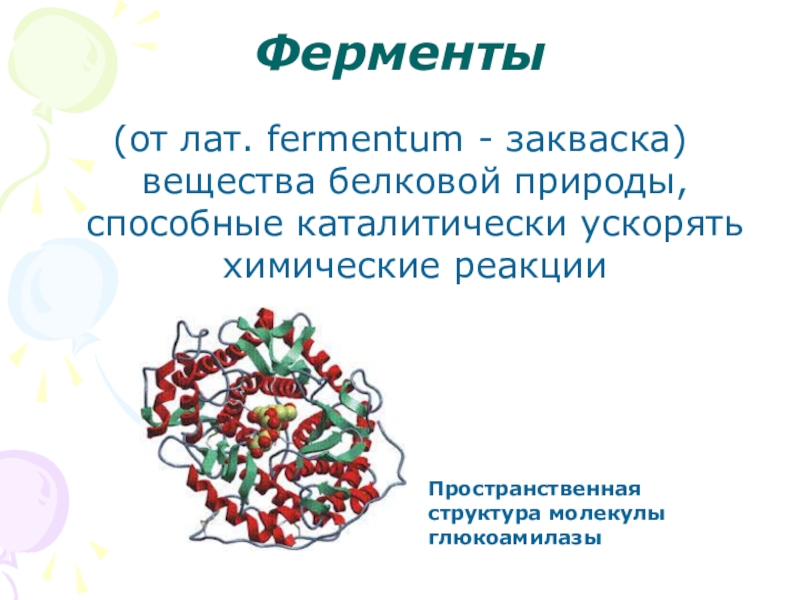
- 2. Ферменты(от лат. fermentum - закваска) вещества белковой
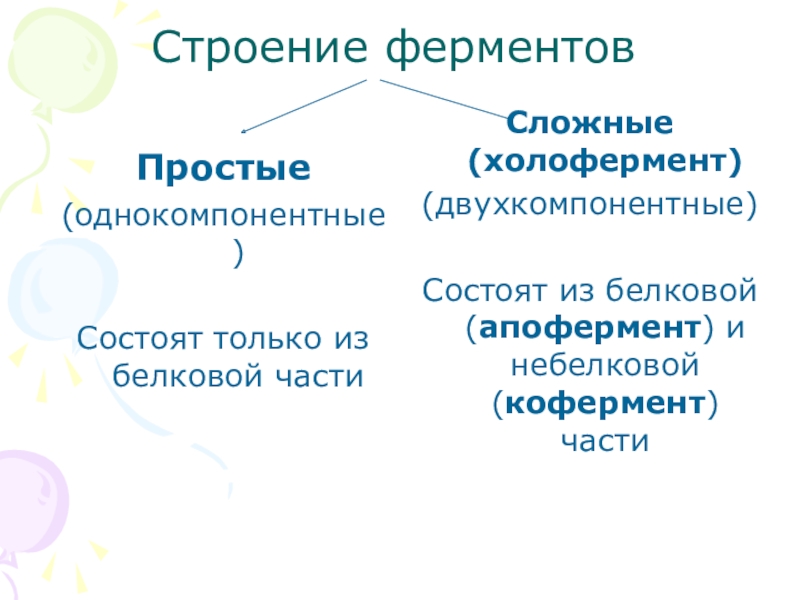
- 3. Строение ферментовПростые(однокомпонентные)Состоят только из белковой части Сложные (холофермент)(двухкомпонентные)Состоят из белковой (апофермент) и небелковой (кофермент) части
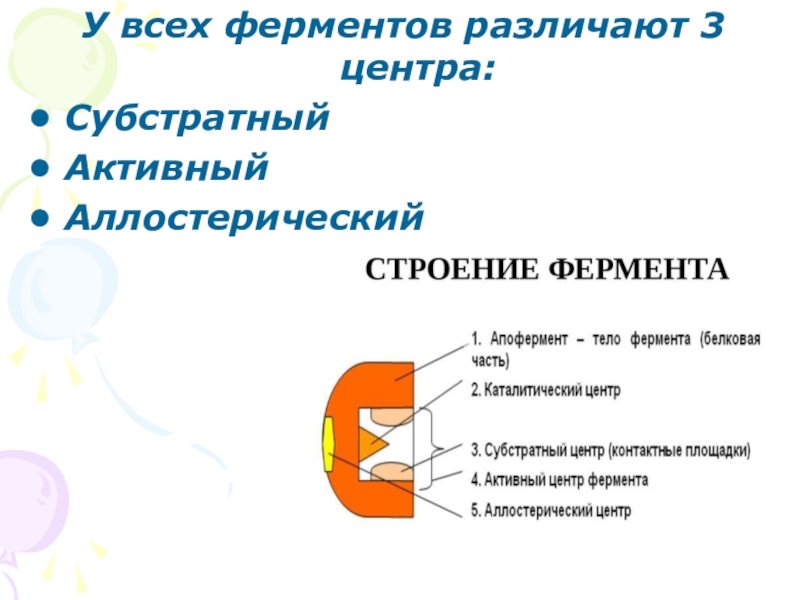
- 4. У всех ферментов различают 3 центра:СубстратныйАктивныйАллостерический
- 5. Субстратный центрФормируется из свободных функциональных групп полипептидной
- 6. Активный центрУ простого фермента может быть образован
- 7. Аллостерический центрУчасток молекулы фермента , участвующий в
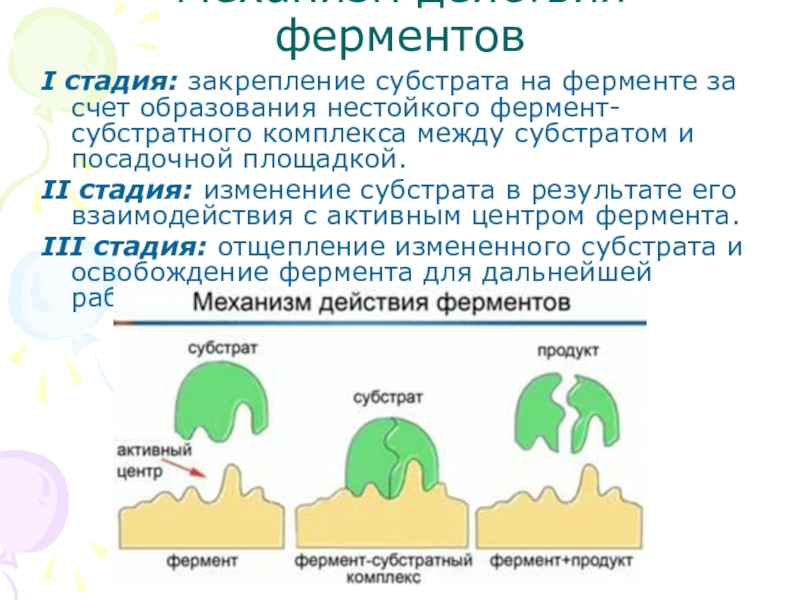
- 8. Механизм действия ферментовI стадия: закрепление субстрата на
- 9. Свойства ферментов1. Специфичность действия - это избирательность
- 10. Свойства ферментов3. Зависимость активности ферментов от температуры. При
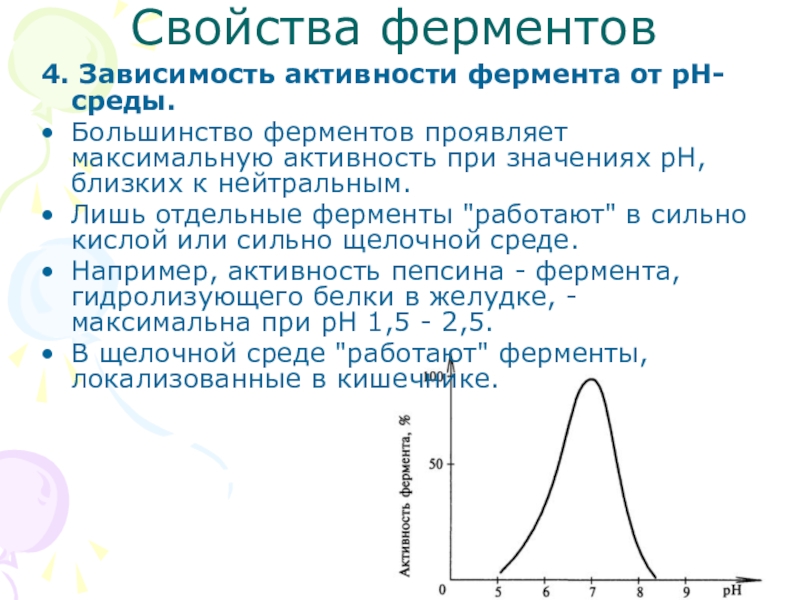
- 11. Свойства ферментов4. Зависимость активности фермента от рН-среды. Большинство
- 12. Свойства ферментов5. Влияние на активность ферментов активаторов
- 13. Классификация ферментовI. Оксидоредуктазы контролируют окислительно-восстановительные реакции.Дегидразы или
- 14. Классификация ферментовII. Трансферазы контролируют межмолекулярный перенос различных
- 15. Классификация ферментовIII. Гидролазы контролируют реакции гидролиза, т.
- 16. Классификация ферментовIV. Лиазы контролируют реакции разрушения различных
- 17. Классификация ферментовV. Изомеразы контролируют реакции внутримолекулярной перестройки.Например: фосфогексоизомераза контролирует превращение фруктозы в глюкозу и наоборот.
- 18. Классификация ферментовVI. Лигазы контролируют реакции синтеза сложных
- 19. Роль ферментов в организме человека По выполняемым
- 20. Роль ферментов в организме человека По выполняемым
- 21. Роль ферментов в организме человекаПо выполняемым функциям
- 22. Значение ферментов в молочной промышленностиПроизводство кисломолочных продуктов
- 23. Значение ферментов в хлебопекарной промышленностиСодержащая в муке
- 24. Вопросы для самоконтроляЧто такое ферменты?Чем объясняются свойства
- 25. Подготовить сообщение по теме «Использование ферментов в медицине» Задание для самостоятельной внеаудиторной работы студентов
- 26. Список используемой литературы:1. Нечаев А.П. Пищевая химия
- 27. Спасибо за внимание!
Слайд 1КОГПОАУ "Кировский технологический колледж пищевой промышленности"
Ферменты
Автор: Торопова А. Г.
Слайд 2Ферменты
(от лат. fermentum - закваска) вещества белковой природы, способные каталитически ускорять
Пространственная структура молекулы глюкоамилазы
Слайд 3Строение ферментов
Простые
(однокомпонентные)
Состоят только из белковой части
Сложные (холофермент)
(двухкомпонентные)
Состоят из белковой (апофермент)
Слайд 5Субстратный центр
Формируется из свободных функциональных групп полипептидной цепи при образовании третичной
Служит как посадочная площадка для закрепления субстрата на ферменте.
Слайд 6Активный центр
У простого фермента может быть образован участком полипептидной цепи.
У холофермента
Активный центр служит для изменения субстрата.
Слайд 7Аллостерический
центр
Участок молекулы фермента , участвующий в формирование третичной и четвертичной структуры
Роль аллостерического фактора могут выполнять исходные вещества, продукты реакции, гормоны, витамины.
Слайд 8Механизм действия ферментов
I стадия: закрепление субстрата на ферменте за счет образования
II стадия: изменение субстрата в результате его взаимодействия с активным центром фермента.
III стадия: отщепление измененного субстрата и освобождение фермента для дальнейшей работы.
Слайд 9Свойства ферментов
1. Специфичность действия - это избирательность фермента по отношению к
Каждый фермент контролирует строго определенную реакцию.
2. Высокая каталитическая активность. (Одна молекула каталазы за одну минуту ускоряет расщепление 5 млн молекул перекиси водорода).
Слайд 10Свойства ферментов
3. Зависимость активности ферментов от температуры.
При высоких значениях температуры может
При определенных (оптимальных) значениях температура может влиять на скорость образования фермент-субстратного комплекса, вызывая увеличение скорости реакции.
Температура, при которой каталитическая активность фермента максимальна, называется температурным оптимумом фермента.
Различные клеточные ферменты имеют собственные температурные оптимумы, которые определяются экспериментально. Для ферментов животного происхождения температурный оптимум находится в интервале 40 - 50°С.
Слайд 11Свойства ферментов
4. Зависимость активности фермента от рН-среды.
Большинство ферментов проявляет максимальную активность
Лишь отдельные ферменты "работают" в сильно кислой или сильно щелочной среде.
Например, активность пепсина - фермента, гидролизующего белки в желудке, - максимальна при рН 1,5 - 2,5.
В щелочной среде "работают" ферменты, локализованные в кишечнике.
Слайд 12Свойства ферментов
5. Влияние на активность ферментов активаторов и ингибиторов.
Активаторы ускоряют деятельность
Чаще всего активаторами ферментов являются катионы Mg2+, Mn2+, Zn2+, K+ и Со2+, а из анионов - Сl-.
В результате действия катионов субстратный и каталитический центры приобретают наиболее выгодную для осуществления катализа конфигурацию.
Ингибиторы тормозят действие ферментов.
Специфическое ингибирование Блокируется работа данного фермента путем нарушения работы одного или нескольких центров фермента.
Неспецифическое ингибирование
Работа фермента нарушается из-за нарушения его структуры, как любого белка.
Так действуют кислоты, щелочи, соли тяжелых металлов. Происходит либо денатурация белка-фермента, либо временное нарушение его структуры
Слайд 13Классификация ферментов
I. Оксидоредуктазы контролируют окислительно-восстановительные реакции.
Дегидразы или дегидрогеназы
Окисляют субстрат путем отщепления
Анаэробные дегидразы
Работают в условиях недостатка кислорода
Аэробные дегидразы
Работают в присутствии кислорода
Оксидазы
Окисляют субстрат в результате воздействия переноса электронов, либо ускоряя взаимодействие субстрата кислородом.
Слайд 14Классификация ферментов
II. Трансферазы контролируют межмолекулярный перенос различных атомов, групп атомов и
Например: аминотрансферазы контролируют перенос аминогрупп с аминокислоты на кетокислоту.
Они необходимы для синтеза заменимых аминокислот.
Слайд 15Классификация ферментов
III. Гидролазы контролируют реакции гидролиза, т. е. разрыв связей с
Например: липаза контролирует гидролиз сложноэфирных связей, образованных ВЖК.
Под ее воздействием жир в организме подвергается гидролизу до глицерина и ВЖК.
Слайд 16Классификация ферментов
IV. Лиазы контролируют реакции разрушения различных связей без участия воды.
Например:
Слайд 17Классификация ферментов
V. Изомеразы контролируют реакции внутримолекулярной перестройки.
Например: фосфогексоизомераза контролирует превращение фруктозы
Слайд 18Классификация ферментов
VI. Лигазы контролируют реакции синтеза сложных органических веществ из простых
Например: цитратсинтетаза ускоряет синтез лимонной кислоты.
Слайд 19Роль ферментов в организме человека
По выполняемым функциям ферменты в организме разделяют
Пищеварительные – расщепляют компоненты пищи на простые соединения, которые всасываются стенками кишечника, попадают в кровь и продолжают свой путь до клеток.
Данные ферменты содержаться на всем протяжении пищеварительного тракта.
Амилаза расщепляет сложные сахара (крахмал) до простых, сахарозы и мальтозы, которые затем могут участвовать в процессах жизнедеятельности организма; протеазы регулируют расщепление белков до аминокислот.
Слайд 20Роль ферментов в организме человека
По выполняемым функциям ферменты в организме разделяют
2. Метаболические – отвечают за обменные процессы, протекающие внутри клетки.
Они выполняют различные процессы, которые обеспечивают жизнедеятельность клетки (окислительно-восстановительные реакции, активизация аминокислот).
К ним относятся: аденилатциклазы (регулируют энергетический обмен), протеинкиназы и протеиндефосфотаза (участвуют в процессе фосфорилирования и дефосфорилирования).
Слайд 21Роль ферментов в организме человека
По выполняемым функциям ферменты в организме разделяют
3. Защитные – ликвидируют воспалительные процессы подобно иммунным агентам.
Важным ферментом является лизоцим, он расщепляет оболочки вредоносных бактерий и активирует ряд иммунных реакций, которые защищают организм от воспалительных реакций.
Слайд 22Значение ферментов в молочной промышленности
Производство кисломолочных продуктов (простокваша, кефир) основана на
Производство сыра тоже связано с ферментами. Молоко содержит белок - казеин, который в процессе химической реакции под действием протеаз изменяется, и в результате реакции выпадает в осадок.
Санитарно-гигиеническая оценка сырого молока (определение бактериальной обсемененности молока по редуктазной пробе).
Контроль эффективности пастеризации.
Слайд 23Значение ферментов в хлебопекарной промышленности
Содержащая в муке амилаза способствует гидролизу крахмала,
Протеаза, придающая тесту более пластичную клейковину, способствует удержанию углекислого газа в тесте. В результате улучшается структура пористости и повышается объем хлеба.
Липаза имеет большое значение при хранении муки, увеличивая ее кислотность.
Липоксигеназа окисляет жирные ненасыщенные кислоты муки в присутствии кислорода до перекисей, которые способствуют увеличению силы муки при хранении.
Слайд 24Вопросы для самоконтроля
Что такое ферменты?
Чем объясняются свойства ферментов?
На какие классы делятся
Значение ферментов в молочной промышленности?
Значение ферментов в хлебопекарной промышленности?
Слайд 25Подготовить сообщение по теме «Использование ферментов в медицине»
Задание для самостоятельной
Слайд 26Список используемой литературы:
1. Нечаев А.П. Пищевая химия [Электронный ресурс] / -
2. Крахмалева Т. Пищевая химия[Электронный ресурс] / - Оренбург : ОГУ, 2012. - 154 с.
3. Ермолина С.А., Пилип Л.В. Биологическая химия: Учебное пособие. – Киров: Вятская ГСХА, 2011. – 184 с.
4. Таганович, А. Д. Биологическая химия[Электронный ресурс] / - Минск : Вышэйшая школа, 2013. - 672 с




















![Презентация по химии на тему Ферменты (СПО) Список используемой литературы:1. Нечаев А.П. Пищевая химия [Электронный ресурс] / - Список используемой литературы:1. Нечаев А.П. Пищевая химия [Электронный ресурс] / - 5-е изд., испр. и доп. -](/img/thumbs/35be1ebfdc6dfef10f28020256d7c82c-800x.jpg)






