- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок по теме: Амины и аминокислоты
Содержание
- 1. Урок по теме: Амины и аминокислоты
- 2. Амины.органические производные аммиака, в молекулах которого один,
- 3. Изомеры и гомологи.У атома азота в молекулах
- 4. Физические свойства. Простейшие амины - газы с
- 5. Химические свойства. 1) Горение:
- 6. 4) Реакции замещения в ароматических аминах
- 7. Аминокислоты.Органические вещества, в молекулах которых содержатся две
- 8. Изомеры и гомологи.Межклассовыми изомерами для аминокислот являются
- 9. Химические свойства.1) Горение:
- 10. 3) Реакции с растворами щелочей:
- 11. Группа —CO—NH— называется амидной группой, а образующиеся
- 12. Получение аминокислот.1) Из карбоновых кислот:
- 13. Слайд 13
Амины.органические производные аммиака, в молекулах которого один, два или все три атома водорода замещены органическими радикалами.По числу радикалов амины делятся на первичные, вторичные и третичные.По типу простейших радикалов амины делятся на предельные, непредельные и ароматические:
Слайд 2Амины.
органические производные аммиака, в молекулах которого один, два или все три
атома водорода замещены органическими радикалами.
По числу радикалов амины делятся на первичные, вторичные и третичные.
По типу простейших радикалов амины делятся на предельные, непредельные и ароматические:
Предельный - CH3—CH2—NH2 (этиламин или аминоэтан)
Непредельный - CH2=CH—CH2—NH2 (аллиламин) Ароматический - C6H5—NH2 (фениламин)
По числу радикалов амины делятся на первичные, вторичные и третичные.
По типу простейших радикалов амины делятся на предельные, непредельные и ароматические:
Предельный - CH3—CH2—NH2 (этиламин или аминоэтан)
Непредельный - CH2=CH—CH2—NH2 (аллиламин) Ароматический - C6H5—NH2 (фениламин)
Слайд 3Изомеры и гомологи.
У атома азота в молекулах аминов есть неподеленная пара
электронов, которая может участвовать в образовании связи по донорно-акцепторному механизму. В ряду
Анилин аммиак первичный амин вторичный амин третичный амин
Электронная плотность на атоме азота возрастает. Из-за наличия в молекулах неподеленной пары электронов амины, как и аммиак, проявляют основные свойства. В ряду
Анилин аммиак первичный амин вторичный амин
Основные свойства усиливаются, из-за влияния типа и числа радикалов.
Анилин аммиак первичный амин вторичный амин третичный амин
Электронная плотность на атоме азота возрастает. Из-за наличия в молекулах неподеленной пары электронов амины, как и аммиак, проявляют основные свойства. В ряду
Анилин аммиак первичный амин вторичный амин
Основные свойства усиливаются, из-за влияния типа и числа радикалов.
Слайд 4Физические свойства.
Простейшие амины - газы с запахом аммиака, более сложные
- жидкости с запахом рыбы, высшие - твердые нерастворимые в воде вещества. Температуры кипения и растворимость в воде у аминов меньше, чем у соответствующих спиртов.
Слайд 5Химические свойства.
1) Горение:
4CH3NH2 + 9O2
4CO2 + 10H2O +2N2
4C6H5NH2 + 31O2 24CO2 + 14H2O + 2N2
2) Взаимодействие с водой:
CH3NH2 + H2O CH3NH3+ + OH-
Анилин с водой практически не реагирует.
3) Взаимодействие с кислотами (основные свойства):
2CH3NH2 + H2SO4 (CH3NH3)2SO4
2) Взаимодействие с водой:
CH3NH2 + H2O CH3NH3+ + OH-
Анилин с водой практически не реагирует.
3) Взаимодействие с кислотами (основные свойства):
2CH3NH2 + H2SO4 (CH3NH3)2SO4
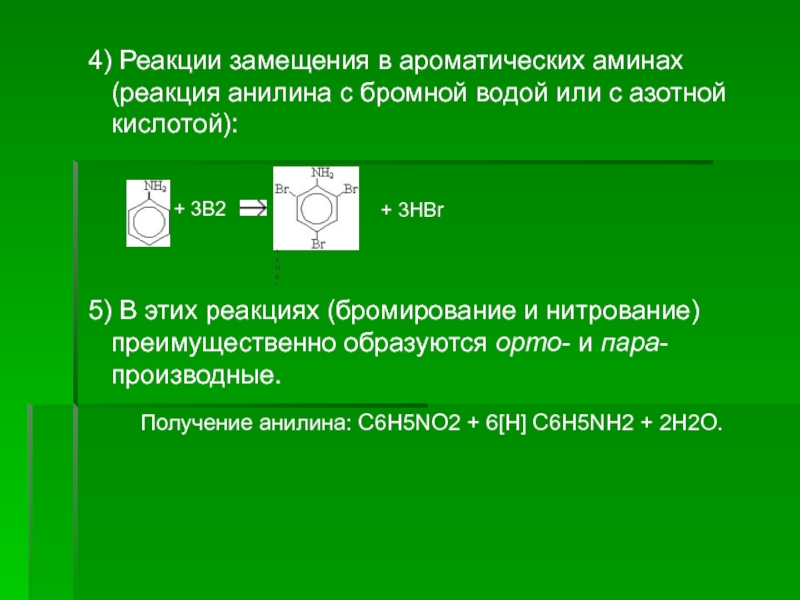
Слайд 6 4) Реакции замещения в ароматических аминах (реакция анилина с бромной
водой или с азотной кислотой):
5) В этих реакциях (бромирование и нитрование) преимущественно образуются орто- и пара-производные.
Получение анилина: C6H5NO2 + 6[H] C6H5NH2 + 2H2O.
5) В этих реакциях (бромирование и нитрование) преимущественно образуются орто- и пара-производные.
Получение анилина: C6H5NO2 + 6[H] C6H5NH2 + 2H2O.
+ 3B2
+ 3HBr
Слайд 7Аминокислоты.
Органические вещества, в молекулах которых содержатся две функциональные группы: аминогруппа и
карбоксильная группа.
Общая формула молекул аминокислот - NH2—R—COOH, где R - двухвалентный радикал. В твердом состоянии и частично в растворах аминокислоты представляют собой "внутренние соли", то есть состоят из биполярных ионов +NH3—R—COO-, образующихся при обратимом переносе протона (H+) от карбоксильной группы к аминогруппе, например:
Общая формула предельных аминокислот с одной карбоксильной и одной аминогруппой - CnH2n+1NO2.
Общая формула молекул аминокислот - NH2—R—COOH, где R - двухвалентный радикал. В твердом состоянии и частично в растворах аминокислоты представляют собой "внутренние соли", то есть состоят из биполярных ионов +NH3—R—COO-, образующихся при обратимом переносе протона (H+) от карбоксильной группы к аминогруппе, например:
Общая формула предельных аминокислот с одной карбоксильной и одной аминогруппой - CnH2n+1NO2.
Слайд 8Изомеры и гомологи.
Межклассовыми изомерами для аминокислот являются нитросоединения R—NO2.
Физические свойства: бесцветные
кристаллические вещества с температурами плавления 150 - 250oС, хорошо растворимы в воде (лучше, чем в органических растворителях), многие - сладкие.
Слайд 9Химические свойства.
1) Горение:
4NH2CH2COOH + 13O2 8CO2
+ 10H2O + 2N2
2) Взаимодействие с водой:
NH2CH2COOH + H2O +NH3CH2COOH + OH- NH2CH2COOH + H2O NH2CH2COO- + H3O+ (NH2CH2COOH NH2CH2COO- + H+)
Аминокислоты - амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная.
2) Взаимодействие с водой:
NH2CH2COOH + H2O +NH3CH2COOH + OH- NH2CH2COOH + H2O NH2CH2COO- + H3O+ (NH2CH2COOH NH2CH2COO- + H+)
Аминокислоты - амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная.
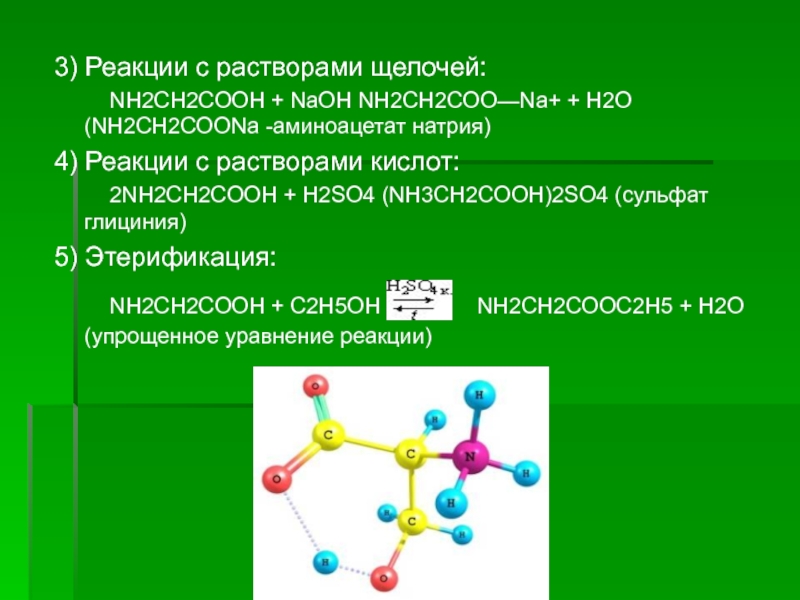
Слайд 103) Реакции с растворами щелочей:
NH2CH2COOH +
NaOH NH2CH2COO—Na+ + H2O (NH2CH2COONa -аминоацетат натрия)
4) Реакции с растворами кислот:
2NH2CH2COOH + H2SO4 (NH3CH2COOH)2SO4 (сульфат глициния)
5) Этерификация:
NH2CH2COOH + C2H5OH NH2CH2COOC2H5 + H2O (упрощенное уравнение реакции)
4) Реакции с растворами кислот:
2NH2CH2COOH + H2SO4 (NH3CH2COOH)2SO4 (сульфат глициния)
5) Этерификация:
NH2CH2COOH + C2H5OH NH2CH2COOC2H5 + H2O (упрощенное уравнение реакции)
Слайд 11Группа —CO—NH— называется амидной группой, а образующиеся полимеры - полиамидами.
Полиамиды -аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды. В таких соединениях группы —CO—NH— называют пептидными группами, а связь C—N - пептидной связью.
К полипептидам относятся белки. В их молекулах присутствуют остатки не одной, а нескольких аминокислот. При гидролизе белков (в кислотной среде или под действием ферментов) образуется смесь аминокислот.
Слайд 12Получение аминокислот.
1) Из карбоновых кислот:
CH3—CH2—COOH +
Cl2 CH3—CHCl—COOH + HCl
CH3—CHCl—COOH + 3NH3 CH3—CH(NH2)—COONH4 + NH4Cl
CH3—CH(NH2)—COONH4 + HCl CH3—CH(NH2)—COOH + NH4Cl
2) Гидролиз белков. Качественные ("цветные")реакции на белки: а) Ксантопротеиновая - появление желтой окпаски при взаимодействии белка с концентрированной азотной кислотой. б) Биуретовая - появление фиолетово-синей окраски при взаимодействии белков с гидроксидом меди(II).
2) Гидролиз белков. Качественные ("цветные")реакции на белки: а) Ксантопротеиновая - появление желтой окпаски при взаимодействии белка с концентрированной азотной кислотой. б) Биуретовая - появление фиолетово-синей окраски при взаимодействии белков с гидроксидом меди(II).