- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок химии 9 кл. Кислоты. Серная кислота
Содержание
- 1. Урок химии 9 кл. Кислоты. Серная кислота
- 2. Кислоты - это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
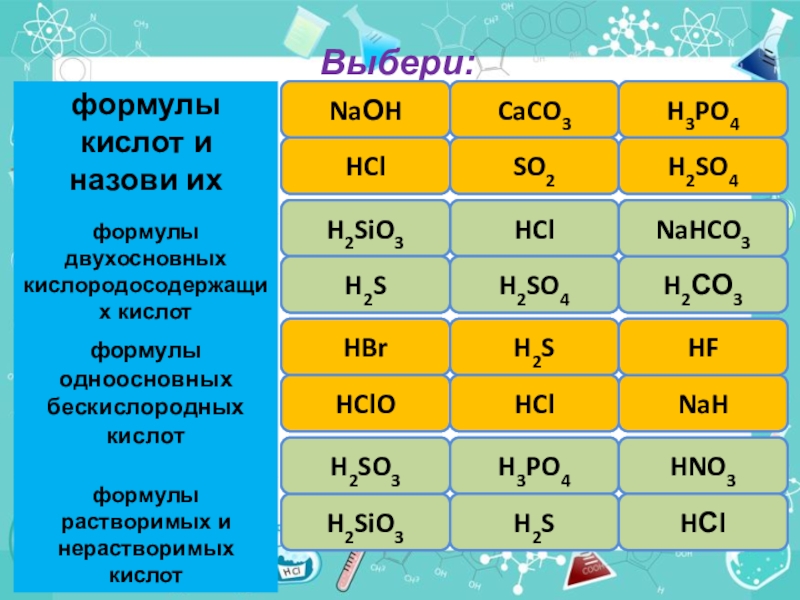
- 3. Выбери:правильноошибкаошибкаошибкаправильноправильноNaОHHClCaCO3SO2H3PO4H2SO4правильноошибкаошибкаправильноправильноошибкаHClH2SiO3H2SH2SO4H2СО3NaHCO3правильноошибкаошибкаправильноправильноошибкаHBrH2SHClONaHHClHFрастворимане растворимарастворимарастворимарастворимарастворимаH2SiO3H2SO3H3PO4H2SHNO3HСl
- 4. Типичные свойства кислот:1) диссоциация;2) Взаимодействие с основаниями;3)
- 5. Н2SО4Агрегатное состояние – жидкостьТяжелая маслянистая жидкость ("купоросное
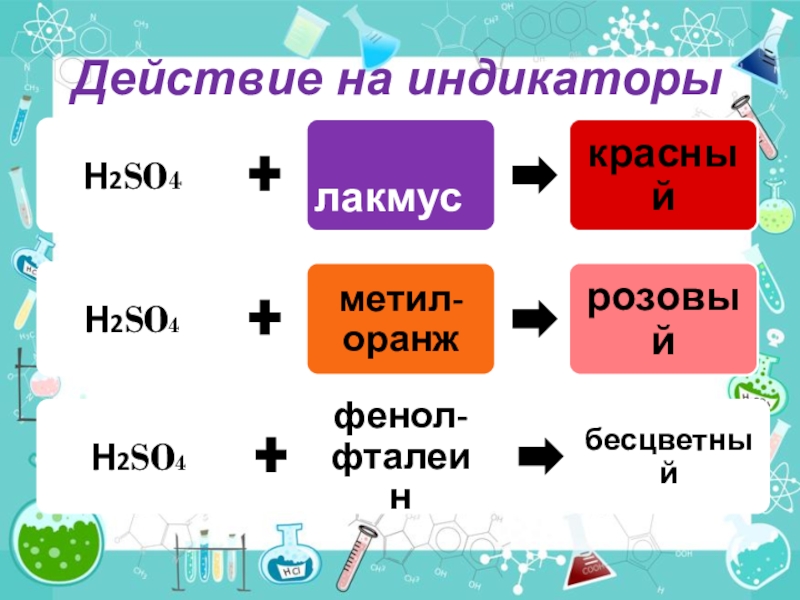
- 6. Действие на индикаторы
- 7. Слайд 7
- 8. Диссоциация:H2SO4 ↔ H+ + HSO4-
- 9. Химические свойства H2SO4С металлами (в ряду активности
- 10. Качественная реакцияNa2SO4+BaCI2→BaSO4↓+ 2NaCIБелый молочный осадок
- 11. ?Зависят ли свойства серной кислоты от её концентрации?
- 12. Свойства концентрированной серной кислотыCu + 2H2SO4(конц) →
- 13. В природе встречается 180 минералов сульфатов, и
- 14. Сульфат кальцияВ Мексике не так давно обнаружили
- 15. Промышленное получение H2SO4S SO2
- 16. Применение серной кислоты «Серная кислота – хлеб химической промышленности.»
- 17. С какими из перечисленных соединений будет взаимодействовать
- 18. Дописать уравнения реакций:Ca+H2SO4(конц.)=CaSO4+H2S+…Hg+H2SO4(конц.)=HgSO4+SO2+…
- 19. Дописать уравнения реакций: 4Ca+5H2SO4(конц.) = 4CaSO4+H2S+4H2O Hg+2H2SO4(конц.) = HgSO4+SO2+2H2O
- 20. Серная кислота – очень активная жидкость, Особенно
- 21. ДОМАШНЕЕ ЗАДАНИЕУЧЕБНИК § 16, Упражнение№5, стр.78(Письменно)
- 22. Спасибо за внимание !
Слайд 1Тема урока: «Серная кислота»
Цель: познакомиться с применением серной кислоты, её особыми
Слайд 2Кислоты - это сложные вещества, молекулы которых состоят из атомов водорода
Слайд 3Выбери:
правильно
ошибка
ошибка
ошибка
правильно
правильно
NaОH
HCl
CaCO3
SO2
H3PO4
H2SO4
правильно
ошибка
ошибка
правильно
правильно
ошибка
HCl
H2SiO3
H2S
H2SO4
H2СО3
NaHCO3
правильно
ошибка
ошибка
правильно
правильно
ошибка
HBr
H2S
HClO
NaH
HCl
HF
растворима
не растворима
растворима
растворима
растворима
растворима
H2SiO3
H2SO3
H3PO4
H2S
HNO3
HСl
Слайд 4Типичные свойства кислот:
1) диссоциация;
2) Взаимодействие с основаниями;
3) Взаимодействие с оксидами металлов;
4)
5) Взаимодействие с солями.
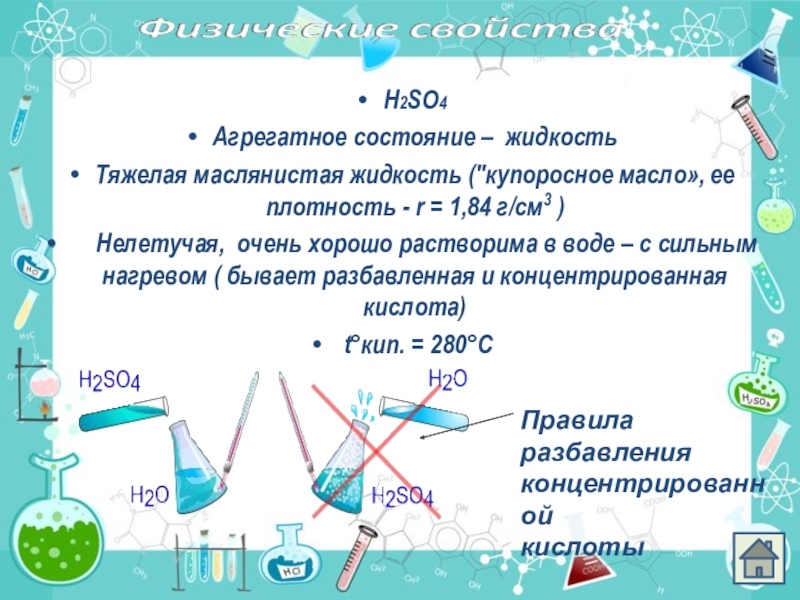
Слайд 5Н2SО4
Агрегатное состояние – жидкость
Тяжелая маслянистая жидкость ("купоросное масло», ее плотность -
Нелетучая, очень хорошо растворима в воде – с сильным нагревом ( бывает разбавленная и концентрированная кислота)
t°кип. = 280°С
Правила
разбавления
концентрированной
кислоты
Слайд 8Диссоциация:
H2SO4 ↔ H+ + HSO4-
Соли серной кислоты
Сульфаты( средние)
Гидросульфаты (кислые)
Слайд 9Химические свойства H2SO4
С металлами (в ряду активности металлов до водорода):
H2SO4+Zn=ZnSO4 +
2. С оксидами металлов:
H2SO4+K2O=K2SO4+H2O
3. С гидроксидами металлов:
H2SO4+2NaOH=Na2SO4+2H2O
4. С солями:
H2SO4+MgCO3=MgSO4+H2O+CO2
Слайд 12Свойства концентрированной серной кислоты
Cu + 2H2SO4(конц) → SO2 + CuSO4 +
Cu0 + 2е → Cu+2 1 восстановитель, окисляется
S+6 + 2е→ S+4 1 окислитель, восстанавливается
4Zn + 5H2SO4(конц)→ H2S + 4ZnSO4 + 4H2О
Zn0 + 2е → Zn+2 4 восстановитель, окисляется
S+6 + 8е→ S-2 1 окислитель, восстанавливается
Слайд 13В природе встречается 180 минералов сульфатов, и на их долю приходится
Их даже много и в морской воде, особенно в лагунах по берегам морей.
Много сульфатов и в горячих водных растворах, просачивающихся из глубин Земли.
Слайд 14Сульфат кальция
В Мексике не так давно обнаружили пещеру
2Н2О)
(CaSO4
Слайд 17С какими из перечисленных соединений будет взаимодействовать раствор серной кислоты?
Составьте уравнения
правильно
NaОH
правильно
ошибка
ошибка
правильно
CaO
HCl
SO3
Ba(NO3)2
H2SO4 + NaOH = Na2SO4 + H2O
H2SO4 + CaO = CaSO4 + H2O
H2SO4 + Ba(NO3)2 = BaSO4↓ + HNO3
(реакция
обмена,)
(реакция
обмена)
(реакция
обмена)
Слайд 19Дописать уравнения реакций:
4Ca+5H2SO4(конц.) = 4CaSO4+H2S+4H2O
Hg+2H2SO4(конц.) = HgSO4+SO2+2H2O
Слайд 20Серная кислота –
очень активная жидкость,
Особенно концентрированная,
которая реагирует со
многими
также она легко действует на
органические соединения:
обугливает бумагу, сахар, древесину, т.е. соединения, которые содержат в себе углерод.
Хранят ее в стеклянной таре,
а перевозят в стальных цистернах
ВЫВОД