- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Типичные реакции средних солей
Содержание
- 1. Типичные реакции средних солей
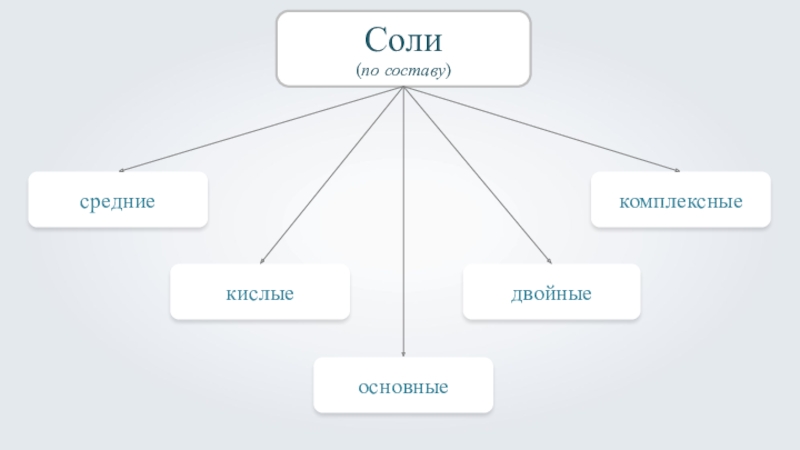
- 2. Соли(по составу)средниекислыеосновныедвойныекомплексные
- 3. Средние соли — соли, состоящие из кислотного остатка и ионов металла.ионы металлакислотный остаток
- 4. Реакции средних солей 1. Взаимодействие соли и
- 5. Реакция взаимодействия соли и кислотысоль + кислота
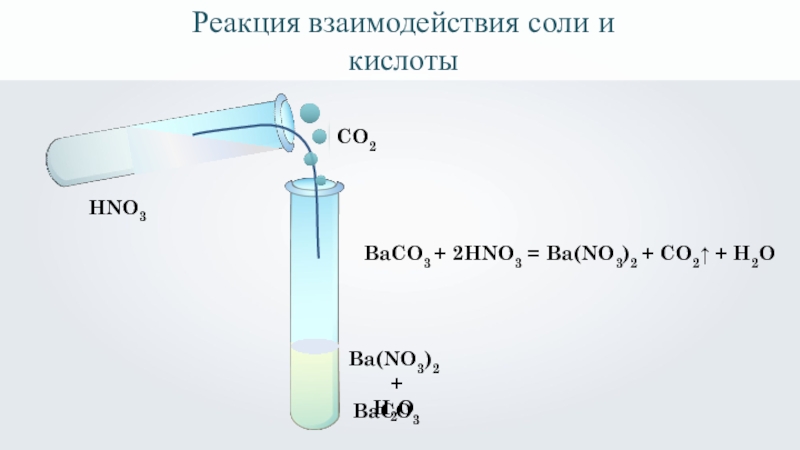
- 6. Реакция взаимодействия соли и кислотыBaCO3HNO3BaCO3 + 2HNO3 = Ba(NO3)2 + CO2↑ + H2O CO2Ba(NO3)2 + H2O
- 7. Взаимодействие соли и щёлочисоль + основание →
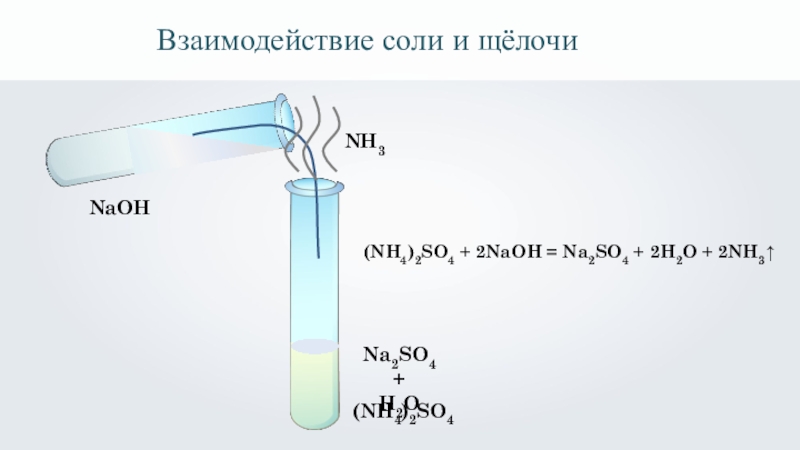
- 8. (NH4)2SO4 NaOH(NH4)2SO4 + 2NaOH = Na2SO4 + 2H2O + 2NH3↑ NH3Взаимодействие соли и щёлочиNa2SO4 +H2O
- 9. соль1 + соль2 → другая соль1 +
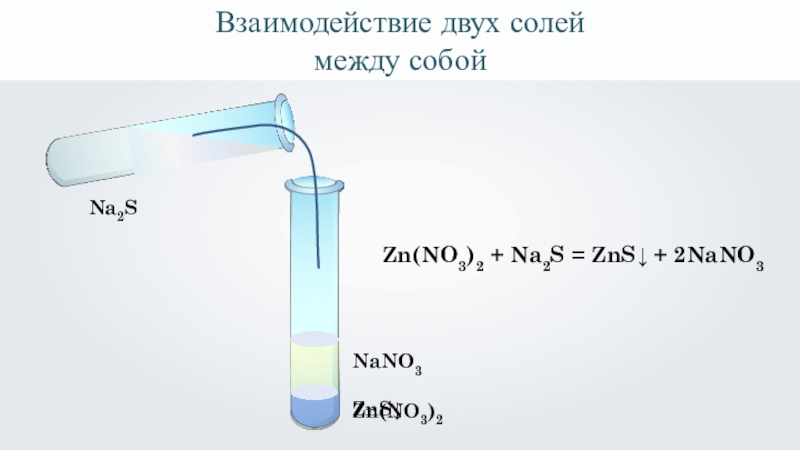
- 10. Взаимодействие двух солей между собойZn(NO3)2 Na2SZnS↓ NaNO3Zn(NO3)2 + Na2S = ZnS↓ + 2NaNO3
- 11. соль + металл → другая соль +
- 12. БекетовНиколай Николаевич1865 год – изучение реакционной способности одних металлов вытеснятьиз солей другие металлы
- 13. Вытеснительный ряд металловMg → Al → Zn
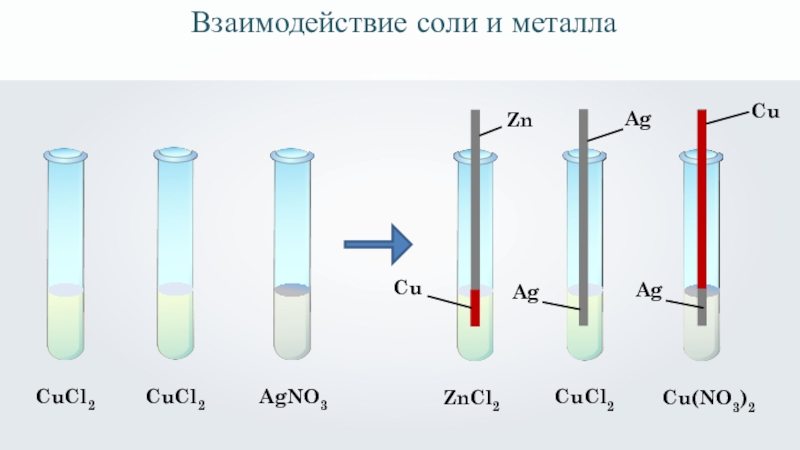
- 14. CuCl2 CuCl2 AgNO3 ZnCl2 ZnCuAgAgCuCl2 CuAgCu(NO3)2Взаимодействие соли и металла
- 15. Взаимодействиехлорида меди CuCl2 (II) с цинком ZnCuCl2 + Zn = ZnCl2 + Cu CuCl2 ZnCl2 ZnCu
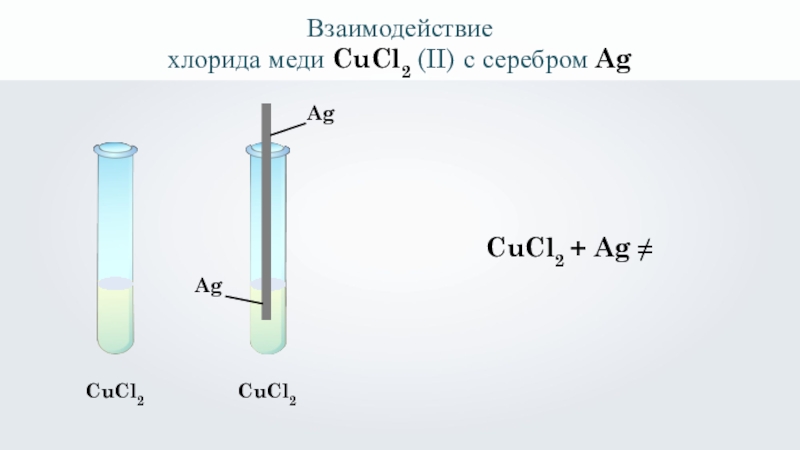
- 16. Взаимодействиехлорида меди CuCl2 (II) с серебром AgCuCl2 AgAgCuCl2 CuCl2 + Ag ≠
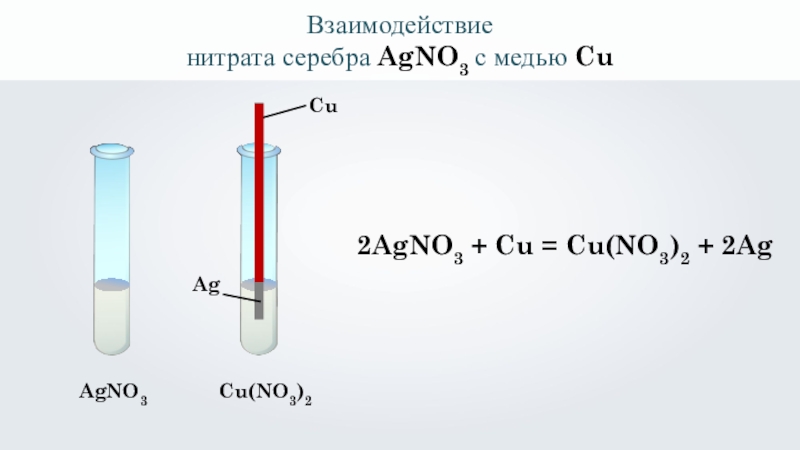
- 17. Взаимодействиенитрата серебра AgNO3 с медью CuAgNO3 CuAgCu(NO3)22AgNO3 + Cu = Cu(NO3)2 + 2Ag
- 18. Вальтер Герман НернстРяд напряжений металлов:K, Ca, Na,
- 19. Электрохимический ряд напряжений металловK → Ca →
- 20. Правила протекания реакцийС растворами кислот взаимодействуют металлы,
- 21. Правила протекания реакцийКаждый металл вытесняет из раствора
- 22. Правила протекания реакций1. Обе соли (реагирующая, образующаяся)
- 23. Соли вступают в химическое взаимодействие с кислотами, щелочами, другими солями и некоторыми металлами.
Слайд 3
Средние соли — соли, состоящие из кислотного остатка и ионов металла.
ионы
кислотный остаток
Слайд 4
Реакции средних солей
1. Взаимодействие соли и кислоты.
2. Взаимодействие соли и
3. Взаимодействие двух солей между собой.
4. Взаимодействие соли и металла.
Слайд 5
Реакция взаимодействия соли и кислоты
соль + кислота → другая соль +
Реакция протекает до конца только в случае образования нерастворимого в воде осадка или газа.
Слайд 6
Реакция взаимодействия соли и кислоты
BaCO3
HNO3
BaCO3 + 2HNO3 = Ba(NO3)2 + CO2↑
CO2
Ba(NO3)2
+
H2O
Слайд 7
Взаимодействие соли и щёлочи
соль + основание → другая соль + другое
Реакция протекает до конца, только если образуется нерастворимый в воде осадок или газ. Относится к реакциям обмена.
Слайд 8
(NH4)2SO4
NaOH
(NH4)2SO4 + 2NaOH = Na2SO4 + 2H2O + 2NH3↑
NH3
Взаимодействие
Na2SO4
+
H2O
Слайд 9соль1 + соль2 → другая соль1 + другая соль2
Взаимодействие двух солей
Реакция протекает только между растворами солей и сопровождается выпадением осадка.
Слайд 11соль + металл → другая соль + другой металл
Взаимодействие соли и
Реакция протекает только при соблюдении определённых условий.
Слайд 12Бекетов
Николай Николаевич
1865 год – изучение реакционной способности одних металлов вытеснять
из солей
Слайд 13
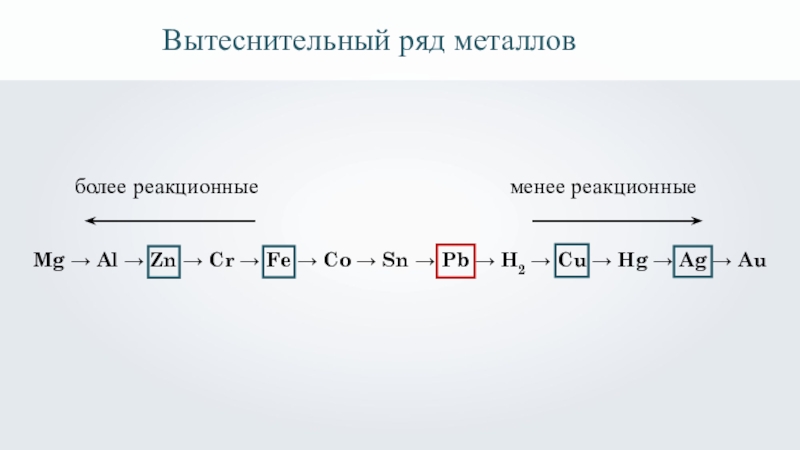
Вытеснительный ряд металлов
Mg → Al → Zn → Cr → Fe
менее реакционные
более реакционные
Слайд 17
Взаимодействие
нитрата серебра AgNO3 с медью Cu
AgNO3
Cu
Ag
Cu(NO3)2
2AgNO3 + Cu = Cu(NO3)2
Слайд 18Вальтер Герман Нернст
Ряд напряжений металлов:
K, Ca, Na, Mg, Al, Zn, Fe,
Вытеснительный ряд металлов:
Mg, Al, Zn, Cr, Fe, Co, Sn, Pb, H2, Cu, Hg, Ag, Au.
Слайд 19
Электрохимический ряд напряжений металлов
K → Ca → Na → Mg →
увеличение восстановительной способности
уменьшение восстановительной способности
Слайд 20
Правила протекания реакций
С растворами кислот взаимодействуют металлы, которые расположены левее водорода
1
Электрохимический ряд напряжений металлов
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Слайд 21
Правила протекания реакций
Каждый металл вытесняет из раствора солей другие металлы, расположенные
2
Электрохимический ряд напряжений металлов
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Слайд 22
Правила протекания реакций
1. Обе соли (реагирующая, образующаяся) в результате реакции должны
2
2. В реакциях вытеснения одних металлов из солей другими не могут участвовать щелочные и щёлочноземельные металлы.
Условия