- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Сутек тақырыбы 8 сыныпқа презентация слайд
Содержание
- 1. Сутек тақырыбы 8 сыныпқа презентация слайд
- 2. Сабақтың тақырыбы: Сутектің алынуы,қолданылуы.Сутектің химиялық, физикалық
- 3. Әр бала- жарық жұлдыз, жарқырауына жәрдемдесу - басты парыз
- 4. Сабақтың мақсаты:“Сутегі, қасиеттері,алынуы, қолданылуы”атты тақырыптасабақ өту барысында
- 5. Оқытудың күтілетін нәтижелері: Сутегі, сутек қосылыстарының қасиеттері туралы білімдері кеңейе және тереңдей түседі;
- 6. Сутегі туралы түсінік Сутегініңфизикалық, химиялық қасиеттері: Сутегінің алынуыСутегінің қолданылуы
- 7. ҮЙ ТАПСЫРМАСЫ БОЙЫНША СҰРАҚ-ЖАУАП
- 8. Сутектің периодтық жүйедегіорныБелсенді металлмен қышқыләрекеттесіпне түзеді?Изатоп дегенімізНе?Жер
- 9. Слайд 9
- 10. Жер бетінде сутек бос
- 11. Тау жыныстарында
- 12. Мұнай құрамындағы метан газында
- 13. Жануарлар мен өсімдіктер организмінде
- 14. Слайд 14
- 15. Сутектің ашылуы ▪1776 жылы ағылшын ғалымы
- 16. Генри Кавендиш
- 17. СутекH11SТабиғатта таралуы
- 18. Сутек атомының құрылысы Сутек
- 19. Сутектің изотоптары
- 20. Сутек атомыВаленттілік мүмкіндіктер: I атомының электрондық конфигурациясы: 1s1
- 21. Сутегі молекуласы Н2 – екі атомды, жәй
- 22. Слайд 22
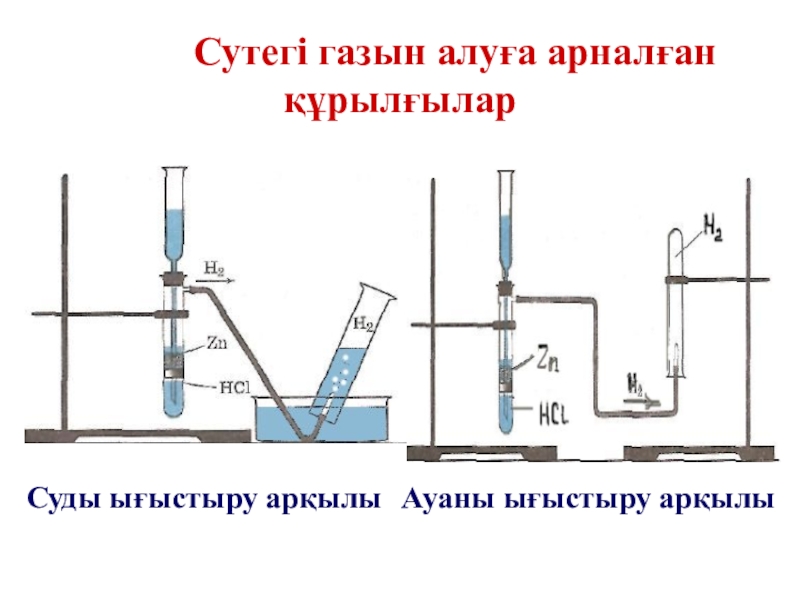
- 23. Сутегі газын алуға арналған құрылғыларСуды ығыстыру арқылыАуаны ығыстыру арқылы
- 24. Слайд 24
- 25. ТӘЖІРИБЕЗертханада сутегін жинаудың екі әдісі. Суды ығыстыру Ауаны ығыстыру
- 26. Сутегінің алынуыЗертханада:Мырыш түйірін тұз қышқылымен әрекеттестіріп:
- 27. Белсенді ме.+қышқыл= =тұз+ сутекБелсенді ме. +су = сілті+ сутек
- 28. Физикалық қасиетіСутегі газ түсі, иісі
- 29. Сутегінің химиялық қасиеттеріЖәй заттармен,металдармен
- 30. Жәй заттармен, бейметалдарменH2 + O2 = 2H2O
- 31. Сутегінің күрделі
- 32. ТәжірибеСутегінің күрделі заттармен әрекеттесуі
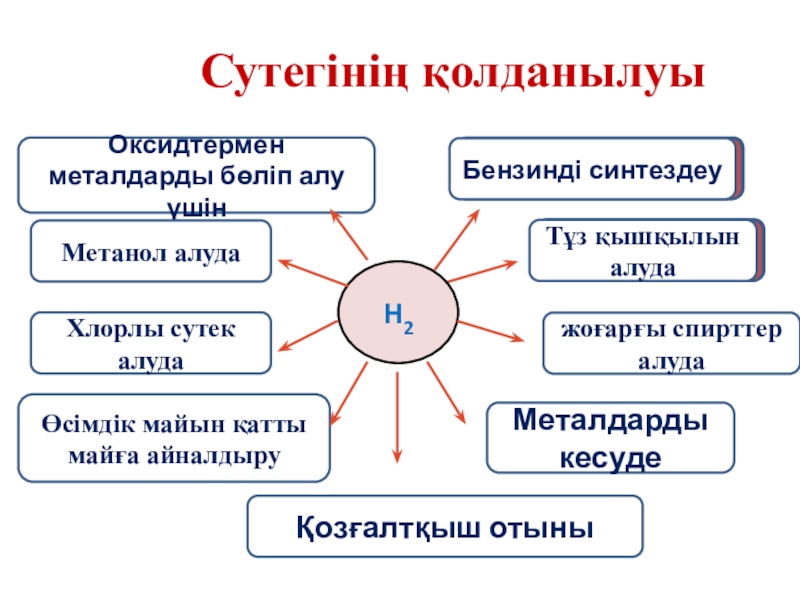
- 33. Сутегінің қолданылуы
- 34. Сутектің маңызды қосылы.
- 35. СУ. ВОДА. WATERСутек пен
- 36. Су дегеніміз– өмір
- 37. Үй тапсырмасы:30,31,32-тақырыптарды оқып келу тапсырма №9Сутек тарауы бойынша тест құрастыру
- 38. Назарларыңызға рахмет!
- 39. Мыс сульфаты суда жақсы еридіҚұм суда ерімейдіБор
- 40. Химиялық қасиеттері
- 41. Сутектің пероксидіСутек пен оттектің тағы бір қосылысы сутектің пероксиді Н2О2.
- 42. Физикалық қасиеттері Сутек пероксиді түссіз қою сұйықтық,
- 43. Химиялық қасиеттеріСутек
- 44. Тәжірибе2H2O2 O2 + 2H2OMnO2
- 45. Слайд 45
- 46. Слайд 46
- 47. Үйге тапсырма:Mr (H2O)=18 Mr (CH4)=16W1(H)=2/18 =1/9
- 48. №2 тапсырмаӨзгерістерді жүзеге асыратын тиісті реакция теңдеулерін
- 49. №3 тапсырмаТазалығы 96% 80г. металдық мырыш 240
- 50. №4 тапсырмаЖергілікті су көздері туралы эссе жазып
- 51. №5 тапсырмаАдам денесі орта есеппен алғанда массасы
- 52. Слайд 52
- 53. Демек, адам денесіндегі ең көбі –
- 54. Өз біліміңді бағала!«5» - 89%-100 %«4» -
- 55. Қолданылған әдебиеттер1. Б.А. Бірімжанов. Жалпы химия, Алматы
- 56. Назарларыңызға рахмет !
Слайд 2 Сабақтың тақырыбы:
Сутектің алынуы,қолданылуы.Сутектің химиялық, физикалық қасиеті.
Өткізілу күні:04.02.2016ж
Өткізілу уақыты: 8.00
Мұғалім:
Слайд 4Сабақтың мақсаты:
“Сутегі, қасиеттері,алынуы, қолданылуы”атты тақырыптасабақ өту барысында оқушылардың жалпы түсінігін қалыптастыру,оқу
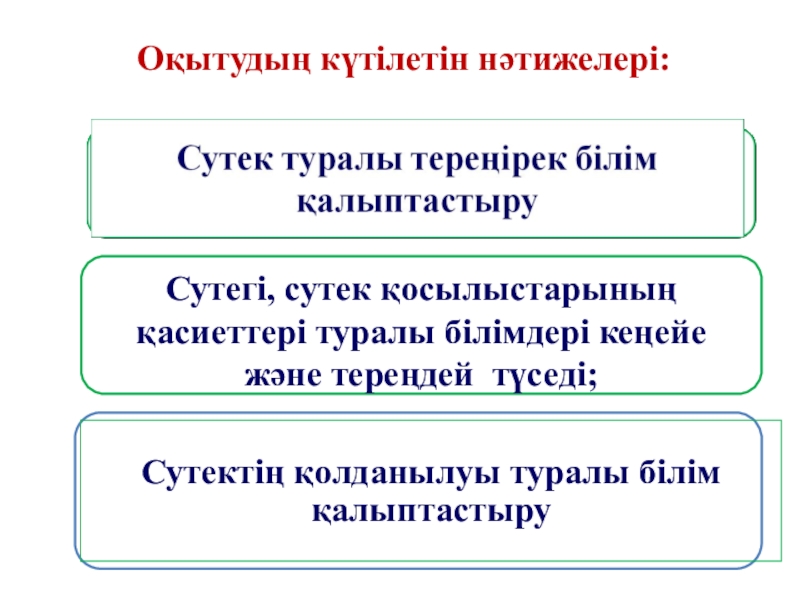
Слайд 5Оқытудың күтілетін нәтижелері:
Сутегі, сутек қосылыстарының қасиеттері туралы білімдері кеңейе және
Слайд 6
Сутегі туралы түсінік
Сутегінің
физикалық,
Сутегінің алынуы
Сутегінің қолданылуы
Слайд 8Сутектің период
тық жүйедегі
орны
Белсенді металл
мен қышқыл
әрекеттесіп
не түзеді?
Изатоп дегеніміз
Не?
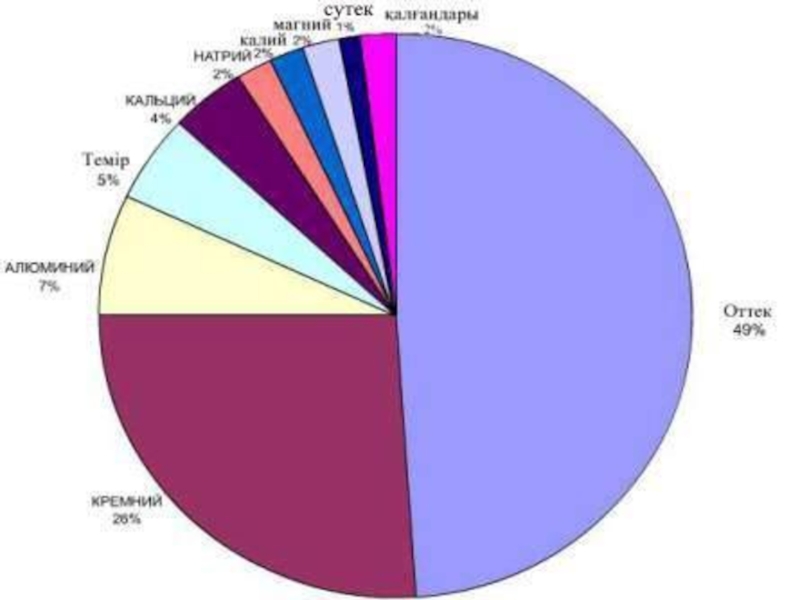
Жер қыртысында
ең көп
тараған
элемент
Сутектің изатоп
-тарын ата
Сутекті
алғаш алған
ғалым кім?
Сутекке” Гид-
рогениум” деп
ат берген
ғалым кім?
“Гидрогениум”
атынша
андай
ағына береді
Периодтық
жүйедегі
сілтілік
металдар
Көп тараған
сутектің
маңызды
қосылысы
Сутектің салыс
тырмалы атом
дық массасы
Сутектің
молекулалық
массасы
12
11
10
9
8
7
6
5
2
4
3
1
Слайд 10 Жер бетінде сутек бос күйінде кездеспейді, көп тараған қосылысы-су. Судағы сутектің
Слайд 14
ағылшын химигі 1766 жылы Генри Кавендиш шешті. Бұл газ жанғанда су түзілетін болғандықтан бертін келе оны “гидрогениум” (гректің “һюдор” - су, “генан” - туғызамын деген сөздерінен сутек деп атаған.
Слайд 15
Сутектің ашылуы
▪1776 жылы ағылшын ғалымы Г.Кавендиш сутектің қасиетін анықтап,басқа
▪Француз ғалымы А. Лавуазье сутекті алғаш судың құрамынан бөліп алды және судың құрамы сутек пен оттектен тұратындығын дәлелдеді. Ол сутектің жай зат екенін анықтап, оған “гидрогениум” деп ат берген. Латынша бұл “су тудырушы” дегенді білдіреді.
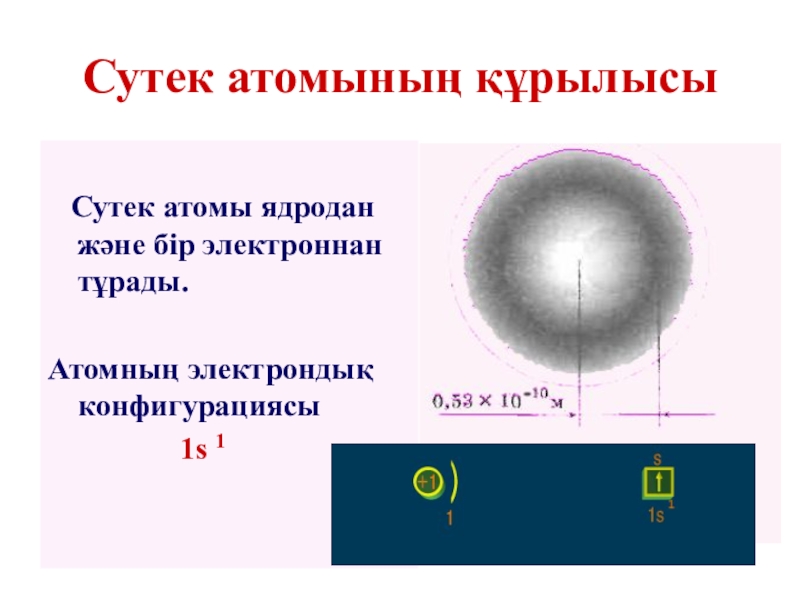
Слайд 18Сутек атомының құрылысы
Сутек атомы ядродан және
Атомның электрондық конфигурациясы
1s 1
Слайд 19Сутектің изотоптары
Изотоп – ядродағы атомдардың
1. протон саны бірдей
(сондықтан ядро заряды бірдей);
2. нейтрон саны әртүрлі
(сондықтан Аr әртүрлі)
Н(1Н)– протий; D(2Н)– дейтерий ;T(3Н)– тритий
Н ( 1р+ + 0n0 ) + 1e- Аr H=1
nD ( 1р+ + 1n0 ) + 1e- Аr D=2
T ( 1р+ + 2n0 ) + 1e- Аr T=3
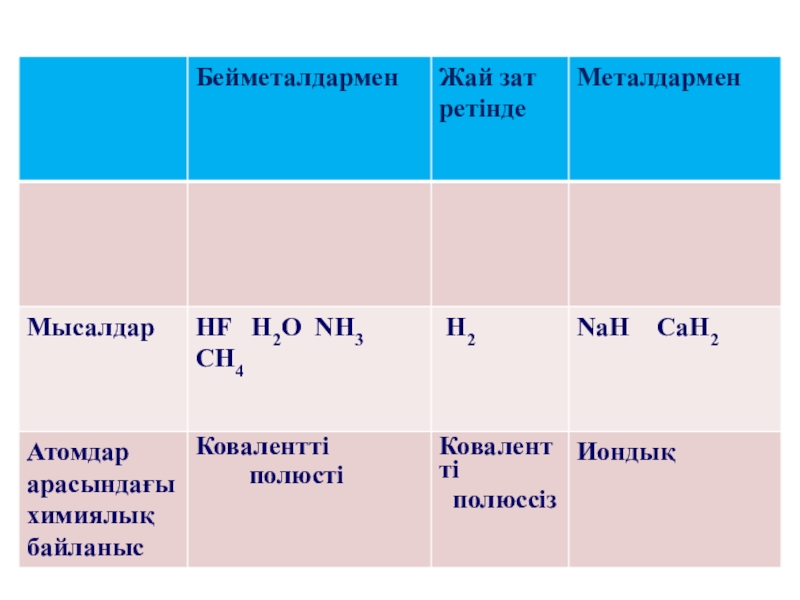
Слайд 21Сутегі молекуласы
Н2 – екі атомды, жәй зат
химиялық байланыс түрі:
ковалентті полюссіз H – H
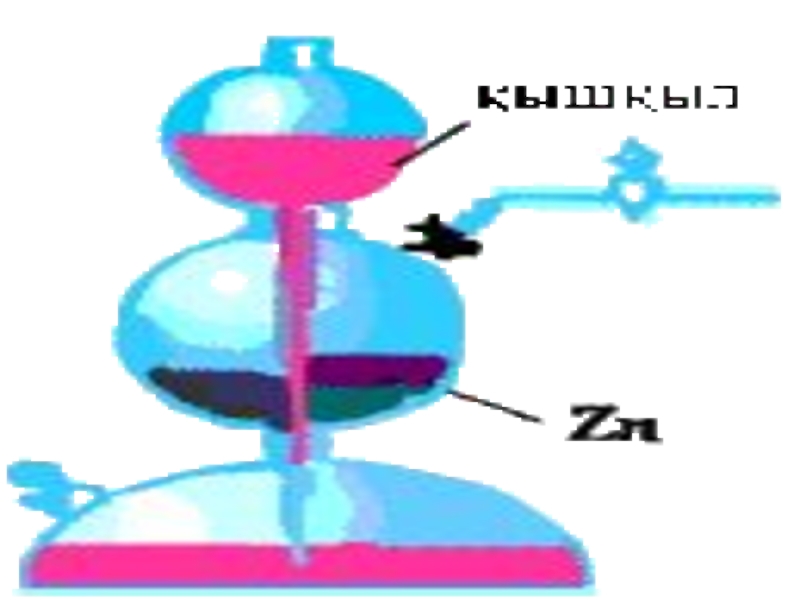
Слайд 26Сутегінің алынуы
Зертханада:
Мырыш түйірін тұз қышқылымен әрекеттестіріп:
Zn+2HCl=ZnCl2+
мырыш хлориді
Калийді сумен әрекеттестіріп:
2К+2H2O=2KOH+H2
калии гидроксиді
өндірісте:
Электр тоғының әсерімен суды айыру: 2H2O=2H2+O2
Слайд 28Физикалық қасиеті
Сутегі газ түсі, иісі және дәмі жоқ.
Өте жеңіл
Слайд 29
Сутегінің химиялық қасиеттері
Жәй заттармен,металдармен
2Na+H2=2NaH натрий гидриді
алюминий гидриді
Реакция нәтижесінде гидридтер түзіледі.
Слайд 30
Жәй заттармен, бейметалдармен
H2 + O2 = 2H2O +572 kДж
H2 +Cl2 =2HCl
C
H2 +S = H2S
Реакция нәтижесінде газдар түзіледі.
Слайд 31 Сутегінің күрделі заттармен әрекеттесуі
(II) мыс оксидін
CuО +H2 =H2O +Cu
Слайд 35 СУ. ВОДА. WATER
Сутек пен оттек қосылыстарының ең маңыздысы
Слайд 37
Үй тапсырмасы:
30,31,32-тақырыптарды оқып
келу
тапсырма №9
Сутек тарауы бойынша
тест құрастыру
Слайд 39Мыс сульфаты
суда жақсы ериді
Құм суда
ерімейді
Бор қышқылы
суда аз ериді
Су – әмбебап еріткіш, ионды қосылыстар мен
полюсті молекуладан құралған заттарды
жақсы ерітеді
Слайд 40 Химиялық қасиеттері
Су көптеген химиялық реакцияларда
А) белсенді металдармен (Na,K,Ca,Ba)
2H2O + 2Na =2NaOH + H2
Г) Әлсіз негізбен әлсіз қышқылдан құралған тұздармен гидролиз реакциясына түседі
AI2S3 + 6H2O = 2AI(OH)3 +3H2S
B) Бейметалдармен (CI2, Br2,I2)
H2O +CI2 =HCI + HCIO
Слайд 42Физикалық қасиеттері
Сутек пероксиді түссіз қою сұйықтық,
tбал= - 41оС,
Сусыз пероксид өте қопарылғыш келеді. 30%-дық ерітіндісі пергидроль деп аталады.
Слайд 43 Химиялық қасиеттері
Сутек пероксидінің судағы ерітіндісінің ортасы
H2O2↔H+ + HO2- (Кдисс.=1,5∙10-12).
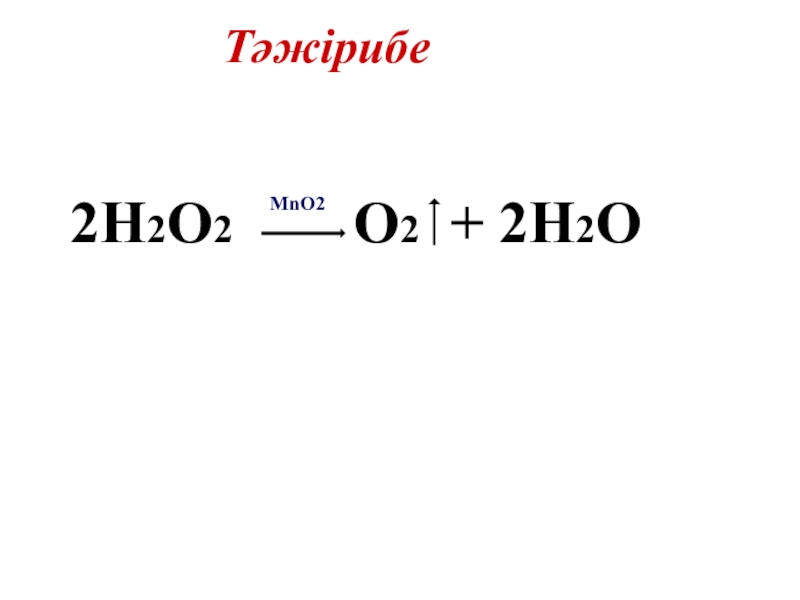
Жарық жерде сақтағанда, қыздырғанда немесе катализатордың әсерінен сутек пероксиді оңай ыдырайды:
MnO2
2H2O2 → O2↑ + 2H2O
Оттегін бөлетін болғандықтан, пероксид залалсыздандырғыш және ағартқыш зат ретінде қолданылады.
Слайд 45 Сутек пероксидінде оттектің
-1 +3 +5 -2
H2O2 + KNO2=KNO3 + H2O
тотықсыздандырғыштық та қасиет көрсетеді:
-1 +7
5H2O2 + 2KMnO4+3H2SO4=
+2 0
=2MnSO4 +5O2 + K2SO4 +8H2O
Слайд 47Үйге тапсырма:
Mr (H2O)=18 Mr (CH4)=16
W1(H)=2/18 =1/9 = 0.111 (11.1)
W2(H)= 4/16=
Жауабы:СН4>Н2О
Берілген қосылыстың қайсысында сутектің массалық үлесі жоғары
H2O немесе CH4
Берілген қосылыстың қайсысында сутектің массалық үлесі жоғары
H2O немесе CH4
Слайд 48№2 тапсырма
Өзгерістерді жүзеге асыратын тиісті реакция теңдеулерін жазып, жүру жағдайын көрсетіп,
H2O2 O2 H2O H2
Слайд 49№3 тапсырма
Тазалығы 96% 80г. металдық мырыш 240 мл. 35% -дық тығыздығы
Слайд 50№4 тапсырма
Жергілікті су көздері туралы эссе жазып келу:
1. Бұқтырма өзені және
2. Марқакөл , Алакөл, Зайсан көлдері су көздерін қорғау жайында;
3.Ертіс өзенінің болашағы.
Слайд 51№5 тапсырма
Адам денесі орта есеппен алғанда массасы бойынша 65% оттектен, 18%
Слайд 52 Шешуі:
Кез келген заттың
Яғни: m(O)=65 г; m(С)= 18 г; m(H)=10 г.
Енді олардың атомдарының молярлық массасына сүйене отырып, әрқайсысының зат мөлшерін табайық:
Слайд 53 Демек, адам денесіндегі ең көбі – сутек атомдары, одан кейін сан
Слайд 55Қолданылған әдебиеттер
1. Б.А. Бірімжанов. Жалпы химия, Алматы 2001
2. Интернет желісі.
3.
4.Н.Е Кузменко,В.В Еремин,В.А Папков «Начало химии» Пособие для учителей. М.: Экзамен, 2010, 324 с.
5. Бердоносов С.С., Бердоносов П.С. Справочник по общей химии. М.: АСТ, Астрель, 2002, 285 с.
6. “Химия пособие репетитор” изд.“ Ростов –на- Дону “Феникс” 1997 г.
7. Большой справочник “Химия” для школьников и поступающих в вузы” изд. Москва “Дрофа” 2000г.