- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Современное представление о строении атома, S- и P- орбитали.
Содержание
- 1. Современное представление о строении атома, S- и P- орбитали.
- 2. Но значительные трудности возникали в определении валентности углерода.
- 3. В соединенияx метана, этана, пропана, которые входят
- 4. Согласно с современными электронными представлениями, все особенности органических соединений определяются свойствами элемента углерода.
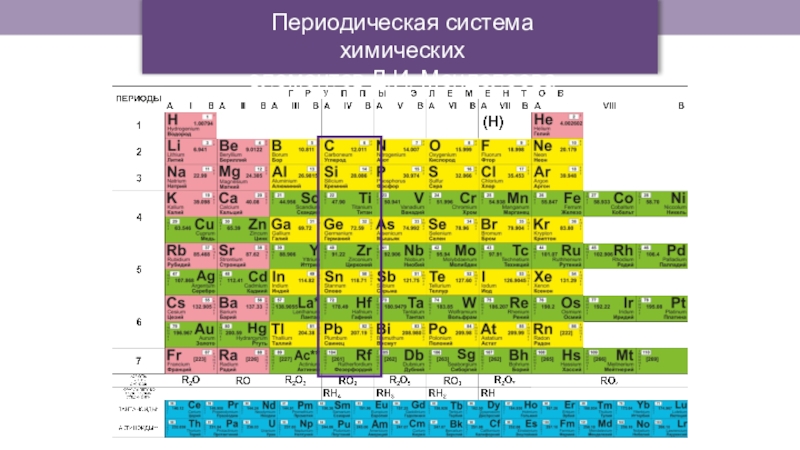
- 5. Периодическая система химических элементов Д.И. Менделеева
- 6. Периодическая система химических элементов Д.И. Менделеева
- 7. Углерод1S22S22P2В свободном состоянии1S22S12P3В возбуждённом состоянииE2S1S2PE2S1S2P
- 8. Структуру внешнего электронного слоя можно выразить следующим
- 9. Ковалентная связь (от латинского «со» — совместно
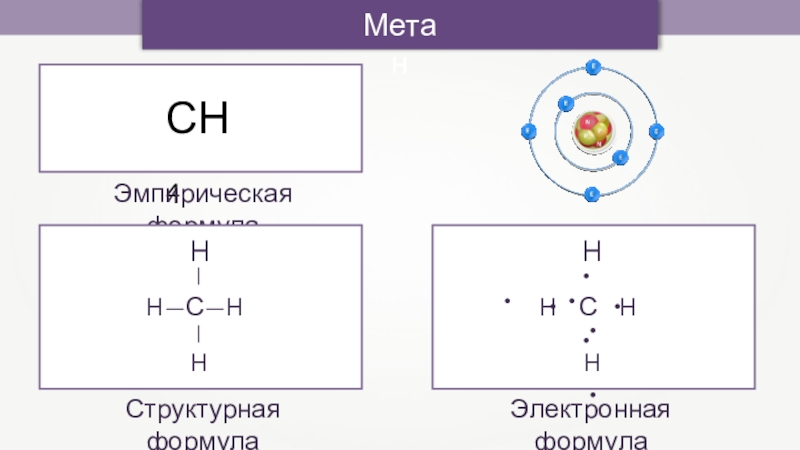
- 10. СН4МетанЭмпирическая формулаСтруктурная формулаЭлектронная формула
- 11. Структурные формулы считаются языком органической химии.
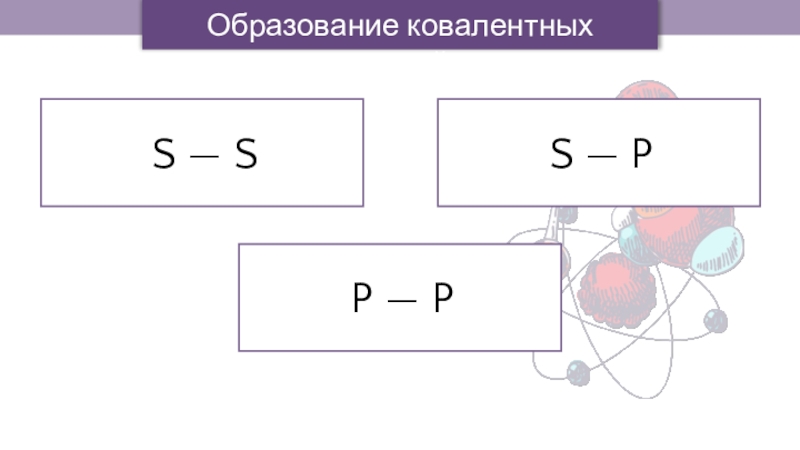
- 12. S — SS — PP — PОбразование ковалентных связей
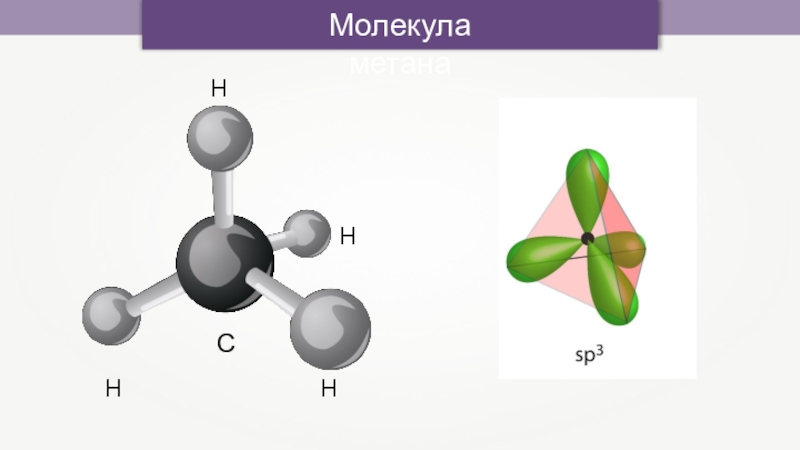
- 13. СHHHHМолекула метана
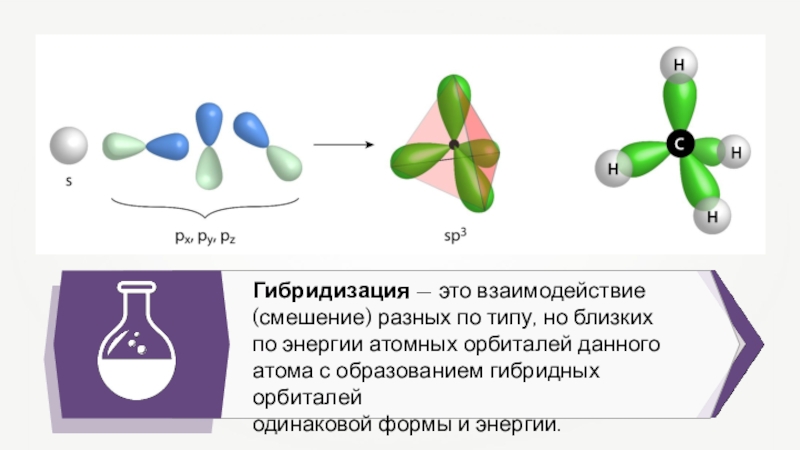
- 14. Гибридизация — это взаимодействие (смешение) разных по
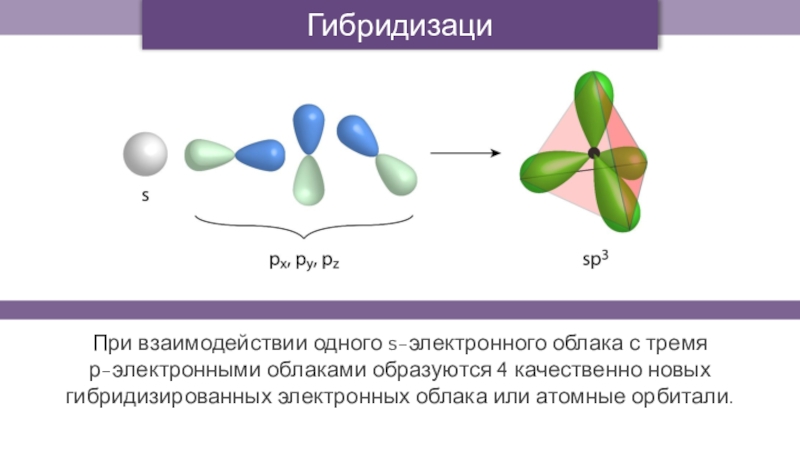
- 15. ГибридизацияПри взаимодействии одного s-электронного облака с тремя
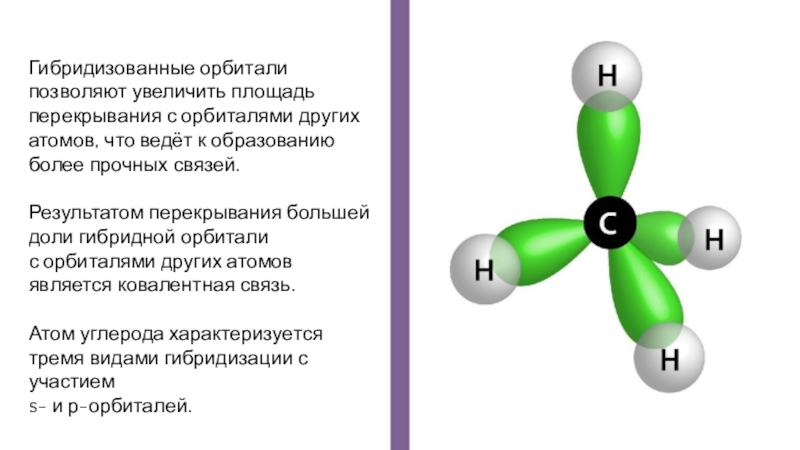
- 16. Гибридизованные орбитали позволяют увеличить площадь перекрывания с
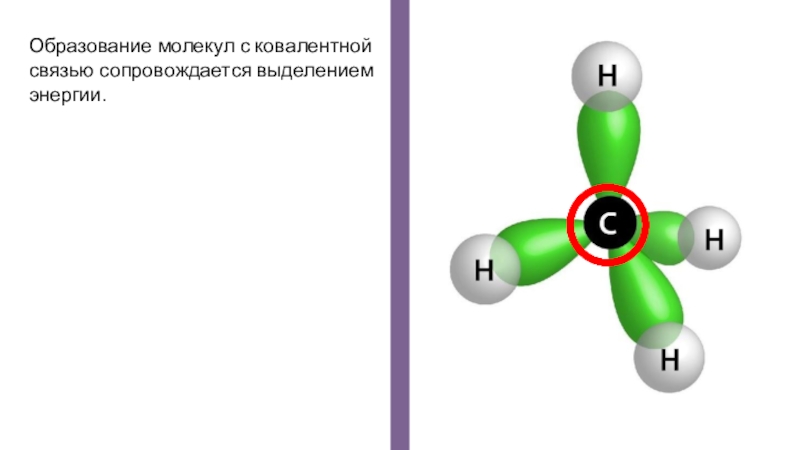
- 17. Образование молекул с ковалентной связью сопровождается выделением энергии.
- 18. Энергия связи указывает на его прочность и измеряется в килоджоулях на 1 моль.кДж/моль
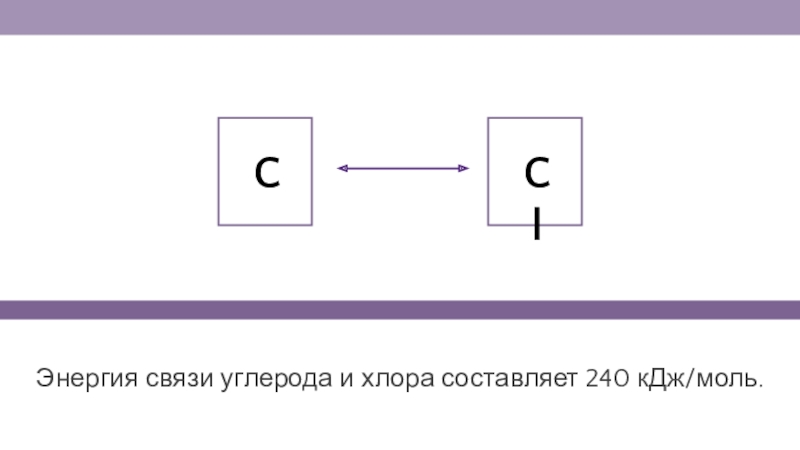
- 19. Энергия связи углерода и хлора составляет 240 кДж/моль.CCl
- 20. Валентность углерода — 4Углерод образует 4 связикДж/мольЭнергия измеряется в килоджоуляхПравила органической химии
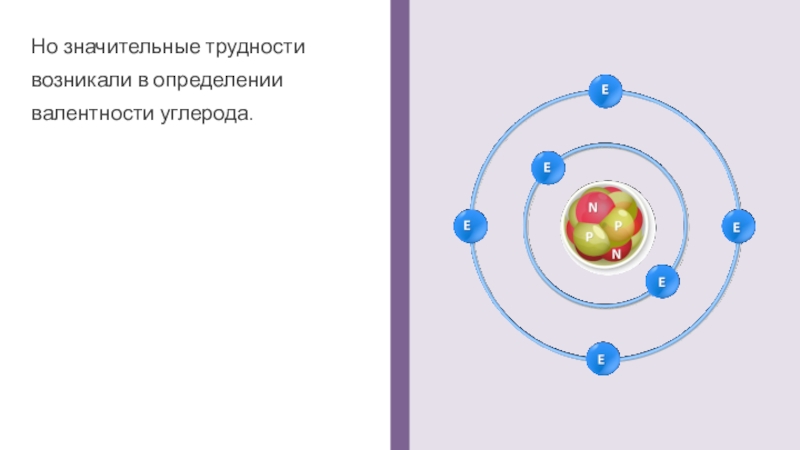
Но значительные трудности возникали в определении валентности углерода.
Слайд 1К середине XIX века было уже достаточно накоплено экспериментального материала
по
органической химии: получено много соединений, изучен их состав, прослежены закономерности протекания отдельных химических реакций.
Слайд 3
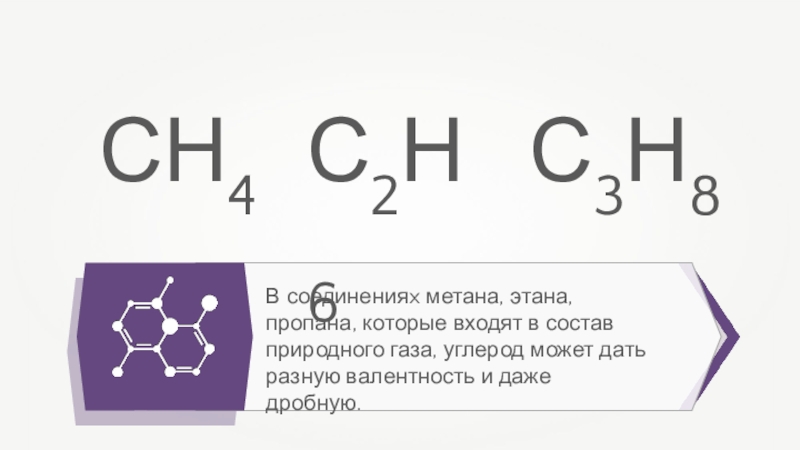
В соединенияx метана, этана, пропана, которые входят в состав природного газа,
углерод может дать разную валентность и даже дробную.
СН4
С2Н6
С3Н8
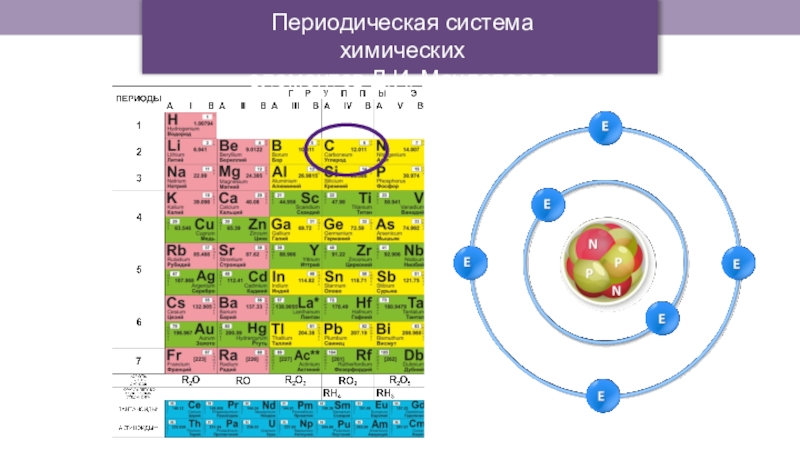
Слайд 4Согласно с современными электронными представлениями,
все особенности органических соединений определяются свойствами
элемента углерода.
Слайд 8
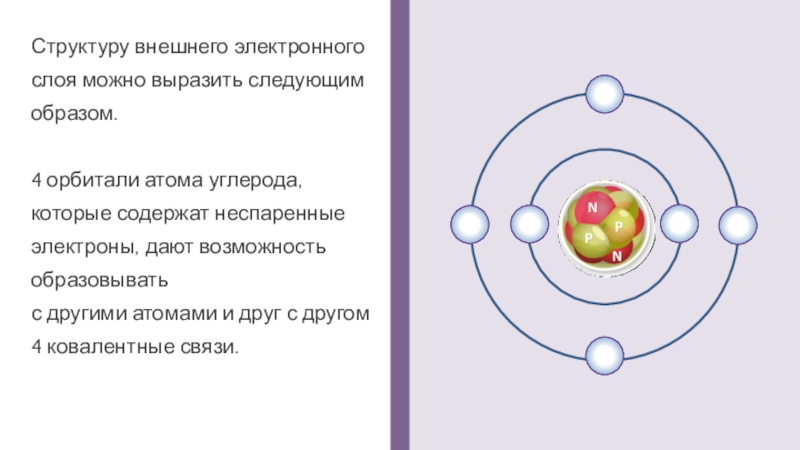
Структуру внешнего электронного слоя можно выразить следующим образом.
4 орбитали атома углерода,
которые содержат неспаренные электроны, дают возможность образовывать
с другими атомами и друг с другом
4 ковалентные связи.
с другими атомами и друг с другом
4 ковалентные связи.
Слайд 9
Ковалентная связь (от латинского «со» — совместно и «vales» — имеющий
силу) осуществляется за счёт электронной пары, принадлежащей обоим атомам.
Слайд 14
Гибридизация — это взаимодействие (смешение) разных по типу, но близких
по
энергии атомных орбиталей данного атома с образованием гибридных орбиталей
одинаковой формы и энергии.
одинаковой формы и энергии.
Слайд 15
Гибридизация
При взаимодействии одного s-электронного облака с тремя
р-электронными облаками образуются 4
качественно новых гибридизированных электронных облака или атомные орбитали.
Слайд 16Гибридизованные орбитали
позволяют увеличить площадь перекрывания с орбиталями других атомов, что
ведёт к образованию более прочных связей.
Результатом перекрывания большей доли гибридной орбитали
с орбиталями других атомов является ковалентная связь.
Атом углерода характеризуется тремя видами гибридизации с участием
s- и р-орбиталей.
Результатом перекрывания большей доли гибридной орбитали
с орбиталями других атомов является ковалентная связь.
Атом углерода характеризуется тремя видами гибридизации с участием
s- и р-орбиталей.
Слайд 20
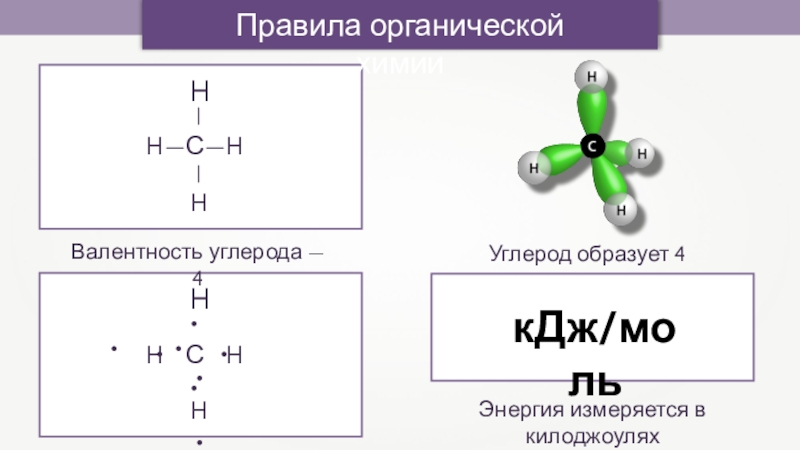
Валентность углерода — 4
Углерод образует 4 связи
кДж/моль
Энергия измеряется в килоджоулях
Правила органической
химии