- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Щелочные и щелочноземельные металлы
Содержание
- 1. Щелочные и щелочноземельные металлы
- 2. Металлы Сu, Au, Ag не взаимодействуют с
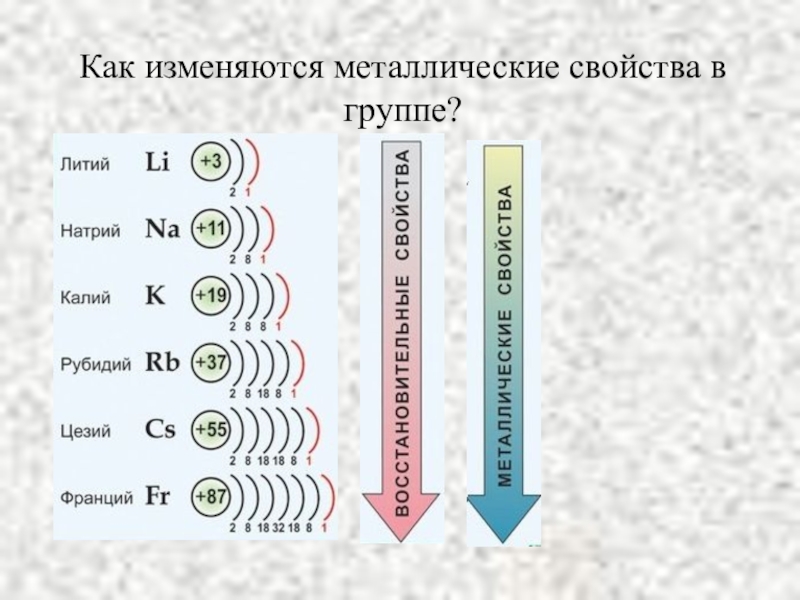
- 3. Как изменяются металлические свойства в группе?
- 4. Радиусы атомов элементов 1А группы
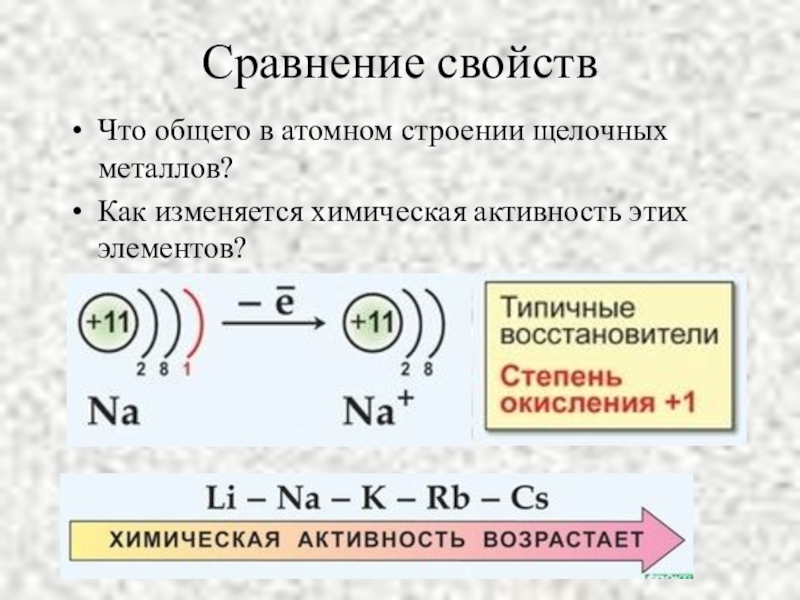
- 5. Сравнение свойствЧто общего в атомном строении щелочных металлов?Как изменяется химическая активность этих элементов?
- 6. Физические свойстваВсе металлы этой подгруппы имеют серебристо-белый цвет (кроме
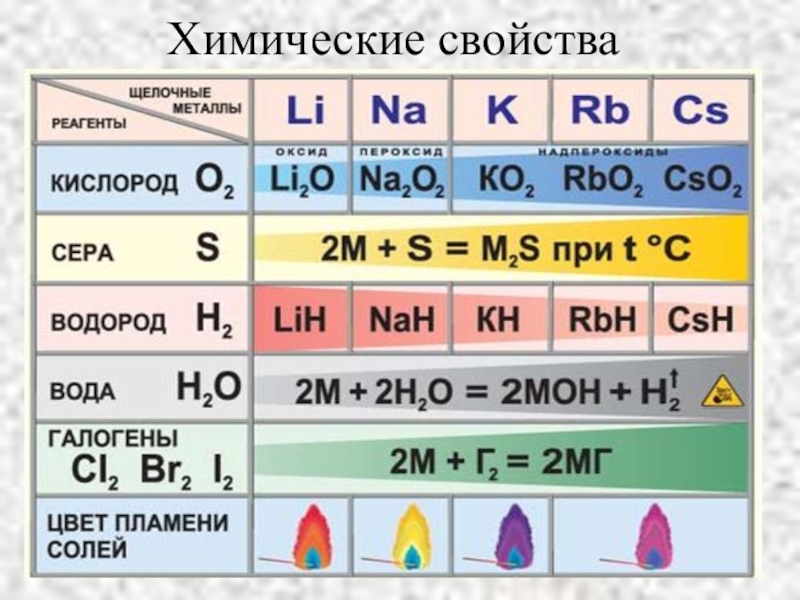
- 7. Химические свойства
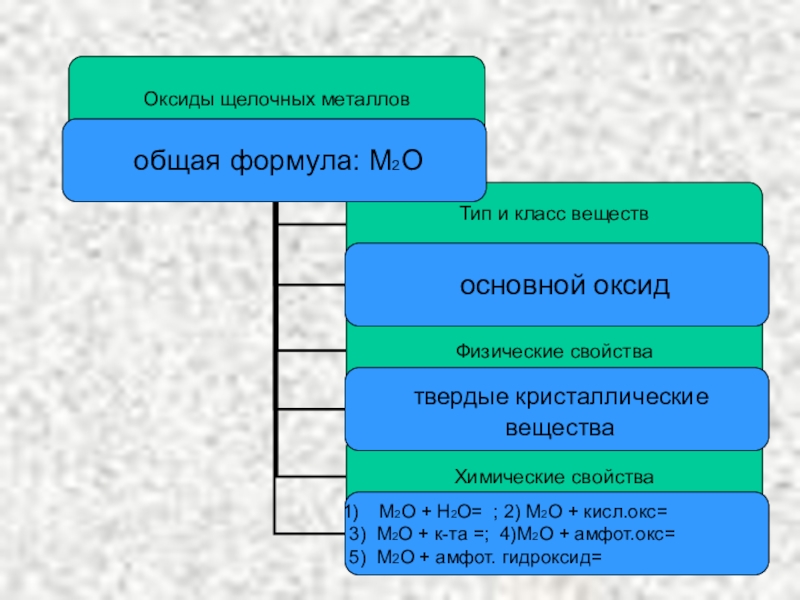
- 8. Оксид литияОксид натрияОксиды щелочных металлов (основные оксиды)
- 9. Слайд 9
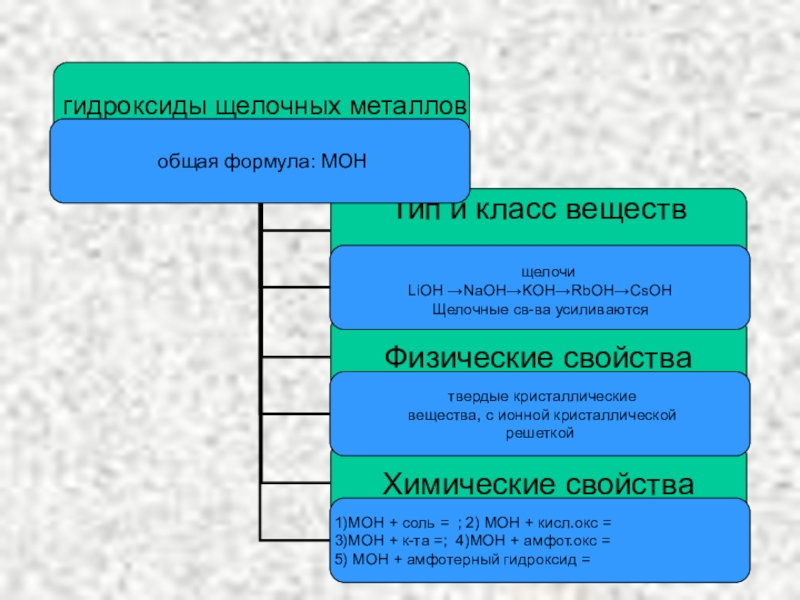
- 10. KOH – гидроксид калия (едкое кали)NaOH – гидроксид натрия (едкое натр)LiOH – гидроксид литияГидроксиды щелочных металлов
- 11. Слайд 11
- 12. Нахождение в природеВстречаются ли щелочные металлы в природе в свободном состоянии?
- 13. Слайд 13
- 14. Поваренная соль в организме человека Соль
- 15. Применение поваренной солиПроизводство химических веществ ---
- 16. Карбонат калия - поташКалийная селитрасоли щелочных металлов
- 17. Карбонат натрия NaCO3 используется в стекольном производстве,
- 18. Характеристика щелочноземельных металлов
- 19. Положение в периодической таблице. Строение атомаВ
- 20. Физические свойстваRa – радиоактивный элемент, содержание его
- 21. Ca – серебристый, твердый металл. В земной
- 22. Be и Mg покрыты защитной пленкой и
- 23. Физические свойства цвет пламени
- 24. Химические свойства2Me0 +O2 → 2Me+2O-2
- 25. Свойства оксидов щелочноземельных металловВзаимодействие с водой.BaO +
- 26. Соли щелочноземльных металлов
- 27. BaSO4 – сульфат бария Благодаря
- 28. Ca3(PO4)2 – ортофосфат кальция
- 29. CaCO3 – карбонат кальцияКарбонат кальция – одно
- 30. CaSO4∙ 2H2O - гипс Встречается
- 31. MgCO3 - карбонат магния Широко применяется
- 32. Са(ОН)2 – гидроксид кальция Гидроксид
- 33. Жесткость воды и способы ее устранения
- 34. Жесткость воды.Жёсткость воды —свойство воды, обусловленное наличием в
- 35. Виды жесткости.ЖесткостьВременная жесткостьПостоянная жесткостьCa(HCO3)2
- 36. Способы устранения жесткости.Бытовые:КипячениеФильтрованиеДобавление умягчителейПромышленные:Добавлением кальценированной соды Na2CO3Добавлением гашеной извести Са (ОН)2
- 37. КипячениеКипячение снижает общую жесткость на 30-40%. При
- 38. Устранение временной жесткостиДобавление гашеной извести Ca(OH)2 Ca(HCO3)2
- 39. Домашнее задание§ 76, вопросы устно§ 77, упр.
Слайд 2Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании.
Металлы
Для металлов характерна металлическая кристаллическая решетка.
У атомов металлов на внешнем уровне 1-3 электрона.
У атомов металлов на внешнем уровне 1-3 электрона.
Металлы являются восстановителями и окислителями.
Для металлов характерна металлическая кристаллическая решетка.
Металлы обладают электропроводностью и теплопроводностью.
При взаимодействии с кислородом металлы принимают электроны.
Все металлы активно взаимодействуют с кислотами.
Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании.
Уберите лишнее
Слайд 5Сравнение свойств
Что общего в атомном строении щелочных металлов?
Как изменяется химическая активность
Слайд 6Физические свойства
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие,
Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Слайд 10KOH – гидроксид калия (едкое кали)
NaOH – гидроксид натрия (едкое натр)
LiOH
Гидроксиды щелочных металлов
Слайд 14Поваренная соль в организме человека
Соль – обязательная составная часть
Слайд 15Применение поваренной соли
Производство химических веществ
--- соляной кислоты
---
--- хлора
--- соды
Для консервирования
Приправа к пище
Производство мыла
Слайд 17Карбонат натрия NaCO3 используется в стекольном производстве, мыловарении, в производстве стиральных
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода (E-500), пищевая сода, бикарбонат натрия, натрий двууглекислый) — кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета.
Слайд 19Положение в периодической таблице.
Строение атома
В периодической системе находятся в главной
Являются сильными восстановителями, отдают 2 ē, во всех
соединениях проявляют степень окисления +2.
Be
Mg
Ca
Sr
Ba
Ra
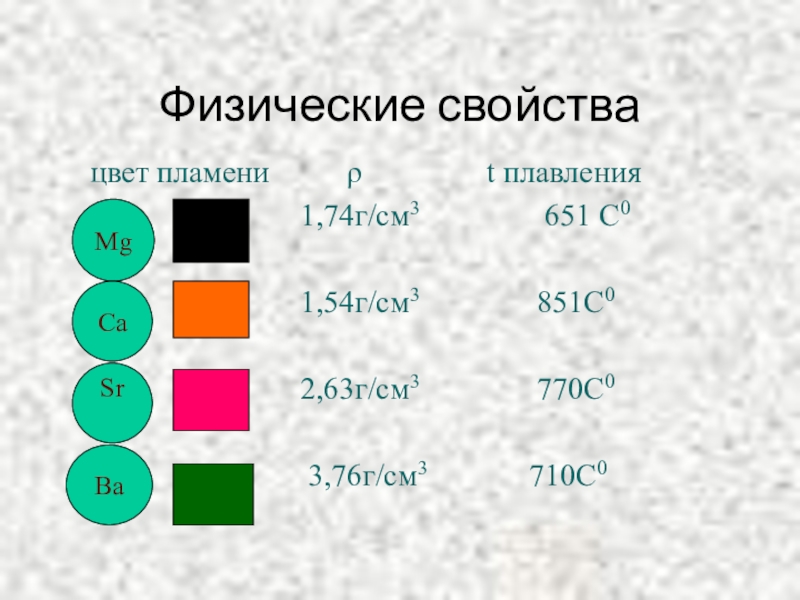
Слайд 20Физические свойства
Ra – радиоактивный элемент, содержание его в природе невелико.
Все металлы
Слайд 21Ca – серебристый, твердый металл. В земной коре 35 % Ca,
Ba по мягкости напоминает Pb (свинец).
Слайд 22Be и Mg покрыты защитной пленкой и хранятся на воздухе. Остальные
Слайд 23Физические свойства
цвет пламени
1,74г/см3 651 С0
1,54г/см3 851С0
2,63г/см3 770С0
3,76г/см3 710С0
Mg
Ca
Sr
Ba
Слайд 24Химические свойства
2Me0 +O2 → 2Me+2O-2 (оксиды)
Me0
Me0 +Cl02 → Me+2Cl2 (галогениды)
Me0 +S0 → Me+2S-2 (сульфиды)
Me0 +2HCl → Me+2Cl2 + H2 (соли)
Me0 +2H2О → Me+2(OH)2 +Н2 (гидроксиды)
Слайд 25Свойства оксидов щелочноземельных металлов
Взаимодействие с водой.
BaO + H2O = Ba(OH)2
Взаимодействие с
BaO + 2HCl = BaCl2 + H2O
Взаимодействие с кислотными оксидами.
BaO + CO2 = BaCO3
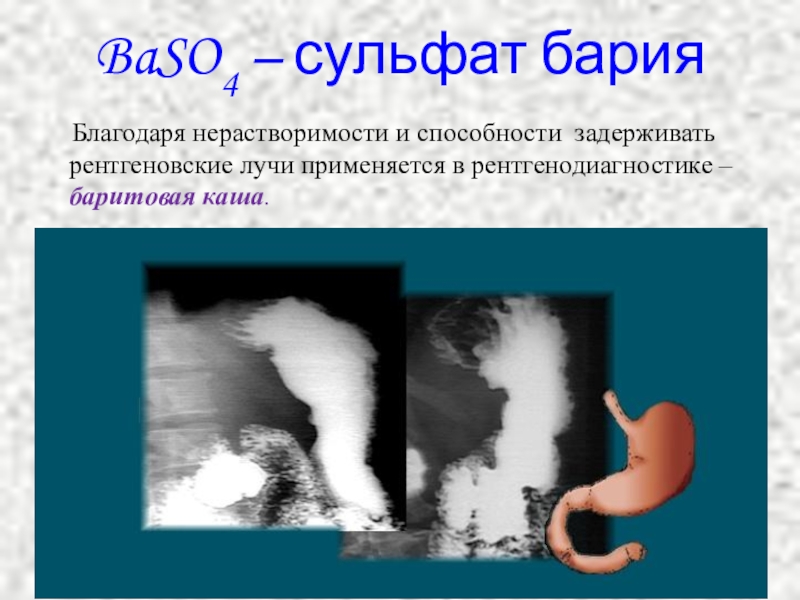
Слайд 27BaSO4 – сульфат бария
Благодаря нерастворимости и способности задерживать
Слайд 28Ca3(PO4)2 – ортофосфат кальция
Входит в состав
Слайд 29CaCO3 – карбонат кальция
Карбонат кальция – одно из самых распространённых на
Слайд 30CaSO4∙ 2H2O - гипс
Встречается в природе в
Слайд 31MgCO3 - карбонат магния
Широко применяется в производстве стекла, цемента,
Слайд 32Са(ОН)2 – гидроксид кальция
Гидроксид кальция или гашёная известь
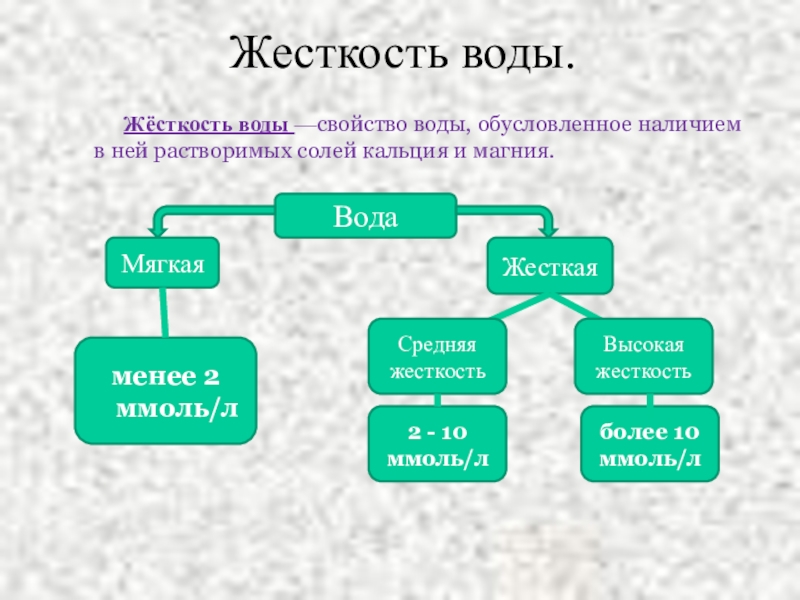
Слайд 34Жесткость воды.
Жёсткость воды —свойство воды, обусловленное наличием в ней растворимых солей кальция
Вода
Мягкая
Жесткая
менее 2 ммоль/л
Средняя жесткость
Высокая жесткость
2 - 10 ммоль/л
более 10 ммоль/л
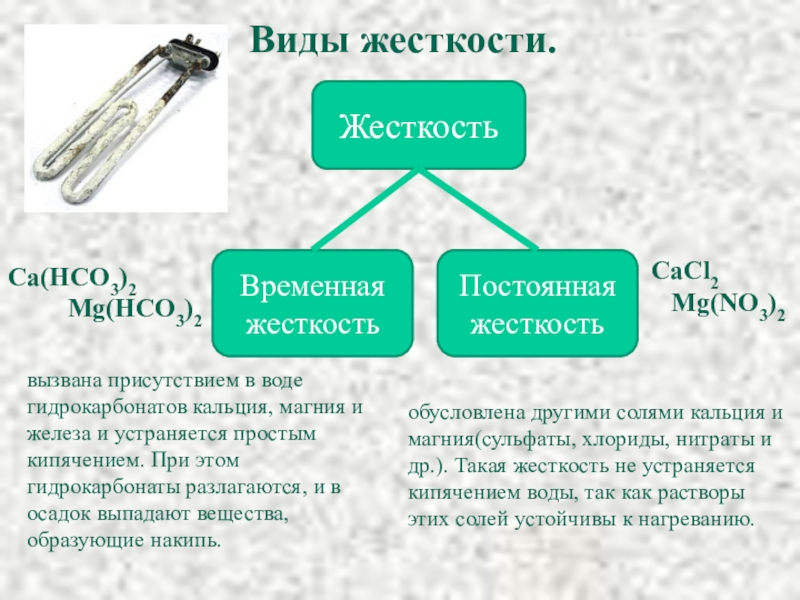
Слайд 35Виды жесткости.
Жесткость
Временная жесткость
Постоянная жесткость
Ca(HCO3)2
Mg(HCO3)2
вызвана присутствием в
обусловлена другими солями кальция и магния(сульфаты, хлориды, нитраты и др.). Такая жесткость не устраняется кипячением воды, так как растворы этих солей устойчивы к нагреванию.
CaCl2
Mg(NO3)2
Слайд 36Способы устранения жесткости.
Бытовые:
Кипячение
Фильтрование
Добавление умягчителей
Промышленные:
Добавлением кальценированной соды Na2CO3
Добавлением гашеной извести Са (ОН)2
Слайд 37Кипячение
Кипячение снижает общую жесткость на 30-40%. При нагревании жесткой воды образуется
Фильтрование.
Фильтрование снижает общую жесткость до 80%.Внутри картриджа фильтра содержится смесь из активированного угля и катионообменники. Уголь адсорбирует вредные органические вещества и хлориды. Катионообменники снижают общую жесткость.
Ca(HCO3)2 = CO2 ↑ + CaCO3↓ + H2O
Mg(HCO3)2 = Mg(OH)2↓ + CO2 ↑
Слайд 38Устранение временной жесткости
Добавление гашеной извести Ca(OH)2
Ca(HCO3)2 + Ca(OH)2 =2CaCO3+2H2O
Mg(HCO3)2 +
Устранение постоянной жесткости.
Добавление соды Na2CO3
Ca(NO3) 2 + Na2CO3 = CaCO3↓ + 2NaNO3
2MgSO4+H2O + Na2CO3 = Mg(OH)2CO3↓+ CO2+2Na2SO4
Слайд 39Домашнее задание
§ 76, вопросы устно
§ 77, упр. 3
§ 78, упр. 1
§
§ 80, вопросы устно
§ 82, 83, 84 составить конспект