- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Серная кислота (9 класс)
Содержание
- 1. Презентация по химии на тему Серная кислота (9 класс)
- 2. Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая
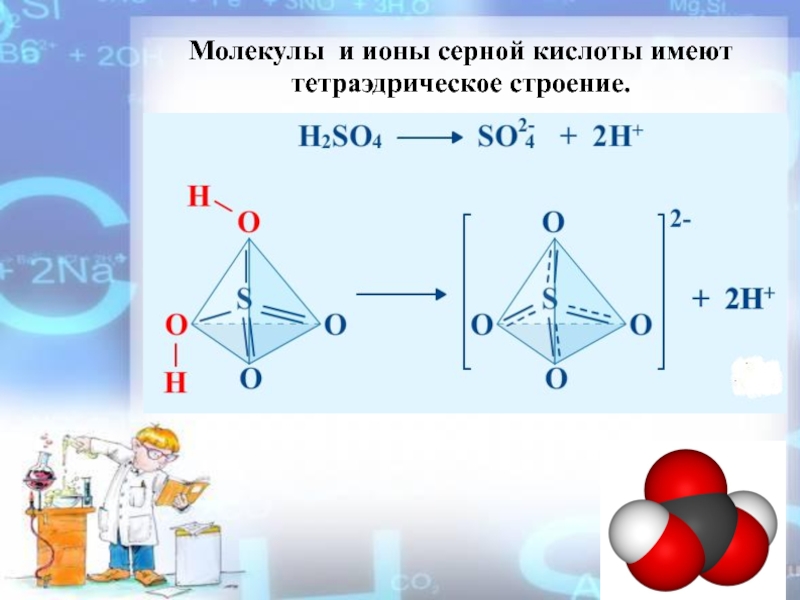
- 3. Молекулы и ионы серной кислоты имеют тетраэдрическое строение.
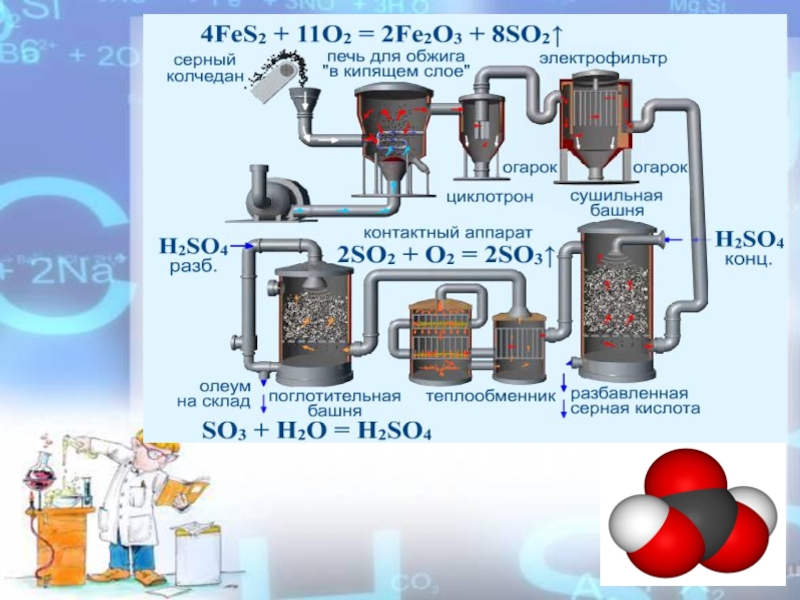
- 4. FeS2SH2SSO2 → SO3 → H2SO4 ПиритСерный колчедан Получение серной кислоты
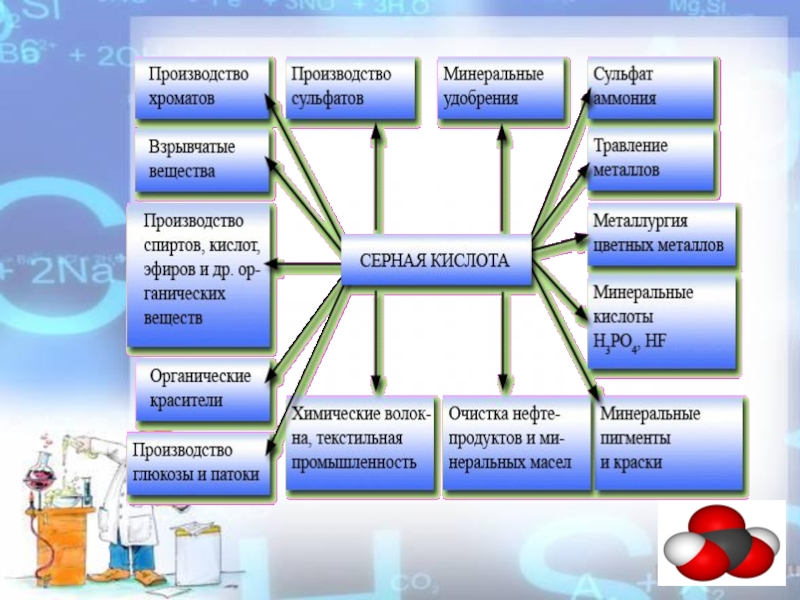
- 5. Слайд 5
- 6. Общие свойства растворов кислот
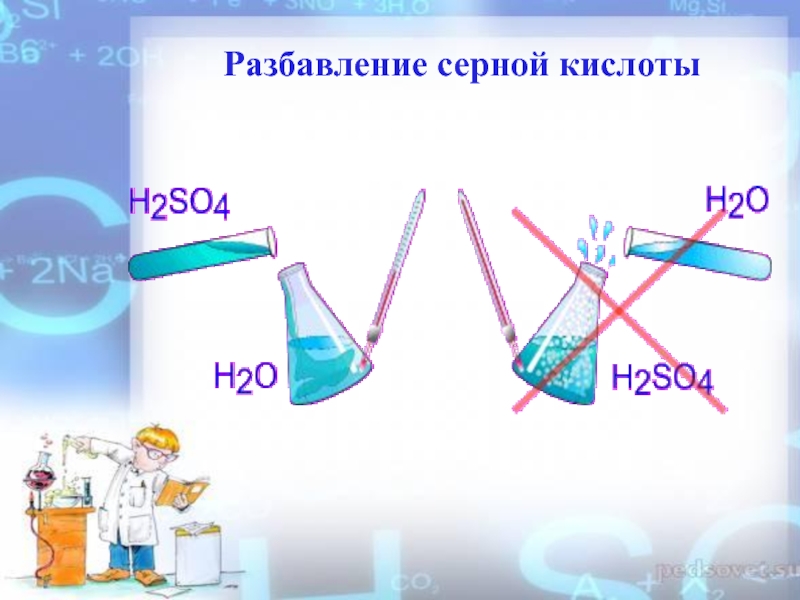
- 7. Разбавление серной кислоты
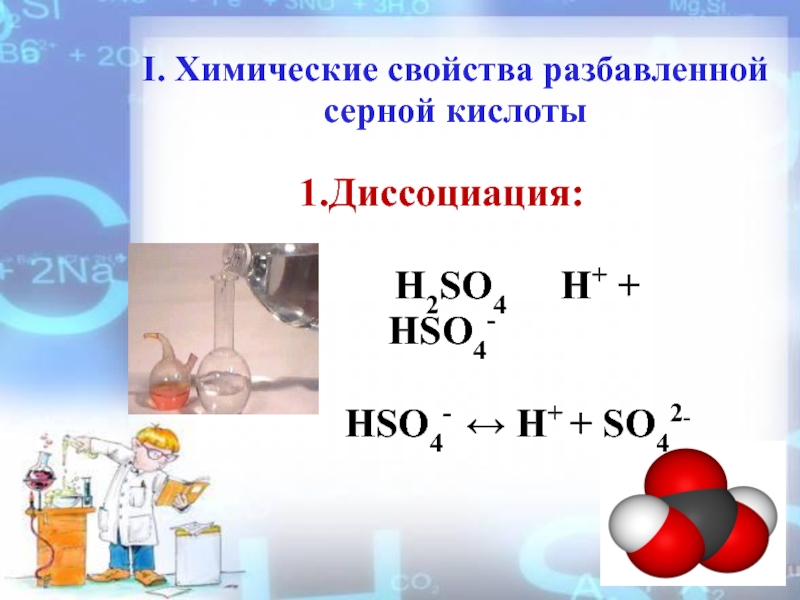
- 8. I. Химические свойства разбавленной серной кислоты1.Диссоциация:
- 9. 2. Взаимодействие с металлами ( до Н
- 10. 3. Взаимодействие с оcновными и амфотерными оксидамиCuO
- 11. 4. Взаимодействие с основаниями и амфотерными гидроксидами2NaOH
- 12. 5.Взаимодействие с солями H2SO4+BaCI2 = BaSO4 ↓
- 13. Качественная реакцияH2SO4+BaCI2 = BaSO4 ↓ + 2HCIBa2+ + SO42- = BaSO4↓
- 14. Серная кислота вытесняет более летучие кислотыNaCI + H2SO4 → NaHSO4 + HCI
- 15. Свойства концентрированной серной кислотыОрганические вещества обугливаются !!!C12H22O11 (сахароза) → 12С (уголь)
- 16. концентрированная серная кислота окисляет неметаллынеМе +
- 17. концентрированная серная кислота окисляет металлыконцентрированная H2+6SO4
- 18. Слайд 18
- 19. Спасибо за внимание!
Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси
Слайд 2Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы
(+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3.
Слайд 8I. Химические свойства разбавленной серной кислоты
1.Диссоциация:
H2SO4 H+ + HSO4-
HSO4- ↔ H+ + SO42-
HSO4- ↔ H+ + SO42-
Слайд 92. Взаимодействие с металлами ( до Н )
Zn + H2SO4 →
ZnSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
Слайд 103. Взаимодействие с оcновными и амфотерными оксидами
CuO + H2SO4 → CuSO4
+ H2O
CuO + 2H+ → Cu2+ + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2H+ → Zn2+ + H2O
Слайд 114. Взаимодействие с основаниями и амфотерными гидроксидами
2NaOH + H2SO4 → Na2SO4
+2 H2O
H+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2H+ → Zn2+ +2H2O
H+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2H+ → Zn2+ +2H2O
Слайд 125.Взаимодействие с солями
H2SO4+BaCI2 = BaSO4 ↓ + 2HCI
Ba2++SO42-
= BaSO4 ↓
K2CO3 + H2SO4 = K2SO4 + CO2 ↑+ H2O
2H++ CO32- = CO2 ↑+ H2O
K2CO3 + H2SO4 = K2SO4 + CO2 ↑+ H2O
2H++ CO32- = CO2 ↑+ H2O
Слайд 15Свойства концентрированной серной кислоты
Органические вещества обугливаются !!!
C12H22O11 (сахароза) → 12С
(уголь)
Слайд 16 концентрированная серная кислота окисляет неметаллы
неМе + H2SO4(конц.) = H2O +
SO2 + кислородсодержащая кислота неМе,
C + 2H2SO4 = 2H2O + CO2 + 2SO2
S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
Слайд 17 концентрированная серная кислота окисляет металлы
концентрированная H2+6SO4 – сильный окислитель; при
взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag + 2H2SO4 → Ag2SO4 + SO2+ 2H2O
8Na + 5H2SO4 → 4Na2SO4 + H2S + 4H2O
2Ag + 2H2SO4 → Ag2SO4 + SO2+ 2H2O
8Na + 5H2SO4 → 4Na2SO4 + H2S + 4H2O