- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Самоучитель по химии Учись решать задачи
Содержание
- 1. Самоучитель по химии Учись решать задачи
- 2. D. углеродСоотношение молекулярных массвысшего гидроксида и летучего
- 3. Слайд 3
- 4. При температуре 40°С реакция протекает за 2
- 5. 32 : 2 = 16 (скорость увеличивается
- 6. Температурный коэффициент некоторой химической реакции равен 2.
- 7. Скорость увеличивается в 4
- 8. При 20°С скорость реакции равна 2 моль/л∙с.
- 9. Слайд 9
- 10. При увеличении давления в 3 раза скорость
- 11. Скорость пр.р.= k•[СО]2•[О2]Скорость пр.р.= k•(3[СО])2•3[О2] Скорость пр.р.=
- 12. При электролизе 40%-ного раствора бромида калия на
- 13. 2KBr + 2H2O = H2 + Br2
- 14. При электролизе 2 М раствора нитрата ртути
- 15. 2Hg(NO3)2 + 2H2O → 2Hg +
- 16. Массовая доля поваренной соли в морской воде
- 17. 8. Решение
- 18. Масса 60%-ного раствора соляной
- 19. Слайд 19
- 20. Газ, полученный разложением 79 г перманганата
- 21. Слайд 21
- 22. Смесь железа и меди обработали при комнатной
- 23. 11. Решение
- 24. Объемная доля кислорода в смеси газов, полученных
- 25. 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑12.
- 26. Масса 0,2 моль вещества Х3 в цепочке
- 27. СН3СООNa СН4
- 28. 150 г смеси, содержащей хлорид натрия, нитрат
- 29. 14. Решение
- 30. Смесь карбоната натрия и сульфата железа (II)
- 31. 15. Решение Na2CO3 + 2HCl → 2NaCl
- 32. Спасибо за внимание!
Слайд 2D. углерод
Соотношение молекулярных масс
высшего гидроксида и летучего водородного соединения элемента, расположенного
в
31 : 8. Определите элемент.
1. Периодический закон
Помощь
А. титан
+
В. свинец
С. кремний
Е. германий
–
–
–
–
Слайд 3 Mr(H2RO3)
Mr(RH4) 8
2 + X +48 31
X + 4 8
X = 12 (это углерод)
1. Решение
Следующий вопрос
Вопрос № 1
Слайд 4При температуре 40°С реакция протекает за 2 мин, а при температуре
2. Скорость химической реакции
Помощь
А. 2
В. 3
С. 4
D. 5
Е. 6
–
–
–
+
–
Слайд 532 : 2 = 16 (скорость увеличивается в 16 раз)
2. Решение
Вопрос № 2
Следующий вопрос
16
=
400C – 200C
10
16
=
4
2
=
4
?
Температурный
коэффициент
Слайд 6Температурный коэффициент некоторой химической реакции равен 2.
При температуре 20°С она
3. Скорость химической реакции
Помощь
А. 240 с
В. 15 с
С. 30 с
D. 20 с
Е. 10 с
–
–
–
+
–
Слайд 7
Скорость увеличивается в 4 раза,
значит,
60 : 4 = 15
Реакция закончится через 15 секунд
3. Решение
Вопрос № 3
Следующий вопрос
4
=
400C – 200C
2
10
Слайд 8При 20°С скорость реакции равна 2 моль/л∙с. Скорость этой реакции при
и температурном коэффициенте равном 2, составляет
4. Скорость химической реакции
Помощь
А. 4 моль/л∙с
В. 6 моль/л∙с
С. 32 моль/л∙с
D. 16 моль/л∙с
Е. 8 моль/л∙с
–
–
–
+
–
Слайд 9
Скорость увеличится в 16 раз, т.е.
2•16 = 32 моль•л/с
4. Решение
Вопрос № 4
Следующий вопрос
16
=
600C – 200C
10
2
Слайд 10При увеличении давления в 3 раза скорость прямой и обратной реакции
прямой – уменьшится в 9 раз,
обратной – увеличится в 27 раз
прямой – увеличится в 81 раз,
обратной – увеличится в 6 раза
прямой – увеличится в 27 раз,
обратной – увеличится в 9 раз
прямой – увеличится в 81 раз,
обратной – увеличится в 27 раз
прямой – увеличится в 27 раз,
обратной – уменьшится в 9 раз
5. Скорость химической реакции
Помощь
А
B
C
D
E
–
–
+
–
–
Слайд 11Скорость пр.р.= k•[СО]2•[О2]
Скорость пр.р.= k•(3[СО])2•3[О2]
Скорость пр.р.= k•9[СО]2•3[О2] = 27k•[СО]2•[О2]
Скорость прямой
Скорость обр.р.= k•[СО2]2
Скорость обр.р.= k•(3[СО2])2 = 9k•[СО2]2
Скорость обратной реакции увеличится в 9 раз
5. Решение
Вопрос № 5
Следующий вопрос
Слайд 12При электролизе 40%-ного раствора бромида калия на катоде выделилось 4,48 л
8 г Br2 и 95,2 г раствора KBr
16 г Br2 и 59,6 г раствора KBr
32 г Br2 и 19,04 г раствора KBr
32 г Br2 и 119 г раствора KBr
3,2 г Br2 и 23,8 г раствора KBr
6. Электролиз
Помощь
А
B
C
D
E
–
–
–
+
–
Слайд 13
2KBr + 2H2O = H2 + Br2 + 2KOH
m (Br2) = 32 г
m (КBr) = 47,6 г
m (р-ра КBr) = m(КBr) : W(КBr)
m (р-ра КBr) = 47,6 : 0,4 = 119 г
6. Решение
Х г
4,48 л
у г
2•119 г
22,4 л
160 г
Вопрос № 6
Следующий вопрос
Слайд 14При электролизе 2 М раствора нитрата ртути (II) на аноде выделилось
20,1 г Hg и 50 мл раствора Hg(NO3)2
40,2 г Hg и 100 мл раствора Hg(NO3)2
80,4 г Hg и 200 мл раствора Hg(NO3)2
4 г Hg и 10 мл раствора Hg(NO3)2
201 г Hg и 150 мл раствора Hg(NO3)2
7. Электролиз
Помощь
А
B
C
D
E
–
+
–
–
–
Слайд 15
2Hg(NO3)2 + 2H2O → 2Hg + O2 + 4HNO3
m(Hg)
n(Hg(NO3)2) = 0,2 моль
V(р-ра Hg(NO3)2) = n(Hg(NO3)2) : C(Hg(NO3)2)
V(р-ра Hg(NO3)2) = 0,2 : 2 = 0,1 л (100 мл)
7. Решение
2 моль
2•201г
22,4 л
Х моль
У г
2,24 л
C(Hg(NO3)2)
n(Hg(NO3)2)
V(р-ра Hg(NO3)2)
=
Вопрос № 7
Следующий вопрос
0,2 моль
2 моль/л
?
Слайд 16Массовая доля поваренной соли в морской воде 5%. Масса пресной воды,
8. Растворы
Помощь
А. 120 г
В. 200 г
С. 100 г
D. 400 г
Е. 180 г
-
-
-
+
-
Слайд 178. Решение
m1(р-ра)
m (в-ва) = 0,05 • 80 = 4 г
m(в-ва)
m2(р-ра)
0,02(80 + х) = 4
х = 120
=
W1(в-ва)
0,05
80 г
?
=
W2(в-ва)
0,02
80 + х
4 г
Вопрос № 8
Следующий вопрос
Слайд 18 Масса 60%-ного раствора соляной кислоты, которую необходимо добавить
9. Растворы
Помощь
А. 60 г
В. 120 г
С. 240 г
D. 180 г
Е. 16 г
-
-
-
+
-
Слайд 19
m1(р-ра)
m3(в-ва)
m3(р-ра)
0,5(х + 80) = 0,6х + 16
х = 240
9. Решение
=
=
W1(в-ва)
W2(в-ва)
W3(в-ва)
=
0,6
0,5
0,2
0,6Х
16 г
0,6Х+16
Х + 80
Х г
80 г
m2(р-ра)
m2(в-ва)
Вопрос № 9
Следующий вопрос
Слайд 20 Газ, полученный разложением 79 г перманганата калия, смешали в замкнутом
10. Кислород. Водород.
Помощь
А. 9 г
В. 18 г
С. 36 г
D. 1,8 г
Е. 54 г
-
-
-
+
-
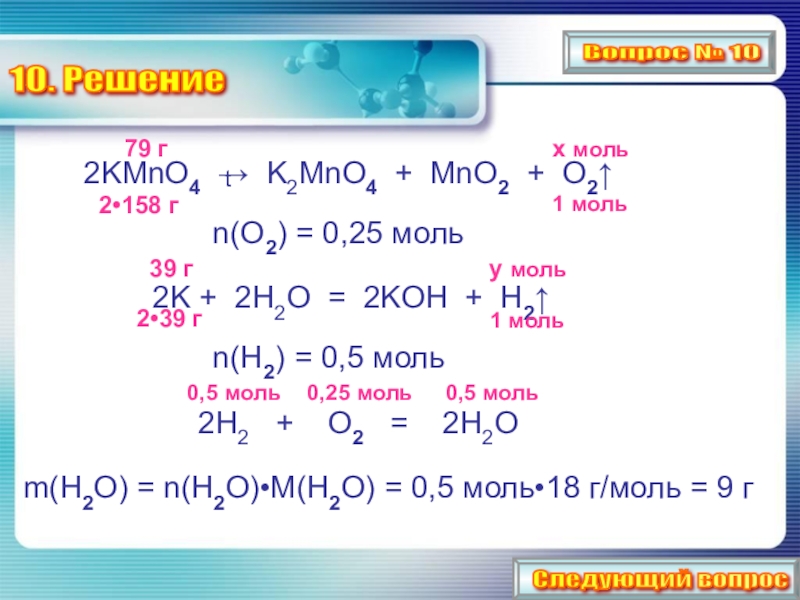
Слайд 21
2KMnO4 → K2MnO4 + MnO2 + O2↑
n(O2) = 0,25 моль
2K + 2Н2O = 2KOН + Н2↑
n(Н2) = 0,5 моль
2Н2 + O2 = 2Н2O
m(Н2O) = n(Н2O)•M(Н2O) = 0,5 моль•18 г/моль = 9 г
10. Решение
t
79 г
х моль
2•158 г
1 моль
39 г
2•39 г
y моль
1 моль
0,5 моль
0,25 моль
0,5 моль
Вопрос № 10
Следующий вопрос
Слайд 22Смесь железа и меди обработали при комнатной температуре концентрированной азотной кислотой.
0,1 моль Fe и 0,1 моль Cu
0,1 моль Fe и 0,2 моль Cu
0,1 моль Cu и 0,2 моль Fe
0,1 моль Fe и 0,3 моль Cu
0,4 моль Fe и 0,2 моль Cu
11. Азот и его соединения
Помощь
А
B
C
D
E
–
+
–
–
–
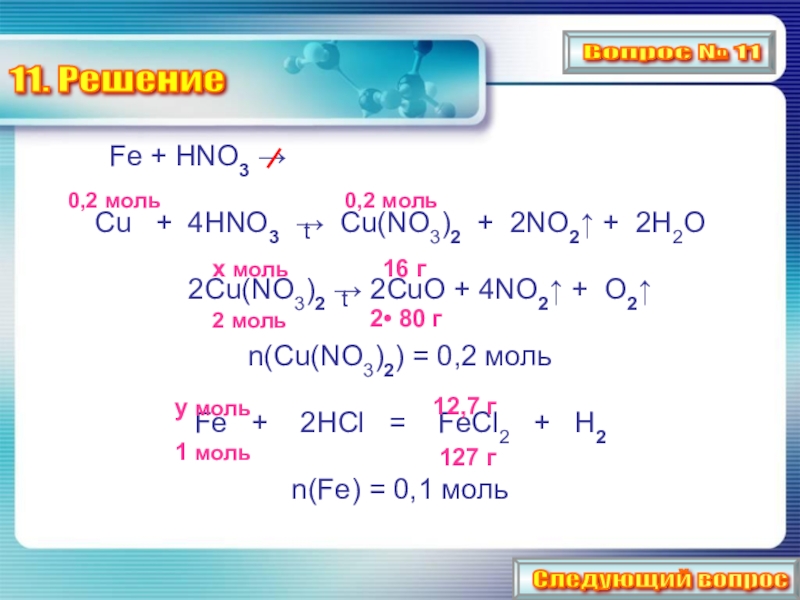
Слайд 2311. Решение
Fe + HNO3
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
n(Cu(NO3)2) = 0,2 моль
Fe + 2HCl = FeCl2 + H2
n(Fe) = 0,1 моль
t
t
0,2 моль
0,2 моль
х моль
2 моль
2• 80 г
16 г
y моль
1 моль
12,7 г
127 г
Вопрос № 11
Следующий вопрос
Слайд 24Объемная доля кислорода в смеси газов, полученных при термическом разложении нитрата
12. Азот и его соединения
Помощь
А. 80 %
В. 50 %
С. 40 %
D. 20 %
Е. 33 %
-
-
-
+
-
Слайд 25
4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑
12. Решение
t
15 моль
3 моль
φ(O2)
=
n(O2)
n(смеси)
15
3 моль
=
=
0,2 (20%)
Вопрос № 12
Следующий вопрос
Слайд 26Масса 0,2 моль вещества Х3 в цепочке превращений:
СН3СООNa
13. Предельные углеводороды
+ Na O H (т в.)
+ 1 Cl2 (свет)
+ 2 Na, С2Н5Cl
Помощь
А. 8,8 г
В. 11,6 г
С. 20 г
D. 16,8 г
Е. 14,4 г
-
-
-
+
-
Слайд 27
СН3СООNa СН4
n(C3H8) = 0,2 моль
m(C3H8) = n(C3H8) • M(C3H8)
m(C3H8) = 0,2 моль • 44 г/моль = 8,8 г
13. Решение
+ Na O H (т в.)
+ 1 Cl2 (свет)
+ 2 Na, С2Н5Cl
X1
X2
X3
Вопрос № 13
Следующий вопрос
Слайд 28150 г смеси, содержащей хлорид натрия, нитрат железа (II), карбонат натрия,
14. Соли
Помощь
А. 76,8 г
В. 10,6 г
С. 67,4 г
D. 34 г
Е. 57,4 г
-
-
-
+
-
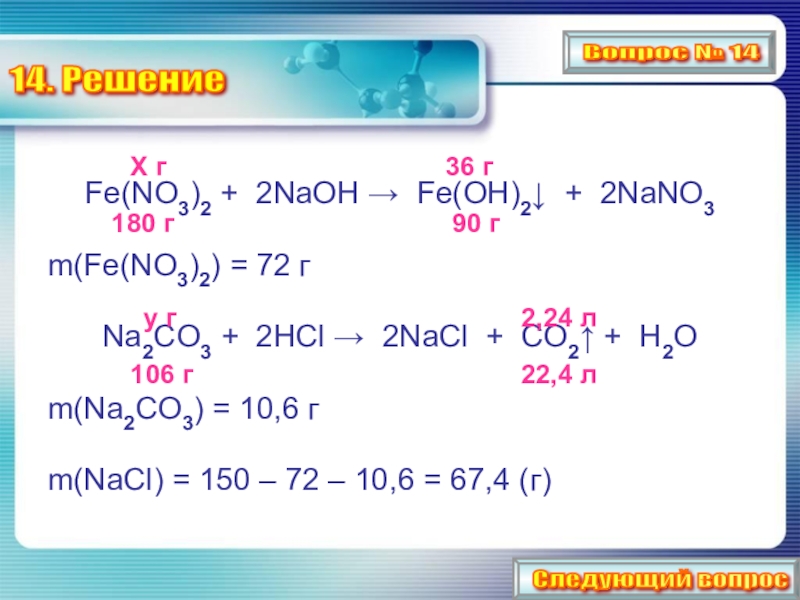
Слайд 2914. Решение
Fe(NO3)2 + 2NaOH
m(Fe(NO3)2) = 72 г
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
m(Na2CO3) = 10,6 г
m(NaCl) = 150 – 72 – 10,6 = 67,4 (г)
Х г
36 г
90 г
180 г
y г
106 г
2,24 л
22,4 л
Вопрос № 14
Следующий вопрос
Слайд 30Смесь карбоната натрия и сульфата железа (II) обработали водой. К полученному
15. Соли
Помощь
А. 30,4 г
В. 10,6 г
С. 41 г
D. 60 г
Е. 58 г
-
-
-
+
-
Слайд 3115. Решение
Na2CO3 + 2HCl → 2NaCl + CO2↑ +
m(Na2CO3) = 10,6 г
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
m(FeSO4) = 30,4 г
m(смеси) = 10,6 + 30,4 = 41 (г)
y г
Х г
2,24 л
22,4 л
106 г
152 г
90 г
18 г
Вопрос № 15
Работа закончена










![Самоучитель по химии Учись решать задачи Скорость пр.р.= k•[СО]2•[О2]Скорость пр.р.= k•(3[СО])2•3[О2] Скорость пр.р.= k•9[СО]2•3[О2] = 27k•[СО]2•[О2]Скорость прямой Скорость пр.р.= k•[СО]2•[О2]Скорость пр.р.= k•(3[СО])2•3[О2] Скорость пр.р.= k•9[СО]2•3[О2] = 27k•[СО]2•[О2]Скорость прямой реакции увеличится в 27 разСкорость обр.р.=](/img/thumbs/edbc3874511cc5cf1cb02dba2763b7e5-800x.jpg)