- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Роль воды в химических реакциях (11 класс, базовый уровень)
Содержание
- 1. Роль воды в химических реакциях (11 класс, базовый уровень)
- 2. Вода - самое необыкновенное вещество в мире.
- 3. Строение молекулы воды 1S1HО1S2 2S2 2p4δ+δ+δ–δ+δ+δ–δ+δ+δ–δ+δ+δ–δ+δ+δ–δ+δ+δ–э/о(Н)=2,1э/о(О)=3,5δ+δ+δ–δ+δ+δ–δ+δ+δ–δ+δ+δ–δ+δ+δ–δ+δ+δ–Тпл=00СТкип=1000Сρ=1г/мл
- 4. I. универсальный растворительпо отношению к воде как
- 5. Кристаллогидраты – кристаллические вещества, содержащие молекулы
- 6. Растворение – физико–химический процесс, при котором происходит
- 7. Виды растворовгидратация - процесс взаимодействия воды с
- 8. II. фактор диссоциации-молекулярныйионныйионнаяионная-ионныйионнаяионныйковалентная ковалентная слабополярнаяковалентная сильнополярнаяhttp://www.youtube.com/watch?v=EjScUis24Xchttp://www.youtube.com/watch?v=81hzKx19bHM
- 9. Все вещества принято делить на с неполярной
- 10. Слайд 10
- 11. Классификация электролитов соли (искл. HgCl2, Fe(SCN)3)основания, образованные
- 12. В 1887г. шведский учёный предложил теорию электролитической
- 13. Основные положения ТЭДэлектролиты в растворах и расплавах
- 14. III. реакционная средавсе взаимодействия в растворах -
- 15. Формы связывания ионовBaCl2 + Na2SO4 → BaSO4
- 16. IV. "транспортное средство"Все реакции обмена веществ в
- 17. V. катализатор2Al +3I2
- 18. VI. химический реагентВ органической химии – это
- 19. VI. химический реагентВ неорганической химии – это
- 20. Домашнее задание§ 17Упр.1-10ТПО стр. 114-122
Слайд 1Роль воды в химических реакциях
11 класс
базовый уровень
Трухина О.Е.
http://Учительский.сайт/Трухина-Ольга-Евгеньевна
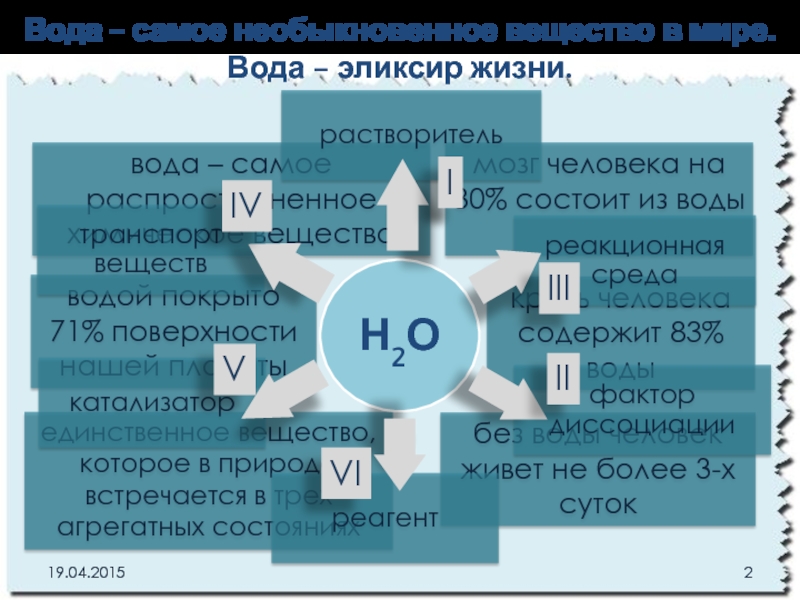
Слайд 2Вода - самое необыкновенное вещество в мире.
Вода – эликсир жизни.
водой
кровь человека содержит 83% воды
единственное вещество, которое в природе встречается в трех агрегатных состояниях
вода – самое распространенное химическое вещество
без воды человек живет не более 3-х суток
мозг человека на 80% состоит из воды
Н2О
растворитель
реакционная среда
фактор диссоциации
реагент
катализатор
транспорт веществ
I
II
III
IV
VI
V
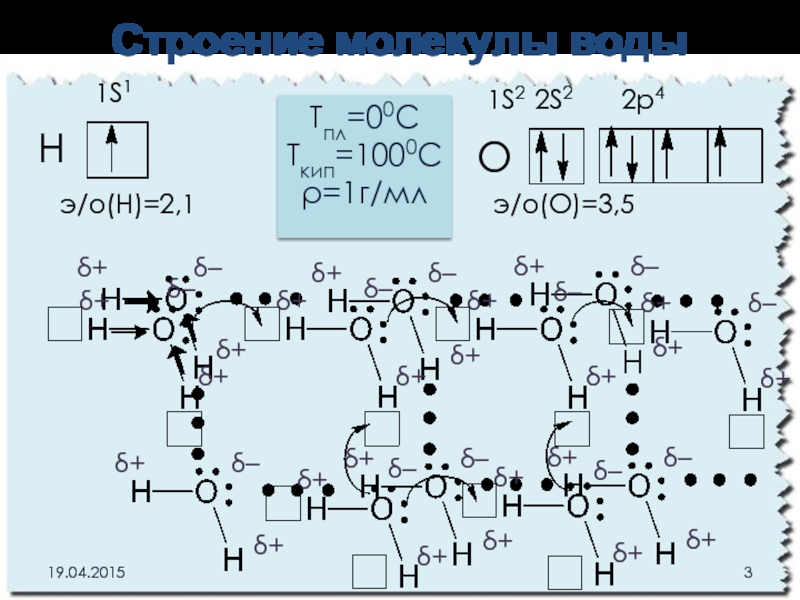
Слайд 3Строение молекулы воды
1S1
H
О
1S2 2S2 2p4
δ+
δ+
δ–
δ+
δ+
δ–
δ+
δ+
δ–
δ+
δ+
δ–
δ+
δ+
δ–
δ+
δ+
δ–
э/о(Н)=2,1
э/о(О)=3,5
δ+
δ+
δ–
δ+
δ+
δ–
δ+
δ+
δ–
δ+
δ+
δ–
δ+
δ+
δ–
δ+
δ+
δ–
Тпл=00С
Ткип=1000С
ρ=1г/мл
Слайд 4I. универсальный растворитель
по отношению к воде как растворителю все вещества делятся
В 100г воды растворяется
более 1г вещества
В 100г воды растворяется
от 0,01 до 1г вещества
В 100г воды растворяется
менее 0,01г вещества
Р
М
Н
сахар
В 1л воды
─ 2000г
гипс
СаSO4•2Н2О
в 1л воды ─ 2г
AgCl
в 100г воды
─1,5•10-4 г
Слайд 5Кристаллогидраты –
кристаллические вещества, содержащие молекулы воды
СuSO4 •
5H2O
медный купорос
глауберова соль (гипс)
Na2SO4
10H2O
10H2O
Na2СO3 •
кристаллическая сода
кристаллизационная вода
безводный сульфат меди CuSO4 бесцветный (слева), но при соприкосновении с водой он мгновенно превращается в медный купорос (справа).
процесс потери кристаллизационной воды называется выветриванием
http://www.youtube.com/watch?v=6STV9hXH4cs
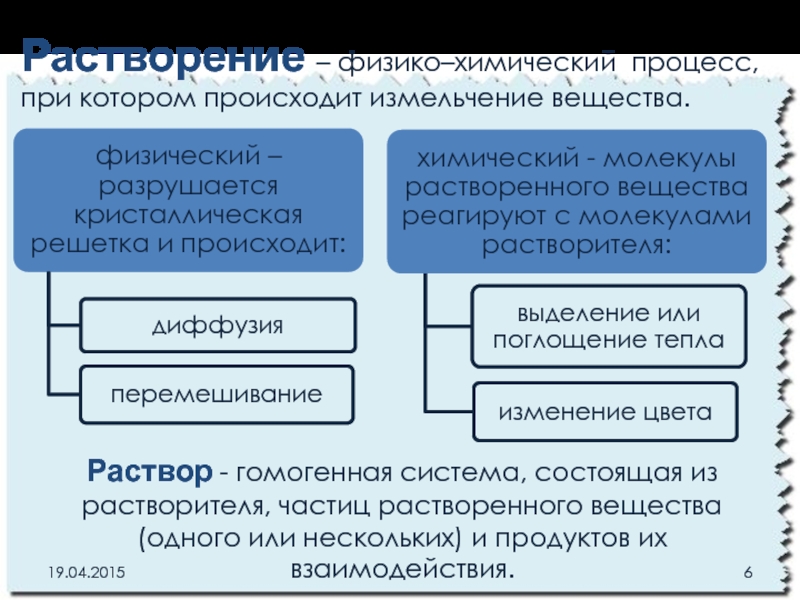
Слайд 6Растворение – физико–химический процесс, при котором происходит измельчение вещества.
Раствор - гомогенная
Слайд 7Виды растворов
гидратация - процесс взаимодействия воды с частицами растворяемого вещества
сахар С12Н22О11
спирт
глюкоза С6Н12О6
уксусная кислота
СH3COOH
поваренная соль
NaCl
сода Na2CO3
☼
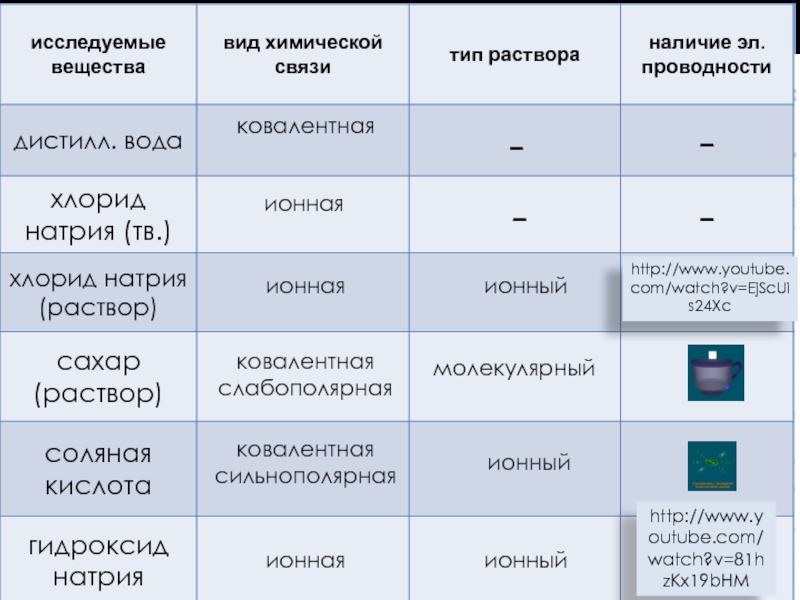
Слайд 8II. фактор диссоциации
-
молекулярный
ионный
ионная
ионная
-
ионный
ионная
ионный
ковалентная
ковалентная слабополярная
ковалентная сильнополярная
http://www.youtube.com/watch?v=EjScUis24Xc
http://www.youtube.com/watch?v=81hzKx19bHM
Слайд 9Все вещества принято делить на
с неполярной и слабополярной ковалентной связью;
вещества
многие органические вещества: у/в, спирты, альдегиды, кетоны, углеводы и др.
с ионной и ковалентной полярной связью;
вещества - растворы, которых обладают ионной проводимостью;
кислоты, основания, почти все соли (искл. HgCl2, Fe(SCN)3)
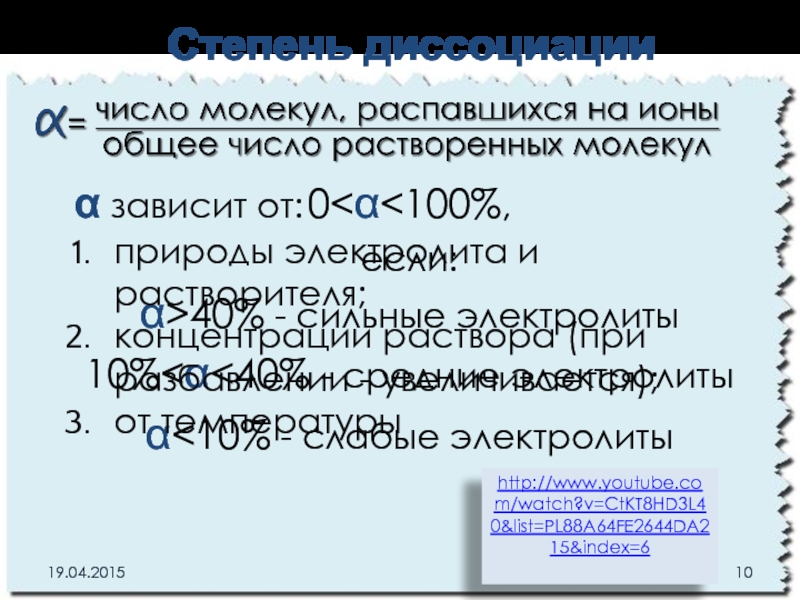
Слайд 100
α<10% - слабые электролиты
α зависит от:
природы электролита и растворителя;
концентрации раствора (при разбавлении - увеличивается);
от температуры
Степень диссоциации
http://www.youtube.com/watch?v=CtKT8HD3L40&list=PL88A64FE2644DA215&index=6
Слайд 11Классификация электролитов
соли (искл. HgCl2, Fe(SCN)3)
основания, образованные щелочными (Li-Fr) и щелочно-земельными
неорган. кислоты: HCl, HBr, HI и (О)содержащие ЭОm(OH)n, если m=2;3 кислота - сильная
гидроксиды d-элементов металлов в низших с.о.
амфотерные –Cr(OH)3, Fe(OH)3, Be(OH)2, Zn(OH)2
гидрат аммиака NH3∙H2O; вода H2O
кислоты органические и неорганические: HCN, HF, H2S и (О)содержащие ЭОm(OH)n, если m=0;1 кислота - слабая
CuCl2 → Cu2+ + 2Cl–
Ba(OH)2 → Ba2+ + 2OH–
HCl → H+ + Cl–
H2SO4 → 2H+ + SO4 2–
CH3COOH ↔ H+ + CH3COO–
H2S ↔ H+ + HS–
NH4OH ↔ NH4+ + OH–
H2O ↔ H+ + OH –
Слайд 12В 1887г. шведский учёный предложил теорию электролитической диссоциации для объяснения
Сванте Аррениус
В дальнейшем эта теория была развита многими учёными, в том числе Д.И.Менделеевым, И.А.Каблуковым и В.А.Кистяковским.
Слайд 13Основные положения ТЭД
электролиты в растворах и расплавах распадаются на ионы;
если через
диссоциация – обратимый процесс (для слабых электролитов);
ионы и атомы одних и тех же элементов отличаются друг от друга по строению и свойствам.
☼
Слайд 14III. реакционная среда
все взаимодействия в растворах - это реакции между сильными
реакции в растворах электролитов – это реакции между ионами;
сущность таких реакций отражают сокращённые ионные уравнения:
BaCl2 + 2AgNO3 → 2AgCl↓ + Ba(NO3)2
2Cl– + 2Ag+ → 2AgCl↓
Cl– + Ag+ → AgCl↓
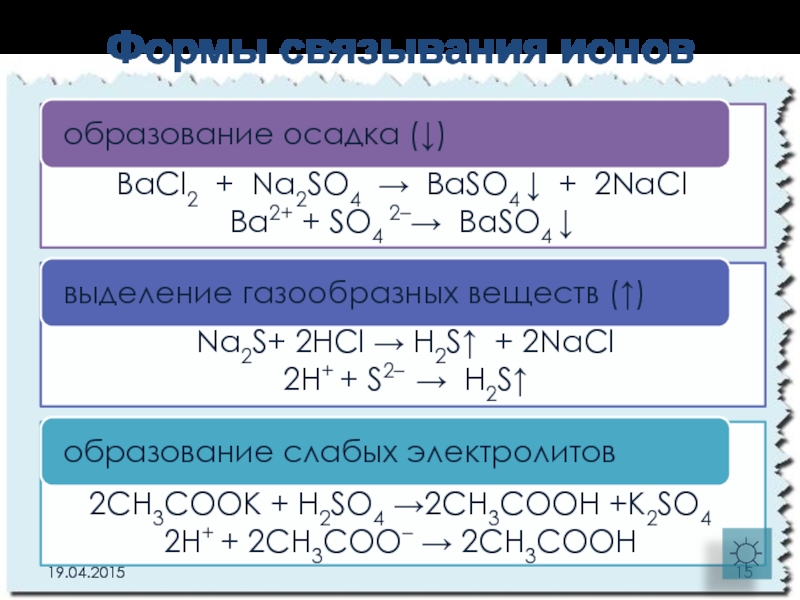
Слайд 15Формы связывания ионов
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Ba2+ +
Na2S+ 2HCl → H2S↑ + 2NaCl
2H+ + S2– → H2S↑
2CH3COOK + H2SO4 →2CH3COOH +K2SO4
2H+ + 2CH3COO– → 2CH3COOH
☼
Слайд 16IV. "транспортное средство"
Все реакции обмена веществ в организме человека, и в
Вода - "транспортное средство", то есть среда, позволяющая перемещать реагенты, продукты реакции из одного технологического аппарата в другой; теплоноситель и хладагент в тепловых процессах.
☼
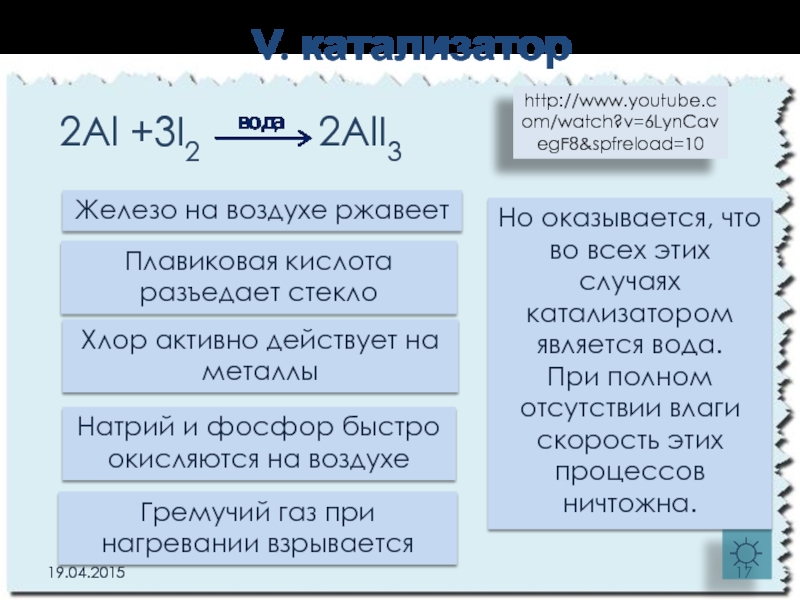
Слайд 17V. катализатор
2Al +3I2 2AlI3
☼
Железо
Гремучий газ при нагревании взрывается
Плавиковая кислота разъедает стекло
Натрий и фосфор быстро окисляются на воздухе
Хлор активно действует на металлы
Но оказывается, что во всех этих случаях катализатором является вода.
При полном отсутствии влаги скорость этих процессов ничтожна.
http://www.youtube.com/watch?v=6LynCavegF8&spfreload=10
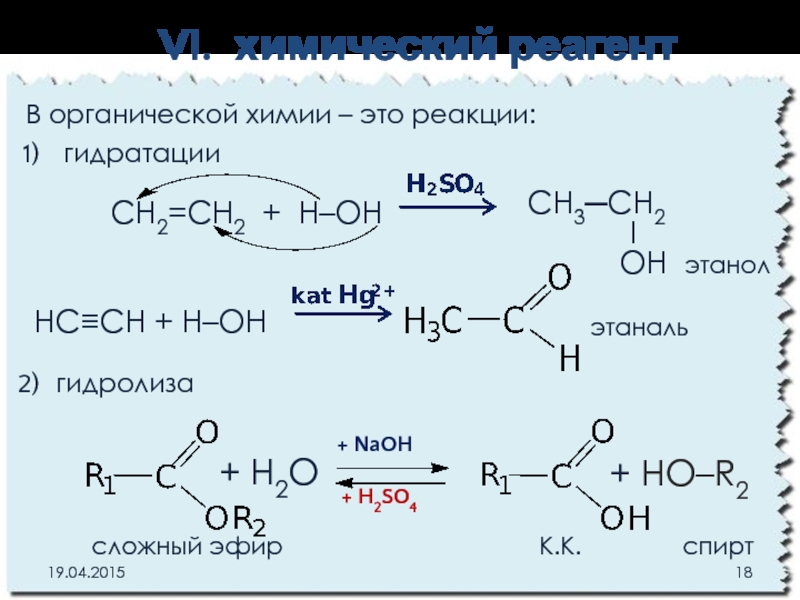
Слайд 18VI. химический реагент
В органической химии – это реакции:
гидратации
гидролиза
СН3─СН2
I
OH этанол
СН2=CH2 + H–OH
НС≡СH + Н–OH
этаналь
+ HO–R2
+ H2O
+ NaOH
+ H2SO4
сложный эфир К.К. спирт
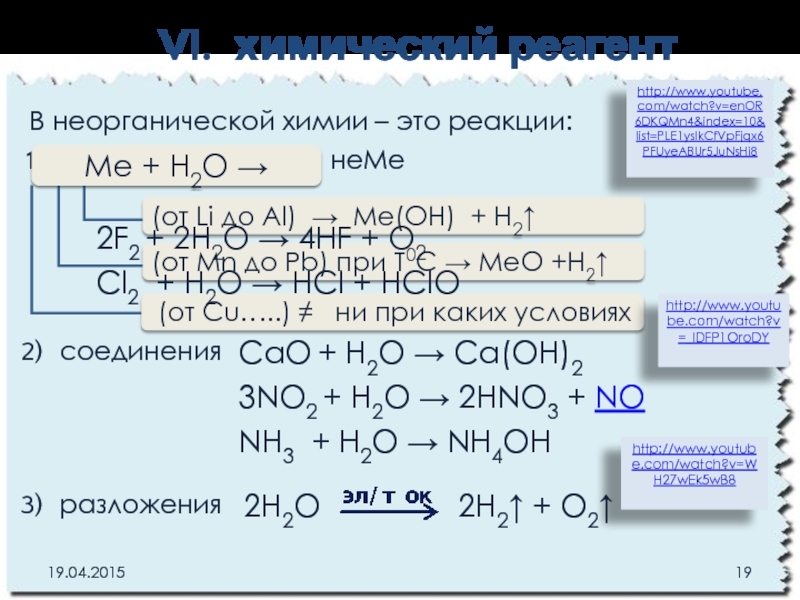
Слайд 19VI. химический реагент
В неорганической химии – это реакции:
замещения с Ме
соединения
разложения
Mе + Н2O →
(от Li до Al) Ме(ОН) + Н2↑
(от Mn до Pb) при Т0С МеО +Н2↑
(от Cu…..) ≠ ни при каких условиях
2H2O 2Н2↑ + О2↑
СaО + H2O → Сa(OH)2
3NO2 + H2O → 2HNO3 + NO
NH3 + H2O → NH4OH
2F2 + 2H2O → 4HF + O2
Cl2 + H2O → HCl + HClO
http://www.youtube.com/watch?v=enOR6DKQMn4&index=10&list=PLE1ysIkCfVpFjqx6PFUyeABUr5JuNsHi8
http://www.youtube.com/watch?v=WH27wEk5wB8
http://www.youtube.com/watch?v=_lDFP1OroDY