химией всю ночь просидеть.
Вс.Рождественский. Над книгой
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Взаимодействие кислот с металлами
Содержание
- 1. Презентация Взаимодействие кислот с металлами
- 2. Цель урока:Знакомство с активностью металлов и
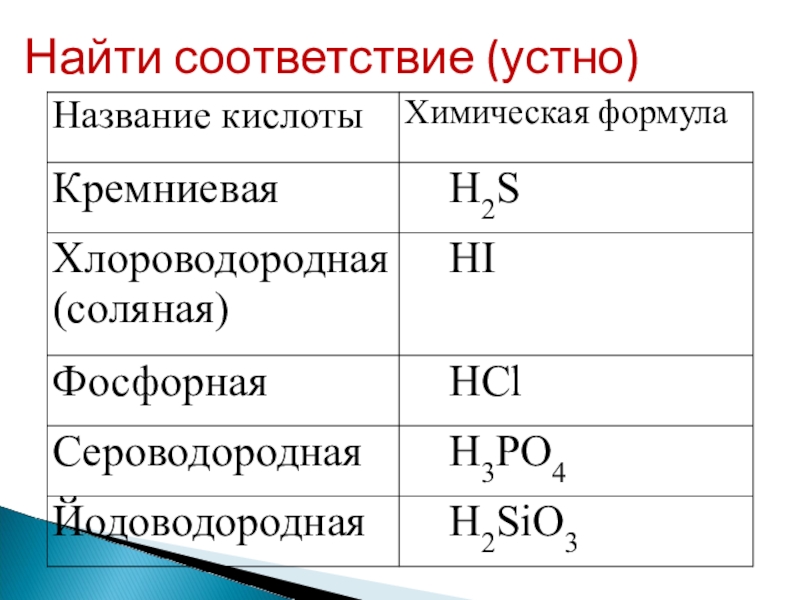
- 3. Найти соответствие (устно)
- 4. Из этих формул отыщите и запишите кислоты
- 5. HCl
- 6. Тема урока: Взаимодействие кислот с металлами.
- 7. Кислоты– ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ
- 8. Слайд 8
- 9. 2. КЛАССИФИКАЦИЯ КИСЛОТ.бескислородные
- 10. По основности:
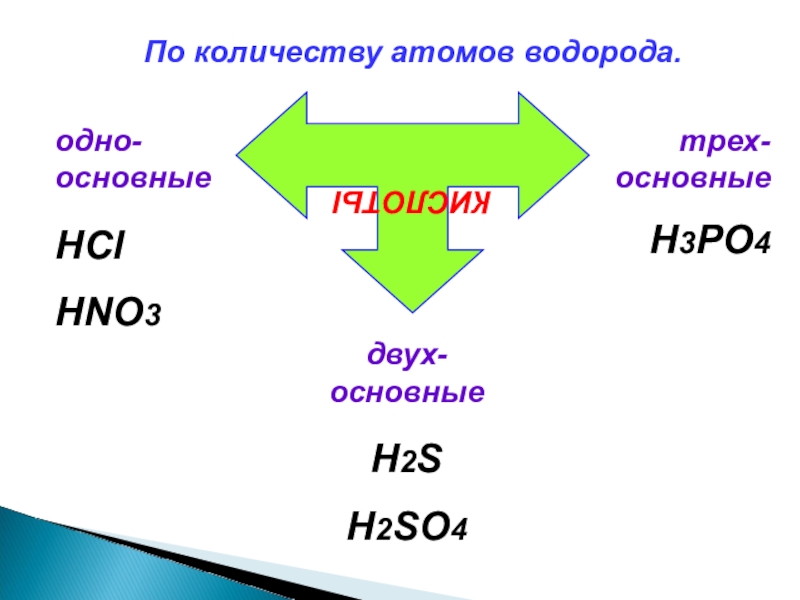
- 11. По количеству атомов водорода.КИСЛОТЫодно-основныеHClHNO3двух-основныеH2SH2SO4трех-основныеH3PO4
- 12. НЕОРГАНИЧЕСКИЕ- СЕРНАЯ, СОЛЯНАЯ, ПЛАВИКОВАЯ, ФОСФОРНАЯ, АЗОТНАЯ.
- 13. ОРГАНИЧЕСКИЕ – ЛИМОННАЯ, ЯБЛОЧНАЯ, УКСУСНАЯ, ЩАВЕЛЕВАЯ, МУРАВЬИНАЯ.
- 14. Соляная кислота, находящаяся в желудке, помогает переваривать пищу.Молочная кислота образуется в мышцах при физической нагрузке.
- 15. Аскорбиновая, фолиевая,липоевая,ацетил-салициловаяи другие
- 16. Уксусная и лимонная кислоты.
- 17. SO2+H2O=H2SO3ОБРАЗОВАНИЕ КИСЛОТНЫХ ДОЖДЕЙ В ПРИРОДЕ.
- 18. Сила кислот уменьшаетсяHClO4,
- 19. Сильные кислоты Слабые кислоты
- 20. 1. При разбавлении кислот с водой следует
- 21. Не принимайте пищу во время химическихэкспериментов, а
- 22. Слайд 22
- 23. Юные химики, помните: кислоту добавляют в воду, а не наоборот
- 24. МЕТАЛЛ + КИСЛОТА = СОЛЬ + ВОДОРОД
- 25. Ряд активности (напряжений) металлов создан
- 26. Три условия: Кислота растворимая (кроме HNO3)Ме стоит
- 27. 1) Cu + НСl →не идет2) Zn
- 28. Следует помнить, что в реакциях металлов с
- 29. Пассивирование - образование оксидной пленки. Al, Fe,
- 30. Помогите расшифровать
- 31. Игра: Третий лишнийА) НСL, HNO3 H2S
- 32. §30, запомнить сильные и слабые кислоты. Домашний эксперимент-стр.171. Используя интернет, найти области применения кислот.
Цель урока:Знакомство с активностью металлов и силой кислот при их взаимодействии. ль: Создать условия для ознакомления учащимися свойствами кислот при взаимодействии с металлами, активностью металлов и силой кислот.
Слайд 2 Цель урока:
Знакомство с активностью металлов и силой кислот при их
взаимодействии.
ль: Создать условия для ознакомления учащимися свойствами кислот при взаимодействии с металлами, активностью металлов и силой кислот.
ль: Создать условия для ознакомления учащимися свойствами кислот при взаимодействии с металлами, активностью металлов и силой кислот.
Слайд 4Из этих формул отыщите и запишите кислоты и металлы назовите их.
H2O HCl H2S Cu AlCl3 Ca H2SO4 ZnSO4 Al2O3 Ca(OH)2 NaNO3 Zn H3PO4 H2SiO3 Na2O K Fe
Слайд 7 Кислоты– ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ АТОМОВ ВОДОРОДА, СПОСОБНОГО ЗАМЕЩАТЬСЯ
НА АТОМЫ МЕТАЛЛОВ, И КИСЛОТНЫХ ОСТАТКОВ.
Цель: Создать условия для ознакомления учащимися свойствами кислот при взаимодействии с металлами, активностью металлов и силой кислот.
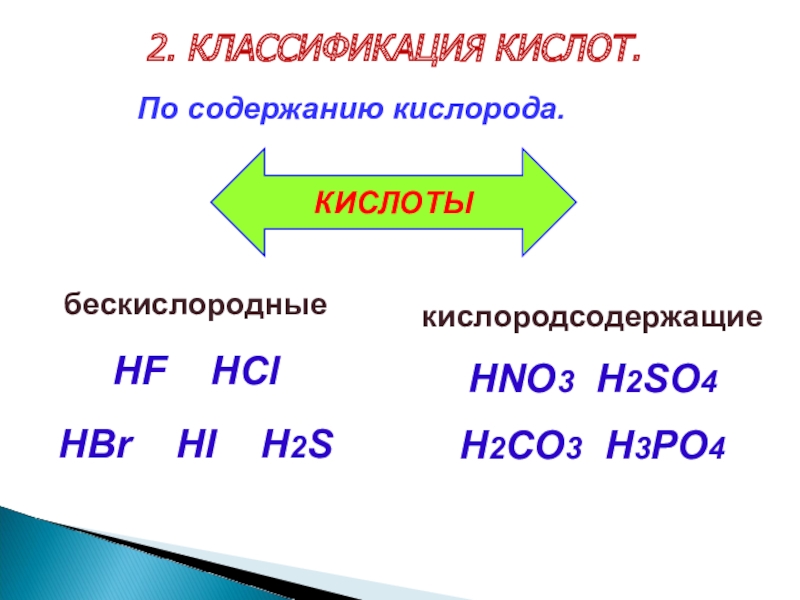
Слайд 92. КЛАССИФИКАЦИЯ КИСЛОТ.
бескислородные
HF
HCl
HBr HI H2S
HBr HI H2S
По содержанию кислорода.
кислородсодержащие
HNO3 H2SO4
H2CO3 H3PO4
КИСЛОТЫ
Слайд 11 По количеству атомов водорода.
КИСЛОТЫ
одно-основные
HCl
HNO3
двух-основные
H2S
H2SO4
трех-основные
H3PO4
Слайд 14Соляная кислота, находящаяся в желудке, помогает переваривать пищу.
Молочная кислота образуется в
мышцах при физической нагрузке.
Слайд 18 Сила кислот уменьшается
HClO4, H2SO4, HCl , H2SO3,
H2СO3, H2S, H2SiO3
HNO3
H3PO4
Под силой кислоты понимают ее способность отдавать ионы водорода H+.
HNO3
H3PO4
Под силой кислоты понимают ее способность отдавать ионы водорода H+.
Слайд 19Сильные кислоты Слабые кислоты
HI
HF
HBr H3PO4-средняя
HCl H2SO3
H2SO4 H2S
HNO3 H2CO3
H2SiO3
HNO2
HBr H3PO4-средняя
HCl H2SO3
H2SO4 H2S
HNO3 H2CO3
H2SiO3
HNO2
Слайд 201. При разбавлении кислот с водой следует кислоту тонкой струйкой при
перемешивании наливать в воду, а не наоборот.
2. Если случайно кислота попадет на руку или на одежду, то немедленно смойте ее большим количеством воды, а потом обработайте место раствором гидрокарбоната натрия (соды).
2. Если случайно кислота попадет на руку или на одежду, то немедленно смойте ее большим количеством воды, а потом обработайте место раствором гидрокарбоната натрия (соды).
Слайд 21Не принимайте пищу во время химических
экспериментов, а после их завершения
тщательно
мойте руки
Никогда не пробуйте химические вещества на вкус
Слайд 22
Плотность воды меньше плотности кислоты. Поэтому:Сначала вода, потом кислота,
Иначе случится большая беда!
Не добавляйте воду в кислоту !
Иначе случится большая беда!
Не добавляйте воду в кислоту !
Слайд 25
Ряд активности (напряжений) металлов создан русским ученым Н.Н.Бекетовым в1865
году.
К Са Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Pt Au
Почему не пошла реакция взаимодействия кислоты с медью?
Найди медь и цинк, магний и железо в ряду
- Активные металлы вытесняют водород из кислот.
К Са Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Pt Au
Почему не пошла реакция взаимодействия кислоты с медью?
Найди медь и цинк, магний и железо в ряду
- Активные металлы вытесняют водород из кислот.
Слайд 26Три условия:
Кислота растворимая (кроме HNO3)
Ме стоит в ряду активности до
водорода
Получается растворимая соль
1) Cu + НСl →
2) Zn + CH3COOH →
3) Na + H3PO4 →
4) Ca + H2SO4 →
Получается растворимая соль
1) Cu + НСl →
2) Zn + CH3COOH →
3) Na + H3PO4 →
4) Ca + H2SO4 →
↑ ↑ з
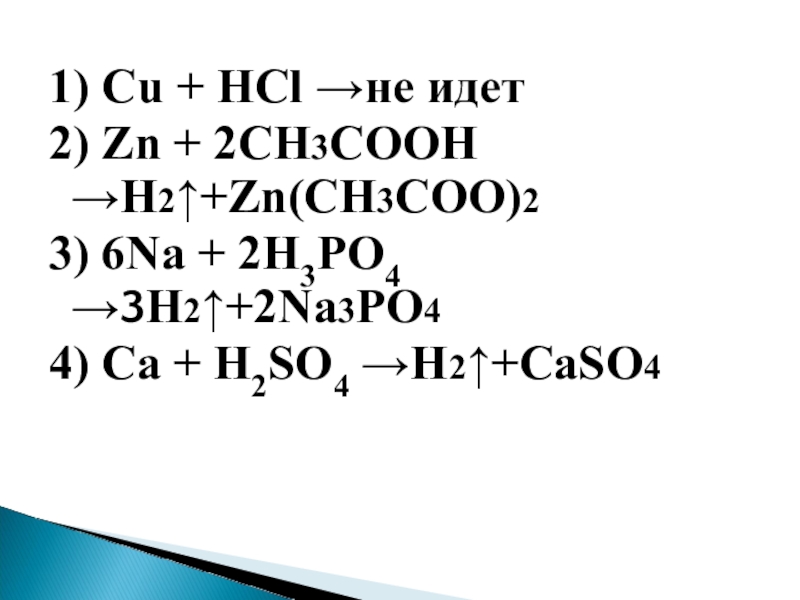
Слайд 271) Cu + НСl →не идет
2) Zn + 2CH3COOH →H2↑+Zn(CH3COO)2
3) 6Na
+ 2H3PO4 →3H2↑+2Na3PO4
4) Ca + H2SO4 →H2↑+CaSO4
4) Ca + H2SO4 →H2↑+CaSO4
Слайд 28Следует помнить, что в реакциях металлов с HNO3 (конц.) и H2SO4(конц)
H2 не образуется, а образуются другие вещества.
Например:
Cu+4HNO3(к)=Cu(NO3)2+2NO2+2H2O
3Cu+8HNO3(р)=3Cu(NO3)2+2NO+4H2O
8K+5H2SO4(конц.)=4K2SO4+H2S+4 H2O
3Zn +4H2SO4(конц.)=3ZnSO4+S+4H2O
Например:
Cu+4HNO3(к)=Cu(NO3)2+2NO2+2H2O
3Cu+8HNO3(р)=3Cu(NO3)2+2NO+4H2O
8K+5H2SO4(конц.)=4K2SO4+H2S+4 H2O
3Zn +4H2SO4(конц.)=3ZnSO4+S+4H2O
Слайд 29Пассивирование - образование оксидной пленки.
Al, Fe, Cr, Ni и другие
- при контакте с безводными кислотами сразу же покрываются тонкой оксидной пленкой (пассивируются).
Слайд 30 Помогите расшифровать
Fe +.....→ FeCl2+ H2↑
Na + HCl→ ....+....
Mg + CH3COOH→ H2+ ....
Ca +H3PO4 →...↑+Ca3(PO4)2
Mg + CH3COOH→ H2+ ....
Ca +H3PO4 →...↑+Ca3(PO4)2
Слайд 32 §30, запомнить сильные и слабые кислоты. Домашний эксперимент-стр.171. Используя интернет,
найти области применения кислот.