- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Валентные состояния атома углерода (10 класс)
Содержание
- 1. Презентация Валентные состояния атома углерода (10 класс)
- 2. Проверка Дз
- 3. Актуализация знаний
- 4. Актуализация знаний
- 5. Валентные состояния атома углерода
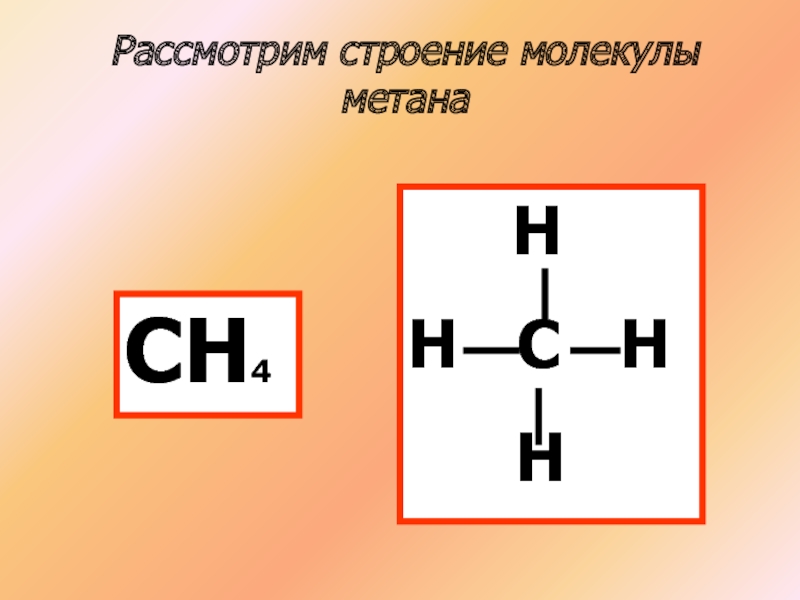
- 6. Рассмотрим строение молекулы метанаСН4 НН С Н Н
- 7. Два «противоречия» в строении метана: Валентность
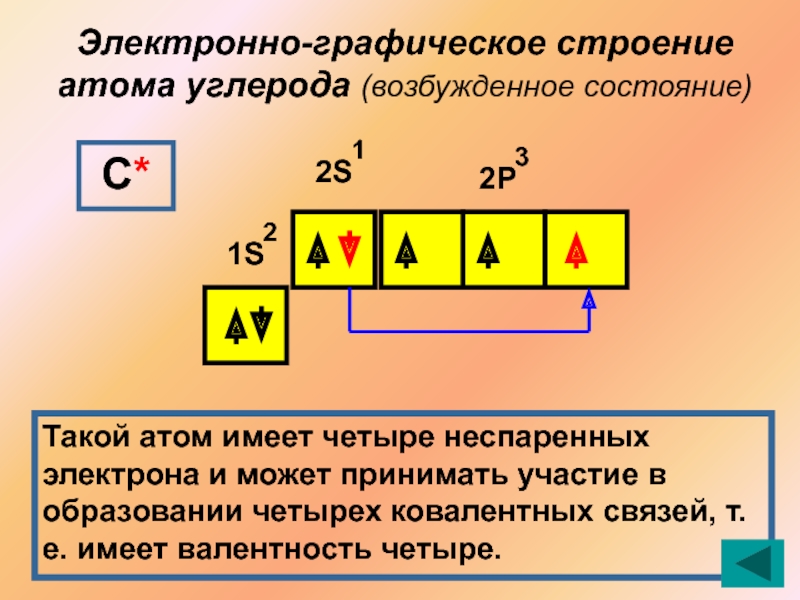
- 8. Электронно-графическое строение атома углерода (возбужденное состояние)1S2S2Р213С*Такой атом
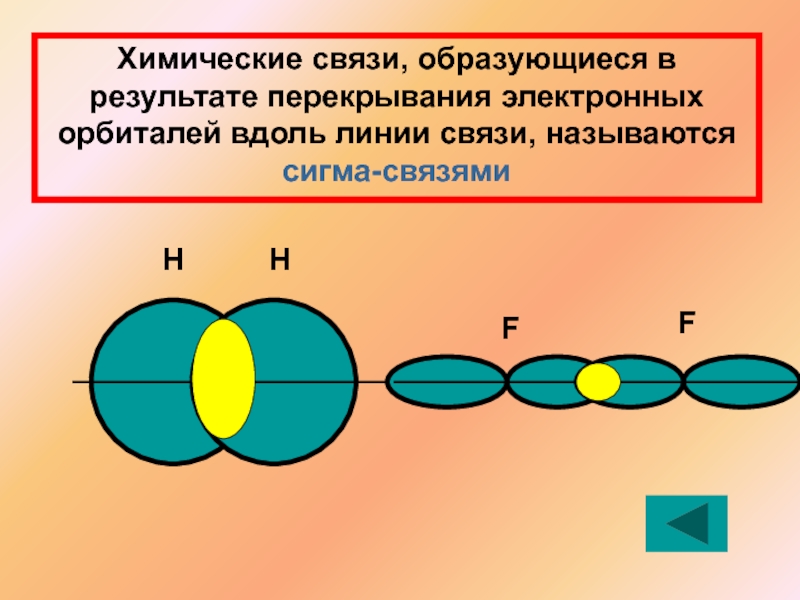
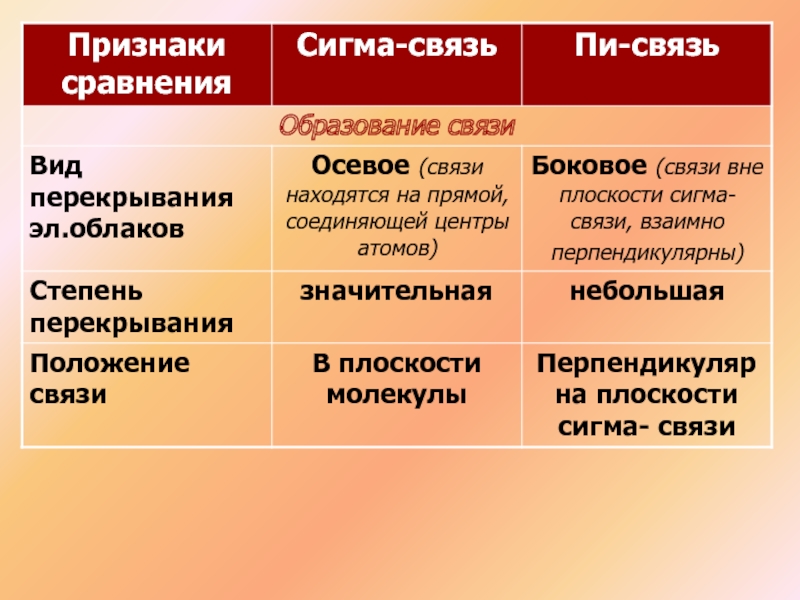
- 9. Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются сигма-связямиННFF
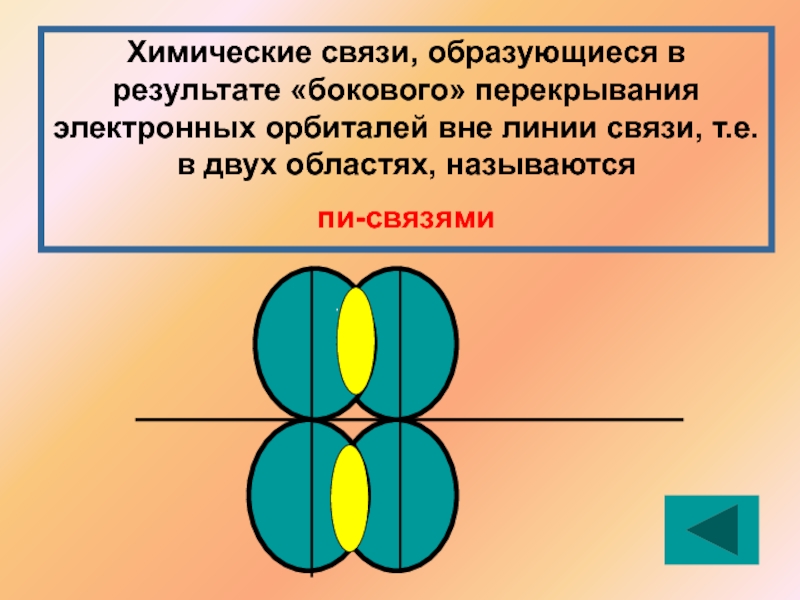
- 10. Химические связи, образующиеся в результате «бокового» перекрывания
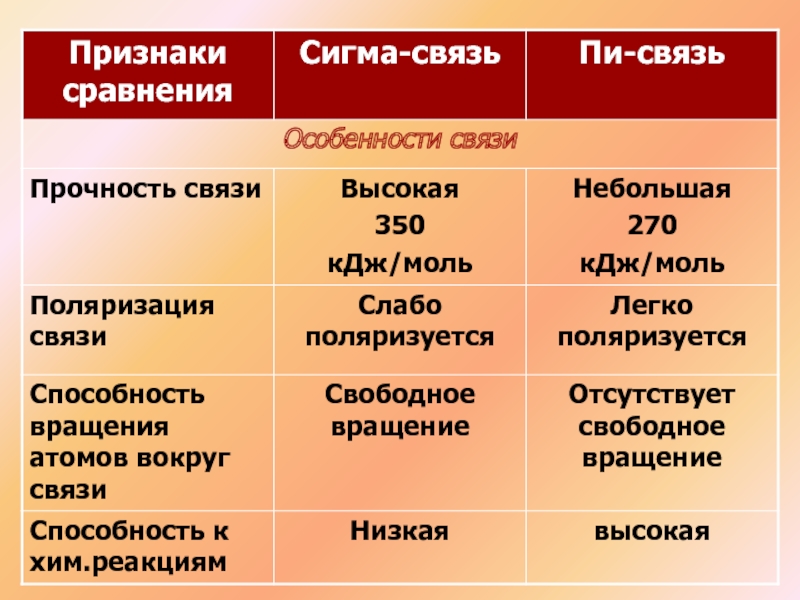
- 11. Связи неравноценны:(сигма) – более прочная(пи) – легче
- 12. Слайд 12
- 13. Слайд 13
- 14. 2 противоречие:В молекуле все четыре связи одинаковые
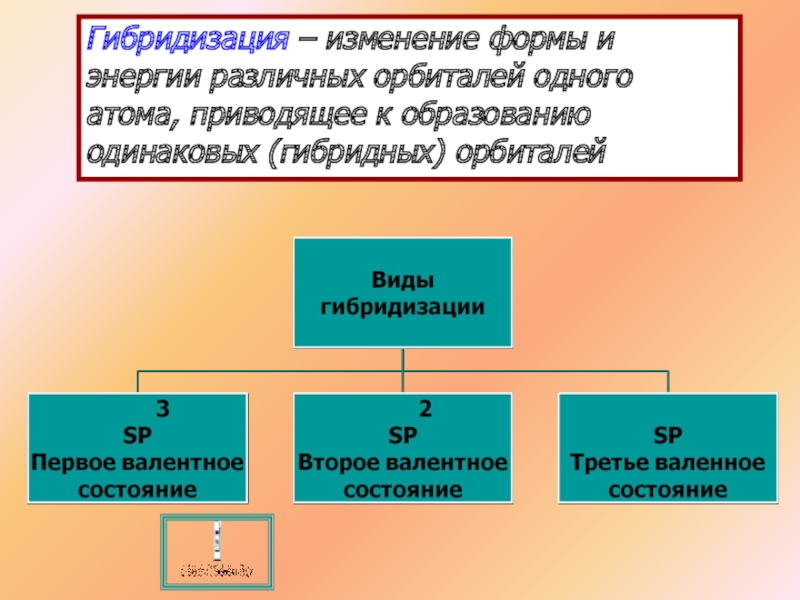
- 15. Гибридизация – изменение формы и энергии различных орбиталей одного атома, приводящее к образованию одинаковых (гибридных) орбиталей
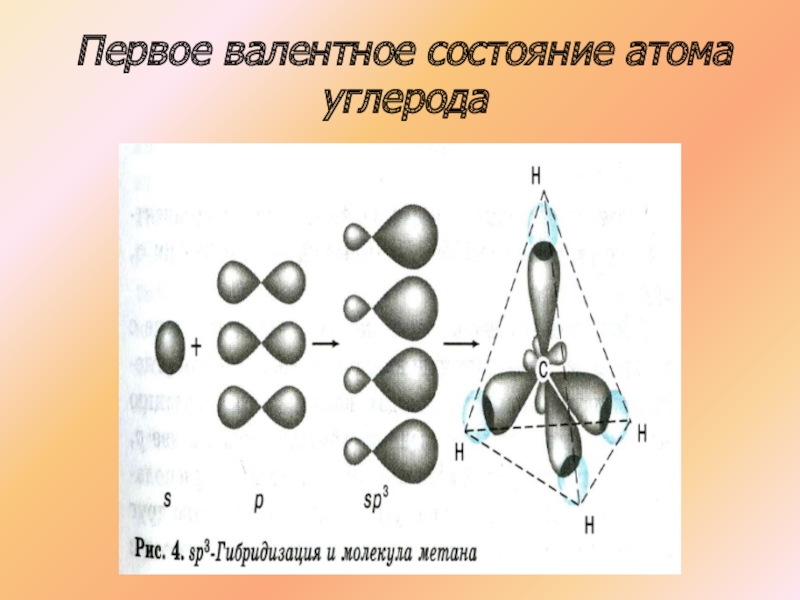
- 16. Первое валентное состояние атома углерода
- 17. Первое валентное состояние атома углерода
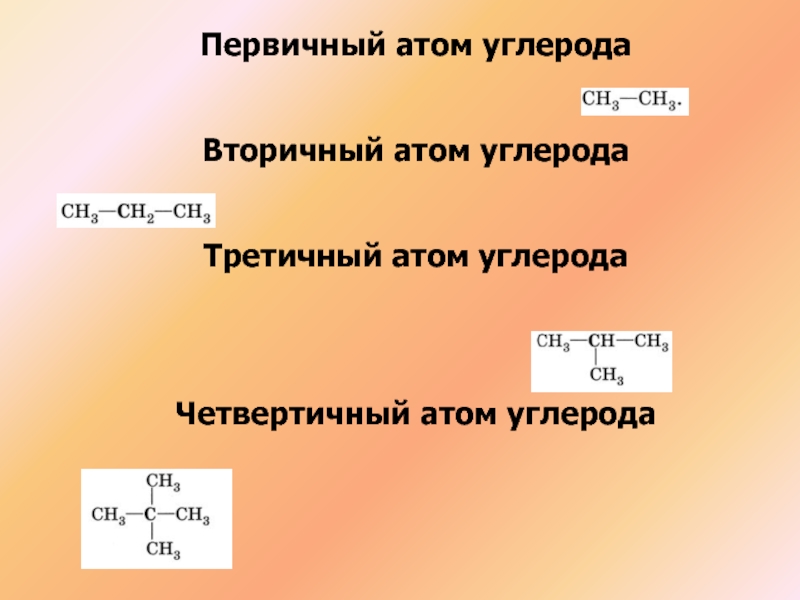
- 18. Первичный атом углеродаВторичный атом углеродаТретичный атом углеродаЧетвертичный атом углерода
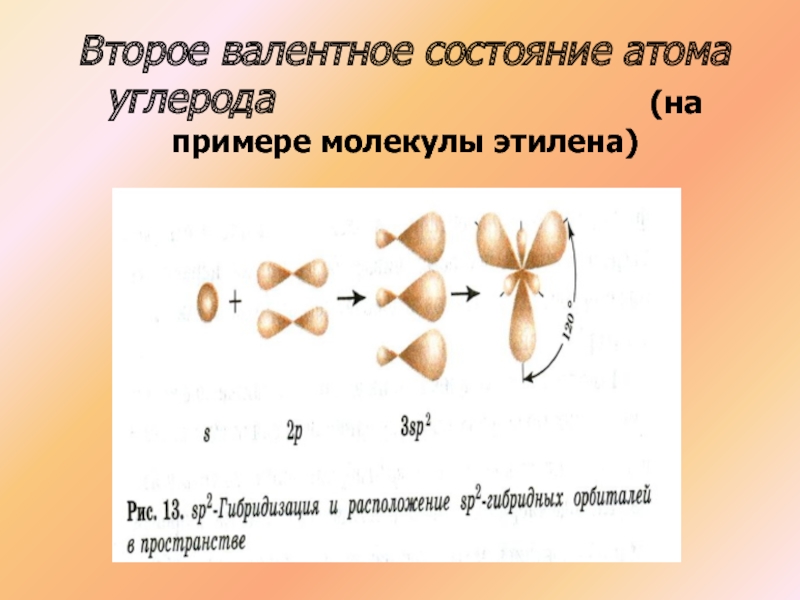
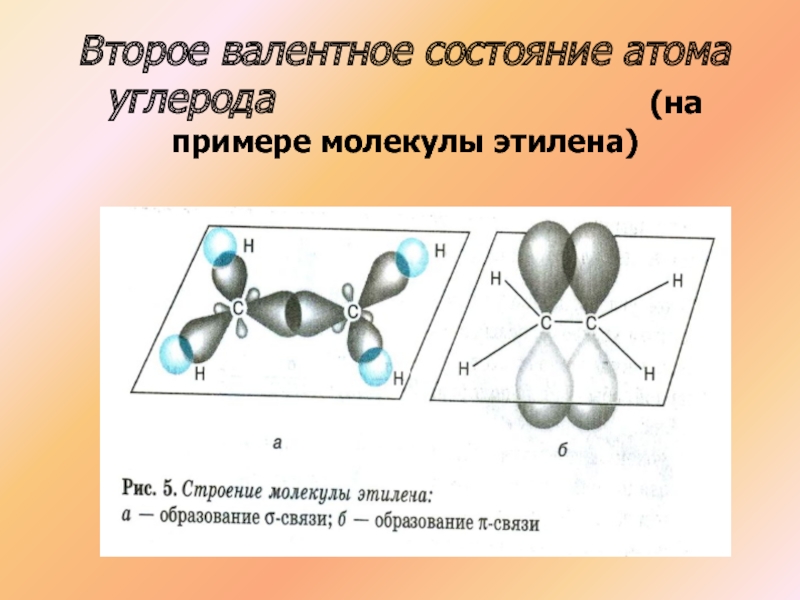
- 19. Второе валентное состояние атома углерода
- 20. Второе валентное состояние атома углерода
- 21. Второе валентное состояние атома углерода
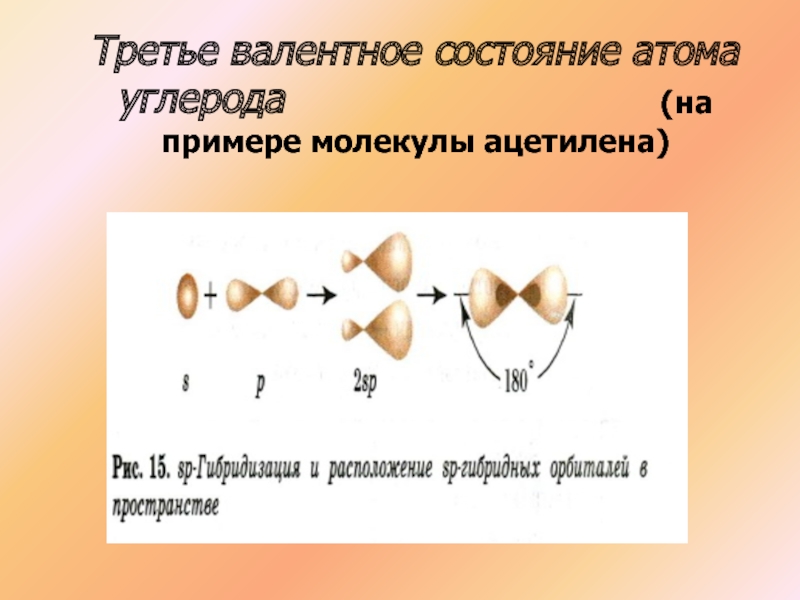
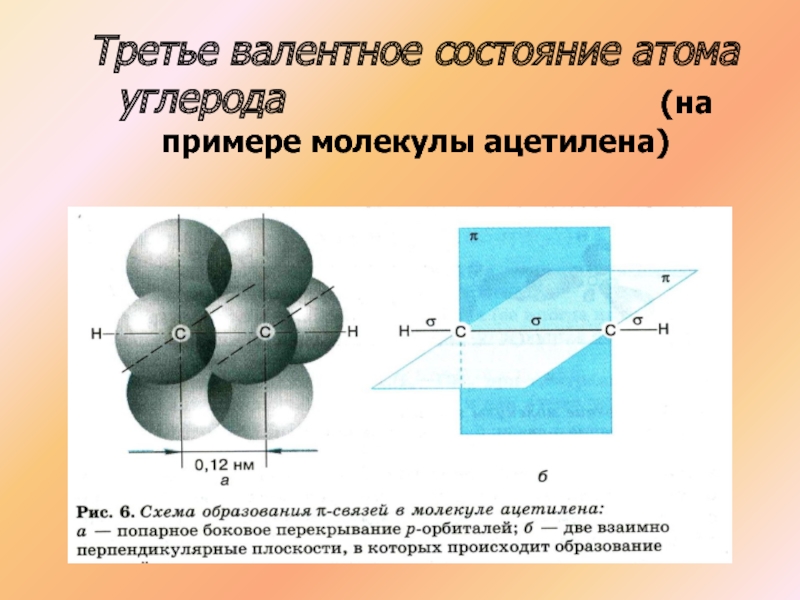
- 22. Третье валентное состояние атома углерода
- 23. Третье валентное состояние атома углерода
- 24. Третье валентное состояние атома углерода
- 25. 32
- 26. Домашнее задание Параграф 3Параграф 4 вопросы 2,3,4Хомченко № 18.1, 18.2, 18.4, 18.5, 18.6, 18.7, 18.8, 18.9
Слайд 7Два «противоречия» в строении метана:
Валентность углерода равна четырем
Решение:
1 противоречие:
Выход в возбужденное состояние атома углерода
Слайд 8Электронно-графическое строение атома углерода (возбужденное состояние)
1S
2S
2Р
2
1
3
С*
Такой атом имеет четыре неспаренных электрона
Слайд 9
Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи,
Н
Н
F
F
Слайд 10
Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии
пи-связями
Слайд 11Связи неравноценны:
(сигма) – более прочная
(пи) – легче рвется, более реакционноспособна, плотность
Слайд 142 противоречие:
В молекуле все четыре связи одинаковые
Решение:
SP гибридизация
3
Слайд 15Гибридизация – изменение формы и энергии различных орбиталей одного атома, приводящее
Слайд 16Первое валентное состояние атома углерода
СН4
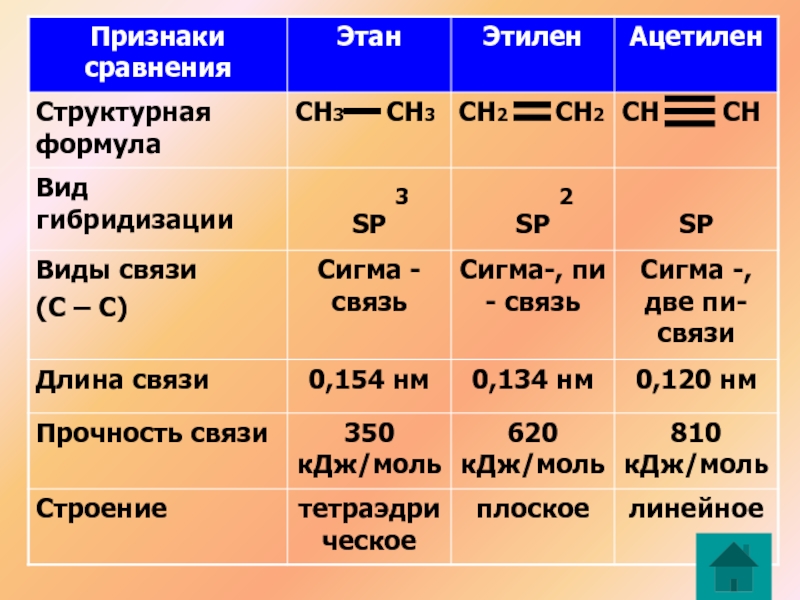
Атомы углерода в молекуле метана образуют одинарные сигма связи, находятся в состоянии SP3 гибридизации
Слайд 18Первичный атом углерода
Вторичный атом углерода
Третичный атом углерода
Четвертичный атом углерода
Слайд 19Второе валентное состояние атома углерода
С2Н4
СН2 СН2
Атомы углерода в молекуле этилена образуют двойную связь, находятся в состоянии SP гибридизации
2
Слайд 22Третье валентное состояние атома углерода
С2Н2
СН СН
Атомы углерода в молекуле ацетилена образуют тройную связь, находятся в состоянии SP гибридизации