- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Трудные вопросы ЕГЭ по химии
Содержание
- 1. Презентация Трудные вопросы ЕГЭ по химии
- 2. «Чтобы избегать ошибок, надо набираться опыта; чтобы набираться опыта, надо делать ошибки».
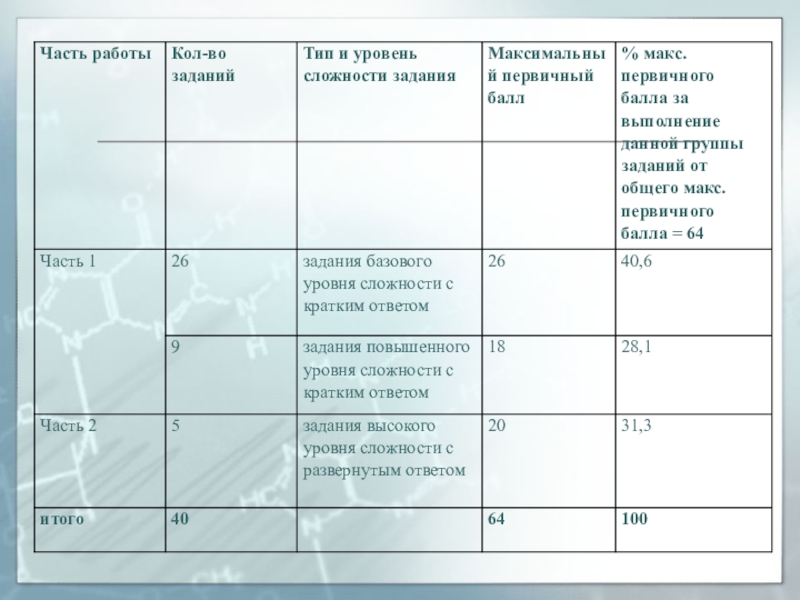
- 3. При проведении итоговой государственной аттестации выпускников основной
- 4. Экзаменационная работа строится с учетом следующих положений:Содержание
- 5. ЕГЭ по химии не является обязательным для сдачи
- 6. Слайд 6
- 7. Анализ результатов выполнения заданий с выбором ответа
- 8. Анализ результатов выполнения заданий с выбором ответа
- 9. Анализ результатов выполнения заданий с выбором ответа
- 10. Строение электронных оболочекВосьмиэлектронную внешнюю оболочку имеет ион1) P3+ 2) S2- 3) Cl5+ 4) Fe3+Ответ: 2
- 11. Характерные химические свойства неорганических веществ различных
- 12. Химическая связь: ковалентная (полярная и
- 13. Зависимость свойств веществ от особенностей их
- 14. Характерные химические свойства неорганических веществ
- 15. Органическая химия Химические свойства основных классов
- 16. Характерные химические свойства неорганических веществ различных классов:
- 17. Органическая химия Химические свойства углеводородов
- 18. Органическая химия Химические свойства основных классов
- 19. Органическая химия Химические свойства углеводородов Для получения
- 20. Анализ результатов выполнения заданий с кратким ответом
- 21. Анализ результатов выполнения заданий с кратким ответом
- 22. Классы неорганических соединений, оксиды Установите соответствие
- 23. №31. Обратимые и необратимые химические реакции. Химическое равновесие.
- 24. Электролиз.
- 25. №32.Качественные реакции на неорганические вещества и
- 26. №32. Установите соответствие между веществами и реагентом,
- 27. №32. Установите соответствие между двумя веществами и
- 28. №32. Установите соответствие между реагирующими веществами и
- 29. Анализ результатов выполнения заданий с развернутым ответом
- 30. Анализ результатов выполнения заданий с развернутым ответом
- 31. Анализ результатов выполнения заданий с развернутым ответом
- 32. №36.Необходимые навыкиРасстановка степеней окисленияЗадавать себе главный вопрос:
- 33. Возможные ошибкиРасстановка степеней окисления:а) степени окисления в
- 34. №36Na2SO3 + KMnO4 + … → …
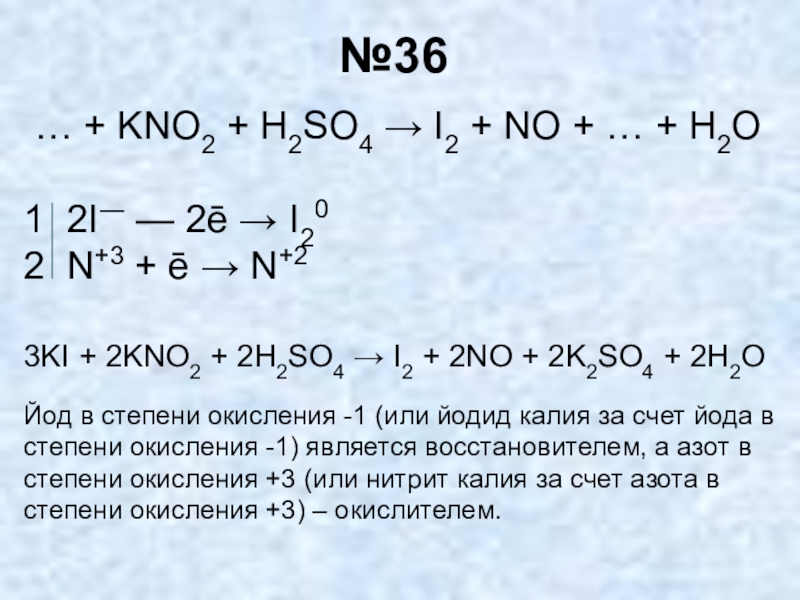
- 35. №36 … + KNO2 + H2SO4 →
- 36. №37. Взаимосвязь различных классов неорганических веществ
- 37. Кристаллическое вещество оранжевого цвета при нагревании значительно
- 38. Слайд 38
- 39. Нитрат меди прокалили, образовавшееся твёрдое вещество растворили
- 40. Элементы ответа:Написаны четыре уравнения возможных реакций между указанными веществами:
- 41. №38. Генетическая связь между основными классами органических веществ
- 42. При решении задания №38«Цепочка органических веществ» учащийся
- 43. Общие свойства классов органических веществОбщие способы получения органических веществСпецифические свойства некоторых конкретных веществОбязательный минимум знаний
- 44. Слайд 44
- 45. Слайд 45
- 46. Типичные ошибки при выполнении задания №38: незнание
- 47. №39. Расчёты по уравнениям реакций
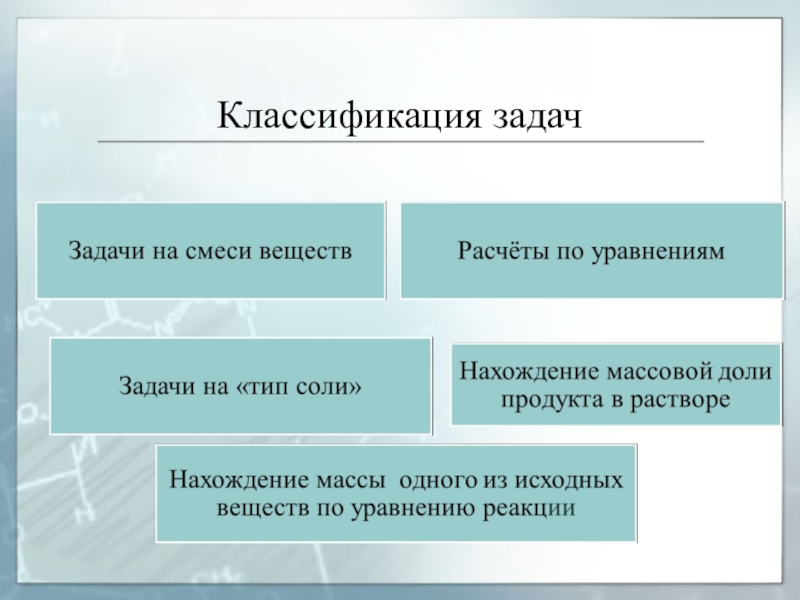
- 48. Классификация задач
- 49. №39.Расчёты по уравнениям реакций.Газ, выделившийся при взаимодействии
- 50. №39.Задачи на смеси веществНа нейтрализацию 7,6 г
- 51. №39. Определение состава продукта реакции (задачи на
- 52. №39. Нахождение массовой доли одного из продуктов
- 53. №39.Нахождение массы одного из исходных веществ по
- 54. №40. Вывод молекулярной формулы вещества
- 55. Вывод формул
- 56. Слайд 56
- 57. №40. При сжигании образца некоторого органического соединения
- 58. Слайд 58
- 59. №40. При полном сгорании образца ацетиленового
- 60. Слайд 60
- 61. Спасибо за внимание
Слайд 1Трудные вопросы ЕГЭ по химии.
Учитель химии МБОУ СОШ
Колюко Н.А.
Слайд 3 При проведении итоговой государственной аттестации выпускников основной школы в форме письменного
Слайд 4Экзаменационная работа строится с учетом следующих положений:
Содержание экзаменационной работы определяется на
Содержание заданий ориентированы на проверку усвоения содержания всех ведущих тем курса химии основной школы и должны быть различного уровня сложности (базовый, повышенный и высокий уровни).
Тип и сложность каждого задания должны соответствовать требованиям стандарта к уровню усвоения проверяемого понятия, а содержание задания – тому виду деятельности, которую нужно осуществить при его выполнении.
Во всех вариантах экзаменационной работы нужно использовать задания одинакового уровня сложности.
При выполнении экзаменационной работы выпускникам необходимо не только вспомнить известные им факты и понятия, но и осуществить определенные виды деятельности: выявлять существенное, объяснять, рассуждать и т.д.
Слайд 5
ЕГЭ по химии не является обязательным для сдачи на выпускных экзаменах в
В 2016 году ЕГЭ по химии остается на 7-м месте по популярности среди выпускников, 3,5% сдававших в этом году выбрали экзамен по химии в качестве дополнительного. С каждым годом экзамен дается труднее, процент не сдавших растет, а средний балл опускается ниже.
Слайд 7Анализ результатов выполнения заданий с выбором ответа (часть 1)
Трудности при установлении
Непониманием терминов «молекулярное» и «немолекулярное» строение, неумение мыслить «от противного», осуществлять корреляцию строения и свойств вещества
Слайд 8Анализ результатов выполнения заданий с выбором ответа (часть 1)
Прогнозирование возможности реакции
Неумение выпускников устанавливать причинно-следственные связи между принадлежностью вещества к определенному классу соединений и его химическими свойствами.
Слайд 9Анализ результатов выполнения заданий с выбором ответа (часть 1)
Трудность определения числа
Незнание одного из основных правил – правило В.В.Марковникова, а также неумение прогнозировать результат реакции.
Слайд 10Строение электронных оболочек
Восьмиэлектронную внешнюю оболочку имеет ион
1) P3+ 2) S2- 3)
Ответ: 2
Слайд 11 Характерные химические свойства неорганических веществ различных классов: простых веществ –
Верны ли следующие суждения о неметаллах?
А. В периодической системе неметаллы расположены в правой, преимущественно верхней части.
Б. Среди неметаллов нет ни одного d- элемента.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: 3
Слайд 12 Химическая связь: ковалентная (полярная и неполярная). Длина и энергия связи
В молекуле какого вещества длина связи между атомами углерода наибольшая?
1) ацетилена 2) этана
3) этена 4) бензола
Ответ: 2
Слайд 13
Зависимость свойств веществ от особенностей их кристаллической решетки
Вещества твердые, прочные,
1) металлическую 2) молекулярную 3) атомную 4) ионную
Ответ: 4
Слайд 14 Характерные химические свойства неорганических веществ различных классов: солей (средних и
С водными растворами хлороводорода, гидроксида бария и хлорида меди(II) реагирует
1) CaCO3 2) K2SO3
3) Na2SO4 4) Al2(SO4)3
Ответ: 2
Слайд 15Органическая химия
Химические свойства основных классов
С раствором NaOH не реагирует
1) С6Н5СООН 2) С6Н5ОН
3) С2Н5СООН 4) С2Н5ОН
Ответ: 4
Слайд 16Характерные химические свойства неорганических веществ различных классов: солей (средних и кислых)
Карбонат
1)гидроксидом бария
2) гидроксидом калия
3) серной кислотой
4) углекислым газом
Ответ: 2
Слайд 17Органическая химия
Химические свойства углеводородов
При взаимодействии бутина-1 с водой в
1) бутанол-1 2) бутанол-2
3) бутаналь 4) бутанон
Ответ: 4
Слайд 18Органическая химия
Химические свойства основных классов органических веществ
Метиламин реагирует с
1) O2 и N2 2) FeCl2 и NH3
3) НС1 и NaCl 4) Н2O и H2SO4
Ответ: 4
Слайд 19Органическая химия
Химические свойства углеводородов
Для получения бутена-2 из 2-бромбутана следует использовать
1) водный
2) водный раствор гидроксида калия
3) спиртовой раствор гидроксида калия при нагревании
4) никелевый катализатор
Ответ: 3
Слайд 20Анализ результатов выполнения заданий с кратким ответом (часть 1)
Плохая ориентация в
Неумение определять характер среды при гидролизе веществ, заданных названиями, а не формулами
Слайд 21Анализ результатов выполнения заданий с кратким ответом (часть 1)
Недостаточный уровень
Уровень освоения стандарта образования, связанный с химическими свойствами органических веществ, как показали результаты экзамена, низкий.
Слайд 22Классы неорганических соединений, оксиды
Установите соответствие между названием оксида и
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид кремния(IV) 1) Al, H2SO4, CO
Б) оксид азота(IV) 2) Fe2O3, H2O, NH3
В) оксид бария 3) С, КОН, СаСО3
Г) оксид железа(III) 4) NaOH, H2O, СаО .
5) Н2О, SO3, Н3РО4 .
6) Н2О, HNO3, Са(ОН)2
Правильный ответ: 3451
Слайд 25№32.Качественные реакции на неорганические вещества
и ионы. Качественные реакции органических соединений
Качественные
Анализируемые вещества могут находиться в различных агрегатных состояниях (твёрдом, жидком и газообразном). С точки зрения наблюдаемых эффектов все реакции обнаружения можно разделить на несколько групп:
1) образование характерных осадков,
2) растворение вещества,
3) появление (изменение) окраски,
4) выделение газов,
5) изменение запаха,
6) окрашивание пламени.
Слайд 26№32. Установите соответствие между веществами и реагентом, с помощью которого можно
А – 5
Б – 1
В – 2
Г – 3
Слайд 27№32. Установите соответствие между двумя веществами и реактивом, с помощью которого
А – 2
Б – 3
В – 2
Г – 2
Слайд 28№32. Установите соответствие между реагирующими веществами и признаком реакции, которая протекает
А – 2
Б – 5
В – 1
Г – 5
Слайд 29Анализ результатов выполнения заданий с развернутым ответом (часть 2)
Ошибки в определении
Затруднения при написании уравнений возможных реакций, в которых принимали участие соединения хрома.
Затруднения в определении избытка одного из веществ и при вычислении массы получившегося раствора с учетом выделившегося в процессе реакции газа.
Слайд 30Анализ результатов выполнения заданий с развернутым ответом (часть 2)
Трудности в составлении
Слайд 31Анализ результатов выполнения заданий с развернутым ответом (часть 2)
Затруднения в определении
Неумение применять знания в изменившейся ситуации.
Слайд 32№36.Необходимые навыки
Расстановка степеней окисления
Задавать себе главный вопрос: кто в этой реакции
Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция. если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая.
Проверьте, чтобы в реакции был и окислитель, и восстановитель
Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Слайд 33Возможные ошибки
Расстановка степеней окисления:
а) степени окисления в водородных соединениях неметаллов: фосфин
б) в органических веществах — проверьте ещё раз, всё ли окружение атома С учтено в) аммиак и соли аммония — в них азот всегда имеет степень окисления −3
в) кислородные соли и кислоты хлора — в них хлор может иметь степень окисления +1, +3, +5, +7;
г) двойные оксиды: Fe3O4, Pb3O4 — в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов.
Слайд 34№36
Na2SO3 + KMnO4 + … → … + MnO2 + KOH
3 S+4 — 2ē → S+6
2 Mn+7 + 3ē → Mn+4
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
Сера в степени окисления +4 (или сульфит натрия за счет серы в степени окисления +4) является восстановителем, а марганец в степени окисления +7 (или перманганат калия за счет марганца в степени окисления +7) – окислителем.
Слайд 35№36
… + KNO2 + H2SO4 → I2 + NO +
1 2I― — 2ē → I20
2 N+3 + ē → N+2
3KI + 2KNO2 + 2H2SO4 → I2 + 2NO + 2K2SO4 + 2H2O
Йод в степени окисления -1 (или йодид калия за счет йода в степени окисления -1) является восстановителем, а азот в степени окисления +3 (или нитрит калия за счет азота в степени окисления +3) – окислителем.
Слайд 37
Кристаллическое вещество оранжевого цвета при нагревании значительно увеличивается в объёме за
Слайд 39
Нитрат меди прокалили, образовавшееся твёрдое вещество растворили в разбавленной серной кислоте.
Слайд 40
Элементы ответа:
Написаны четыре уравнения возможных реакций между указанными веществами:
Слайд 42
При решении задания №38«Цепочка органических веществ» учащийся должен написать пять уравнений
Слайд 43Общие свойства классов органических веществ
Общие способы получения органических веществ
Специфические свойства некоторых
Обязательный минимум знаний
Слайд 46Типичные ошибки при выполнении задания №38:
незнание условий протекания химических реакций,
незнание механизмов, сущности и условий реакций с участием органических веществ, свойств и формул органических соединений;
неумение предсказать свойства органического соединения на основе представлений о взаимном влиянии атомов в молекуле;
незнание окислительно-восстановительных реакций (например, с перманганатом калия).
Слайд 49№39.Расчёты по уравнениям реакций.
Газ, выделившийся при взаимодействии 110 мл 18 %
Слайд 50№39.Задачи на смеси веществ
На нейтрализацию 7,6 г смеси муравьиной и уксусной
Слайд 51№39. Определение состава продукта реакции (задачи на «тип соли»)
Аммиак объёмом 4,48
Слайд 52№39. Нахождение массовой доли одного из продуктов реакции в растворе по
Оксид, образовавшийся при сжигании 18,6 г фосфора в 44,8 л (н.у.) кислорода, растворили в 100 мл дистиллированной воды. Рассчитайте массовую долю ортофосфорной кислоты в полученном растворе.
Слайд 53№39.Нахождение массы одного из исходных веществ по уравнению материального баланса
Слайд 57№40. При сжигании образца некоторого органического соединения массой 14,8 г получено
На основании данных условия задания:
1) произведите необходимые вычисления;
2) установите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с оксидом меди(II).