- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Система подготовки учащихся к олимпиаде по химии
Содержание
- 1. Презентация Система подготовки учащихся к олимпиаде по химии
- 2. ЦельФормировать образовательную среду на основе интеграции базового
- 3. урокВнеурочная деятельностьОбщешкольные мероприятияДистанционное обучениеСистема элективных курсовЛаборатория
- 4. Система работы на уроке1 Использование изобретательских задач2
- 5. Слайд 5
- 6. Задача 1. Даны НNО3 ( одноосновная), Н2SО4(
- 7. Принципы решения задачи открытого типасвобода выбора (
- 8. Установите формулу предельной карбоновой кислоты, калиевая соль
- 9. Неизвестный металл массой 13,5 грамм вступил в
- 10. Массовая доля атомов хлора в газовой смеси,
- 11. Второй способ решенияПусть вся смесь равна 100грамм.Тогда
- 12. В раствор сульфата меди, объёмом 250 мл
- 13. Второй способ решенияСоставим уравнение: Fe + CuSO4
- 14. 4,1 гр смеси этилена и ацетилена способно
- 15. Второй способИз уравнений реакций видно, что 1
- 16. Третий способ решения.х
- 17. Творческая лаборатория «Пытливый ум» НОУ «Эрудит»* решение
- 18. Список элективных курсов в рамках предпрофильной подготовки и профильного обучения.2013-2014
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Дистанционные курсы
- 33. Слайд 33
- 34. Слайд 34
- 35. Система подготовки учащихся к олимпиадам и конкурсам
- 36. Слайд 36
- 37. Слайд 37
- 38. Слайд 38
- 39. Слайд 39
- 40. Средний балл по ЕГЭ2003 – 2004
- 41. Читинский политехнический институтНовосибирский Государственный университетТомский Государственный университетКрасноярский
ЦельФормировать образовательную среду на основе интеграции базового и дополнительного образования, способствующую созданию условий для интеллектуального и личностного развития учащихся.
Слайд 2Цель
Формировать образовательную среду на основе интеграции базового и дополнительного образования, способствующую
созданию условий для интеллектуального и личностного развития учащихся.
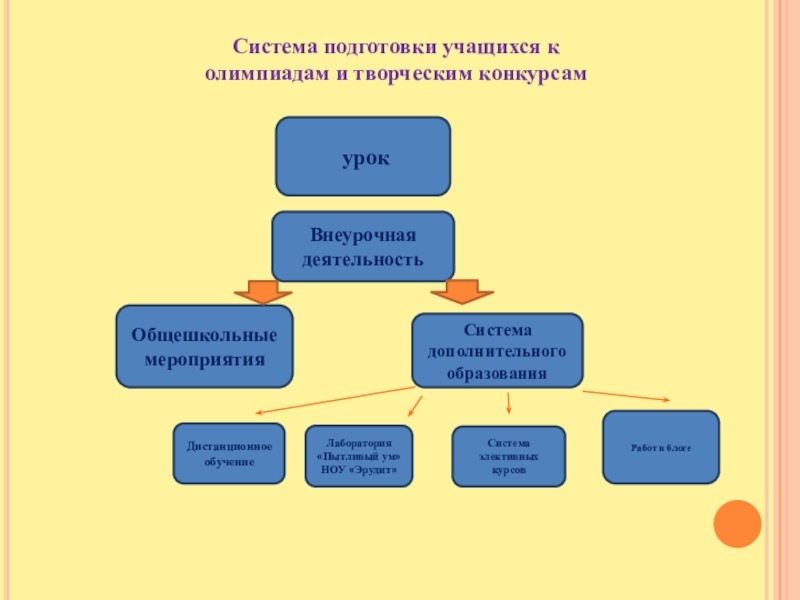
Слайд 3 урок
Внеурочная деятельность
Общешкольные мероприятия
Дистанционное обучение
Система элективных курсов
Лаборатория «Пытливый ум» НОУ «Эрудит»
Система
дополнительного образования
Работ в блоге
Система подготовки учащихся к олимпиадам и творческим конкурсам
Слайд 4Система работы на уроке
1 Использование изобретательских задач
2 Использование задач на составление
определений и формулировок
3 Использование практических творческих задач.
4 Решение задач с обязательным выстраиванием логики решения
5 Использование задач повышенной сложности, используя дифференцированный подход, различные способы решения.
6 Составление задач
3 Использование практических творческих задач.
4 Решение задач с обязательным выстраиванием логики решения
5 Использование задач повышенной сложности, используя дифференцированный подход, различные способы решения.
6 Составление задач
Слайд 6Задача 1.
Даны НNО3 ( одноосновная), Н2SО4( двухосновная), Н3РО4 ( трёхосновная)
кислоты. Сформулируйте определение основных кислот
Задача 2.
Предложите способ классификации следующих соединений Н2SО4, H2O, SO3, NH3, КJ, КОН, HCL.
Задача 2.
Предложите способ классификации следующих соединений Н2SО4, H2O, SO3, NH3, КJ, КОН, HCL.
Слайд 7Принципы решения задачи открытого типа
свобода выбора ( ученик сам « ведёт
себя», выбирая что решит сейчас, а что потом)
открытости ( ученику важно показать соотношение их области знаний с областью научного знания и областью неизученного)
деятельности ( расскажи – покажи – вовлеки), обратной связи ( личностно – ориентированная модель общения и обучения)
идеальности (идеальный конечный результат )
открытости ( ученику важно показать соотношение их области знаний с областью научного знания и областью неизученного)
деятельности ( расскажи – покажи – вовлеки), обратной связи ( личностно – ориентированная модель общения и обучения)
идеальности (идеальный конечный результат )
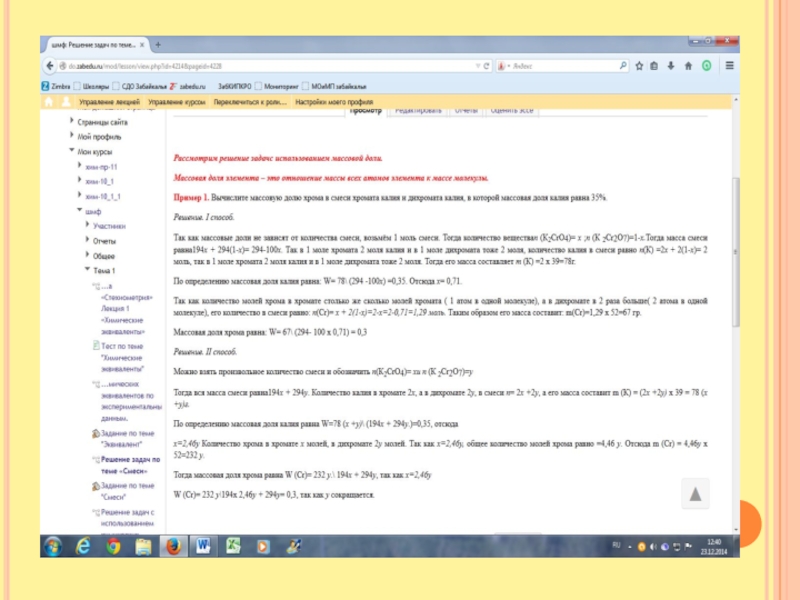
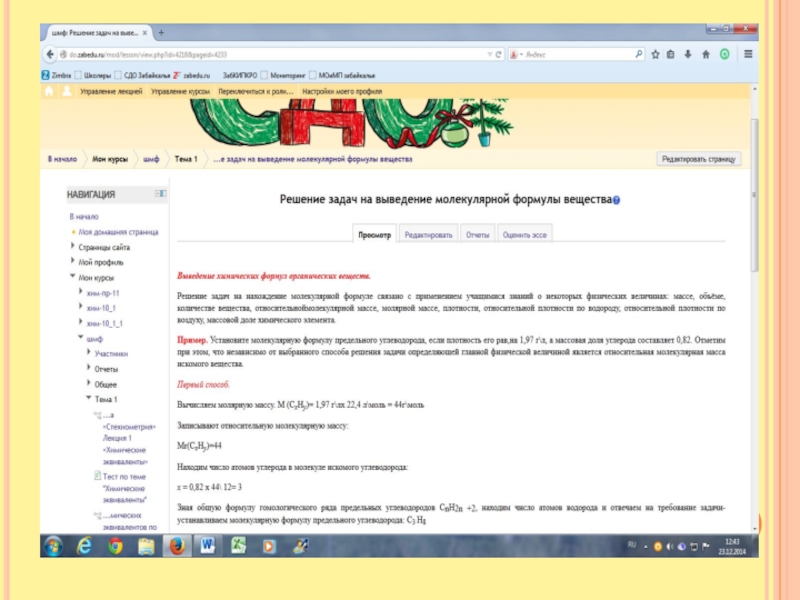
Слайд 8Установите формулу предельной карбоновой кислоты, калиевая соль которой содержит 28, 57%
кислорода. 28,75 % - это массовая доля.
Задаём вопрос Что такое массовая доля. Часть от целого. Речь идёт о массовой доле. Следовательно, часть – это масса кислорода, а целое – это масса молекулы. Кислота предельная. Общая формула: СnH2n+1COOH, её соль СnH2n+1COOК
0, 2857= 32\12х+ 2х +1 +12+32+39
0,2857=32\14х +84
14х+84=32\0,2857
14х= 28 х=2 Кислота С2Н5СООН
Задаём вопрос Что такое массовая доля. Часть от целого. Речь идёт о массовой доле. Следовательно, часть – это масса кислорода, а целое – это масса молекулы. Кислота предельная. Общая формула: СnH2n+1COOH, её соль СnH2n+1COOК
0, 2857= 32\12х+ 2х +1 +12+32+39
0,2857=32\14х +84
14х+84=32\0,2857
14х= 28 х=2 Кислота С2Н5СООН
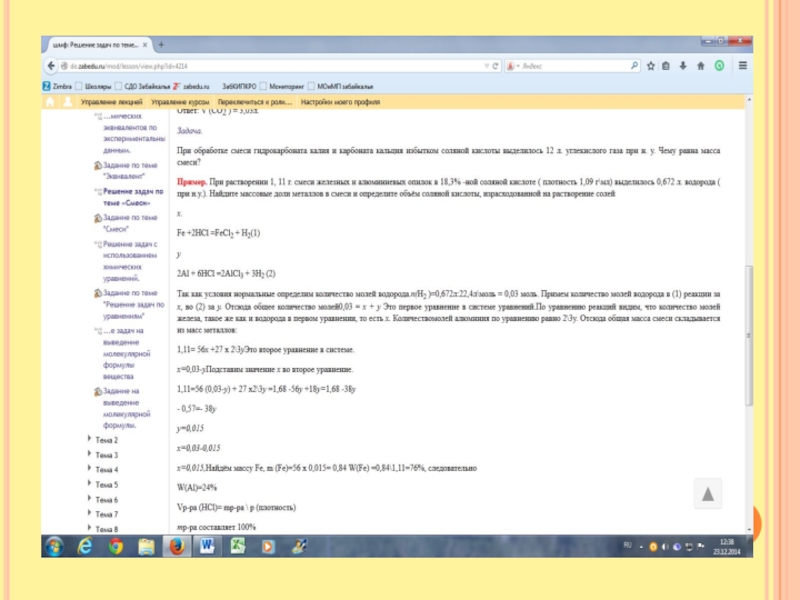
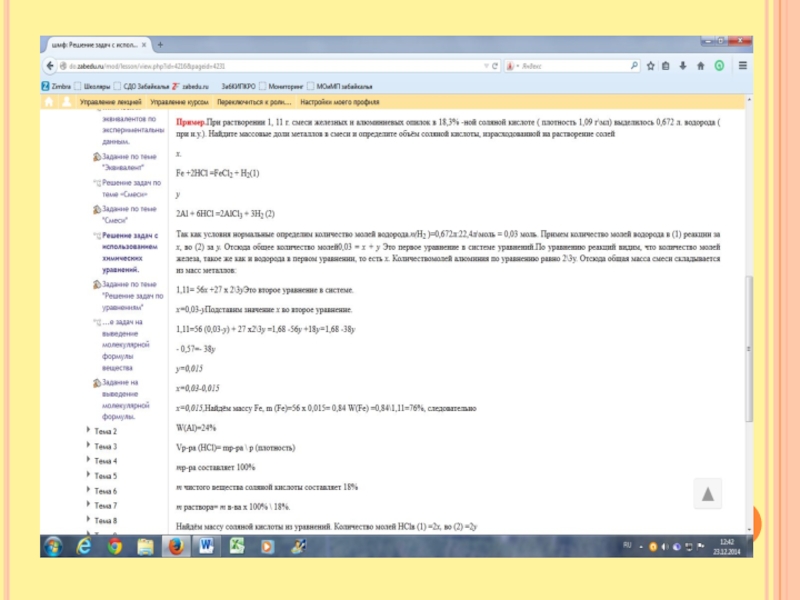
Слайд 9Неизвестный металл массой 13,5 грамм вступил в реакцию с 16,8 л.
(н.у.) хлора Определите неизвестный металл.
2Ме + nCl2= 2MeCln
Нам дан объём хлора. Задаём вопрос Что такое объём? Объём всех молей. Знаем объём всех и объём одного, что найдём? Сколько молей. 16,8л\22,4 моль\л=0,75 моль Нам известна масса металла. Что такое масса? Это масса всех молей. Если бы мы знали сколько молей содержится в этой массе. Мы бы нашли массу одного моля и определили металл по таблице. У нас есть уравнение. Что оно показывает? Соотношение частиц. По равнению соотношение 2: n Известно, что количество молей хлора равно 0,75 Составим пропорцию
2 - n
X - 0,75 х = 0,752\n =1,5n
Мы знаем массу вех молей металла, мы знаем сколько молей, найдём массу одного моля. М (Ме) = 13,5\1,5\n=9n, где n это валентность. Подберём по таблице. Это алюминий
2Ме + nCl2= 2MeCln
Нам дан объём хлора. Задаём вопрос Что такое объём? Объём всех молей. Знаем объём всех и объём одного, что найдём? Сколько молей. 16,8л\22,4 моль\л=0,75 моль Нам известна масса металла. Что такое масса? Это масса всех молей. Если бы мы знали сколько молей содержится в этой массе. Мы бы нашли массу одного моля и определили металл по таблице. У нас есть уравнение. Что оно показывает? Соотношение частиц. По равнению соотношение 2: n Известно, что количество молей хлора равно 0,75 Составим пропорцию
2 - n
X - 0,75 х = 0,752\n =1,5n
Мы знаем массу вех молей металла, мы знаем сколько молей, найдём массу одного моля. М (Ме) = 13,5\1,5\n=9n, где n это валентность. Подберём по таблице. Это алюминий
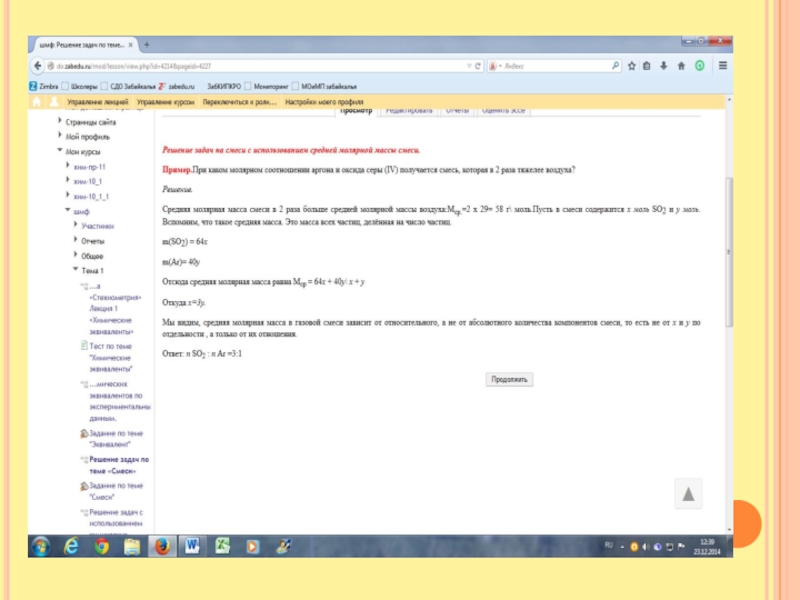
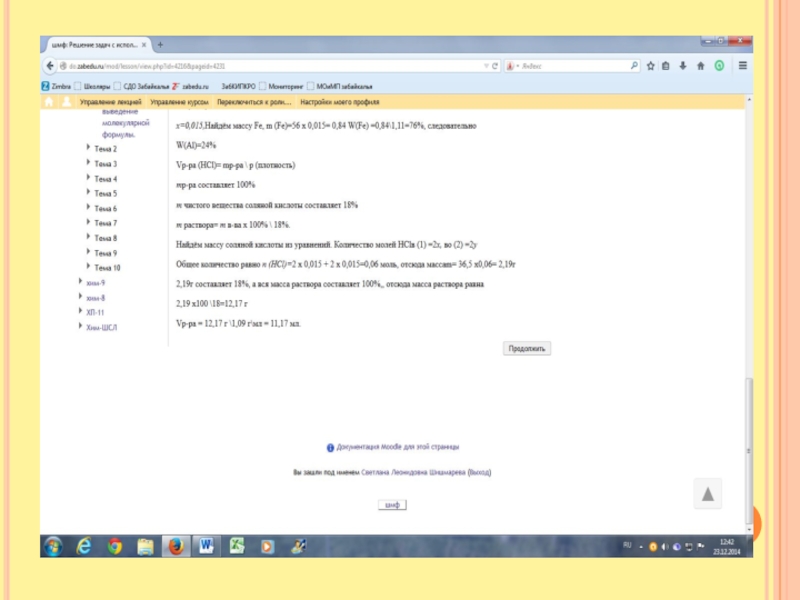
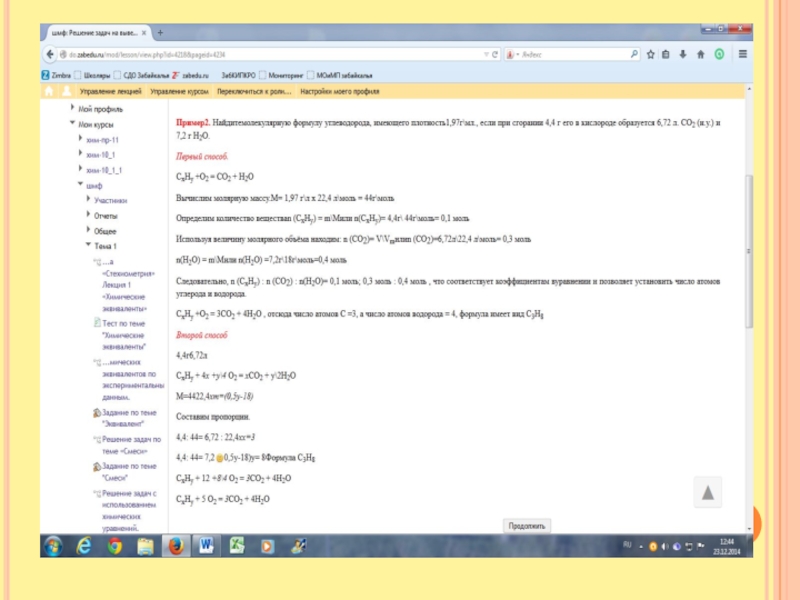
Слайд 10Массовая доля атомов хлора в газовой смеси, состоящей из хлороводорода и
фтороводорода равна 35,5% Определить относительную плотность газовой смеси по водороду.
Первый способ решения
Задаём вопрос Что такое массовая доля. Это часть от целого. То есть масса всех атомов хлора делится на массу всех молекул хлороводорода и фтороводорода. Но мы не знаем их массу. Задаём вопрос Что такое масса. Это масса всех молей. Мы не знаем сколько молей хлороводорода и фтороводорода. Примем за х и у. х- количество молей НCl, y –количество молей НF Отсюда масса всех молей m( НCl)= 36,5х, масса всех молей m(НF) =20у
На одну молекулу приходится один атом хлора, отсюда количество хлора соответственно равно х. Отсюда массовая доля 0,355 = 35,5 х \36,5х + 20у Pешаем, получим
20у=63,5х Отсюда получается соотношение у: х = 63,5 :20, то есть у=3,175, х=1
Найдём массу НСl=36,5х1=36,5гр. Найдём массу НF=20х3,175=63,5 Общая масса смеси=63,5+36,5=100гр, Найдём массу одного моля смеси. Массу всей смеси разделим на количество молей М смеси = 100гр\4,175 =24 гр\моль
Отсюда относительная плотность по водороду = 24\2 =12
Первый способ решения
Задаём вопрос Что такое массовая доля. Это часть от целого. То есть масса всех атомов хлора делится на массу всех молекул хлороводорода и фтороводорода. Но мы не знаем их массу. Задаём вопрос Что такое масса. Это масса всех молей. Мы не знаем сколько молей хлороводорода и фтороводорода. Примем за х и у. х- количество молей НCl, y –количество молей НF Отсюда масса всех молей m( НCl)= 36,5х, масса всех молей m(НF) =20у
На одну молекулу приходится один атом хлора, отсюда количество хлора соответственно равно х. Отсюда массовая доля 0,355 = 35,5 х \36,5х + 20у Pешаем, получим
20у=63,5х Отсюда получается соотношение у: х = 63,5 :20, то есть у=3,175, х=1
Найдём массу НСl=36,5х1=36,5гр. Найдём массу НF=20х3,175=63,5 Общая масса смеси=63,5+36,5=100гр, Найдём массу одного моля смеси. Массу всей смеси разделим на количество молей М смеси = 100гр\4,175 =24 гр\моль
Отсюда относительная плотность по водороду = 24\2 =12
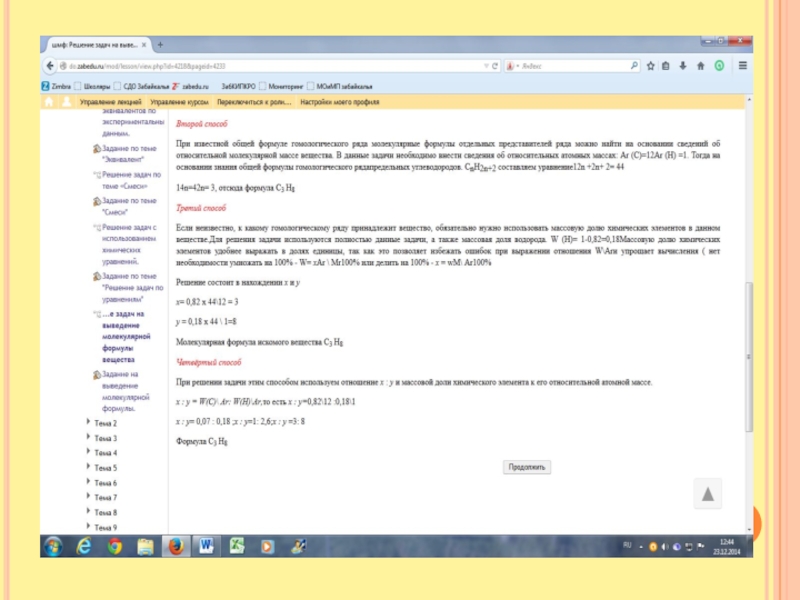
Слайд 11Второй способ решения
Пусть вся смесь равна 100грамм.
Тогда зная массовую долю хлора
определим его массу.
0, 355= х\100 Отсюда масса хлора равна = 35,5 грамм.
Зная массу определим количество =1моль. Зная количество хлора, зная , что в молекуле хлороводорода один атом, определим количество молей хлороводорода. Оно равно=1молю и массу хлороводорода . она равна 36,5гр. Найдём массу фтороводорода. 100-36,5гр =63,5гр Найдём количество молей 63,5\20=3,175. Общее количество молей =4,175. Отсюда, зная массу всех молей, количество молей, найдём массу одного моля.= 100\4,175= 24моль. Плотность по водороду = 24\2=12
0, 355= х\100 Отсюда масса хлора равна = 35,5 грамм.
Зная массу определим количество =1моль. Зная количество хлора, зная , что в молекуле хлороводорода один атом, определим количество молей хлороводорода. Оно равно=1молю и массу хлороводорода . она равна 36,5гр. Найдём массу фтороводорода. 100-36,5гр =63,5гр Найдём количество молей 63,5\20=3,175. Общее количество молей =4,175. Отсюда, зная массу всех молей, количество молей, найдём массу одного моля.= 100\4,175= 24моль. Плотность по водороду = 24\2=12
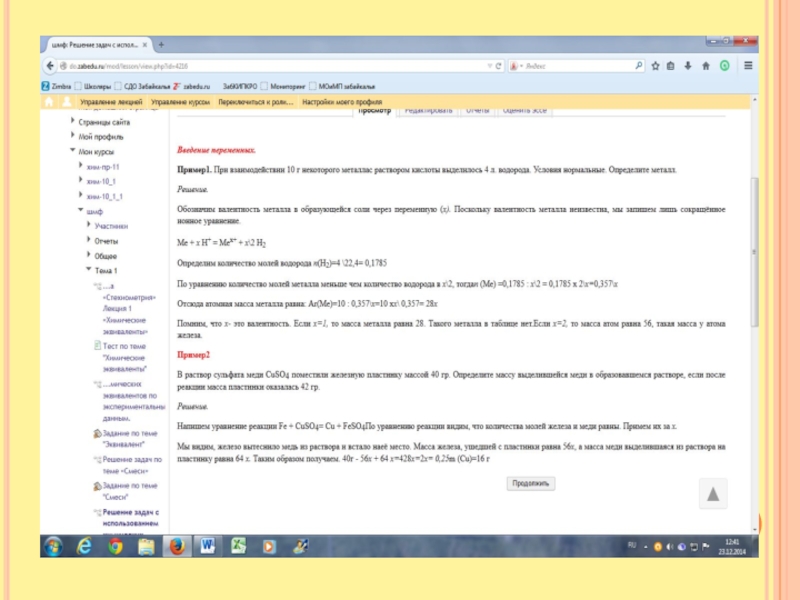
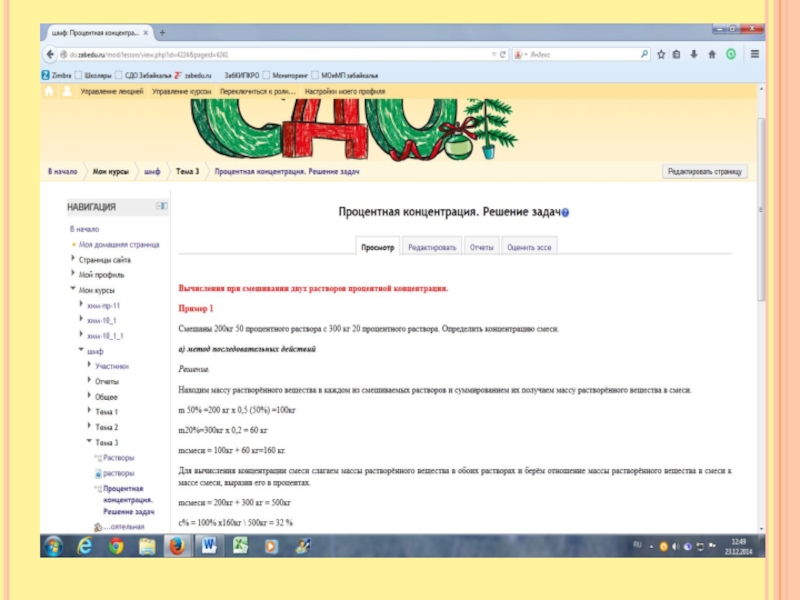
Слайд 12В раствор сульфата меди, объёмом 250 мл поместили железную пластинку массой
40 гр. Определите массу выделившейся меди и молярную концентрацию сульфата железа двухвалентного в образовавшемся растворе, если после реакции масса пластинки оказалась равной 42 гр.
Первый способ решения.
Составим уравнение: Fe + CuSO4 = FeSO4 + Cu
По уравнению реакции мы видим, что соотношение молекул меди и железа равно. 1:1.
То есть исходя из молярной массы 56:64. То есть разница в массе равна 64-56=8. По условию задачи масса пластинки увеличилась на 2грамма 42-40=2гр. Найдём массу выделившейся меди.
Составим пропорцию
При увеличении массы на 8 грамм выделяется 64т гр меди
При увеличении массы на 2 гр. выделяется х гр. меди.
Х= 16гр. По уравнению реакции мы видим, что количество меди и сульфата железа равно. n(Cu)b (FeSO4)= 16гр\64гр.\моль = 0,25 моль. Молярная концентрация показывает сколько молей содержится в 1 литре. Если в 250мл содержится 0,25моль, то в 1л –х, отсюда х= 1 моль. Молярная концентрация См =1моль\л
Первый способ решения.
Составим уравнение: Fe + CuSO4 = FeSO4 + Cu
По уравнению реакции мы видим, что соотношение молекул меди и железа равно. 1:1.
То есть исходя из молярной массы 56:64. То есть разница в массе равна 64-56=8. По условию задачи масса пластинки увеличилась на 2грамма 42-40=2гр. Найдём массу выделившейся меди.
Составим пропорцию
При увеличении массы на 8 грамм выделяется 64т гр меди
При увеличении массы на 2 гр. выделяется х гр. меди.
Х= 16гр. По уравнению реакции мы видим, что количество меди и сульфата железа равно. n(Cu)b (FeSO4)= 16гр\64гр.\моль = 0,25 моль. Молярная концентрация показывает сколько молей содержится в 1 литре. Если в 250мл содержится 0,25моль, то в 1л –х, отсюда х= 1 моль. Молярная концентрация См =1моль\л
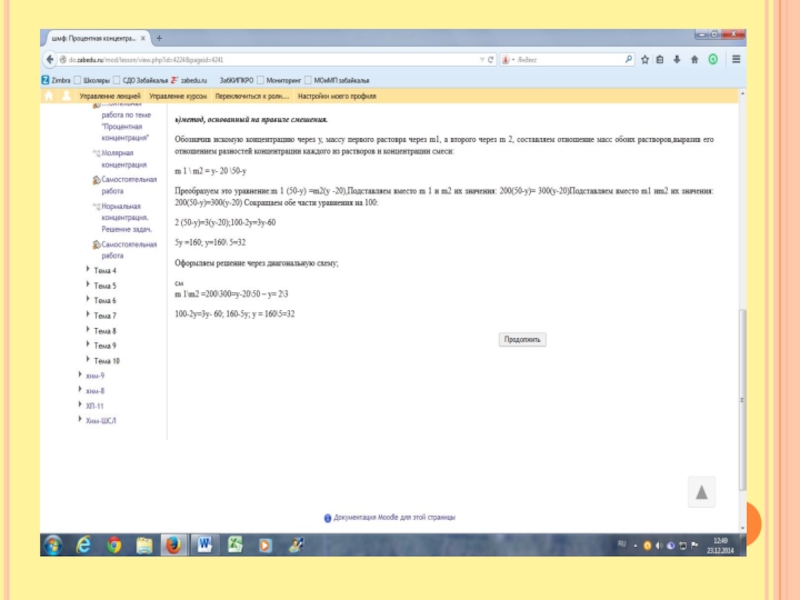
Слайд 13Второй способ решения
Составим уравнение: Fe + CuSO4 = FeSO4 + Cu
По
уравнению реакции мы видим, что количество железа и меди равно, поэтому мы примем количество вещества за х.
Мы видим, что масса железа ушла в раствор, а на пластинке осела масса меди, при этом масса пластинки увеличилась на 2 грамма. К 40 гр прибавили массу меди и отняли массу железа, при этом образовалось 42гр. А что такое масса. Масса всех молей. А сколько у нас молей? Х. Отсюда составим уравнение
40 + 64х-56х =42
Решаем уравнение х=0,25моль. Масса меди m(Cu) =64 гр\моль * 0,25 моль =16гр.
См=n\V Cм =0,25моль\0,25л =1моль\л
Мы видим, что масса железа ушла в раствор, а на пластинке осела масса меди, при этом масса пластинки увеличилась на 2 грамма. К 40 гр прибавили массу меди и отняли массу железа, при этом образовалось 42гр. А что такое масса. Масса всех молей. А сколько у нас молей? Х. Отсюда составим уравнение
40 + 64х-56х =42
Решаем уравнение х=0,25моль. Масса меди m(Cu) =64 гр\моль * 0,25 моль =16гр.
См=n\V Cм =0,25моль\0,25л =1моль\л
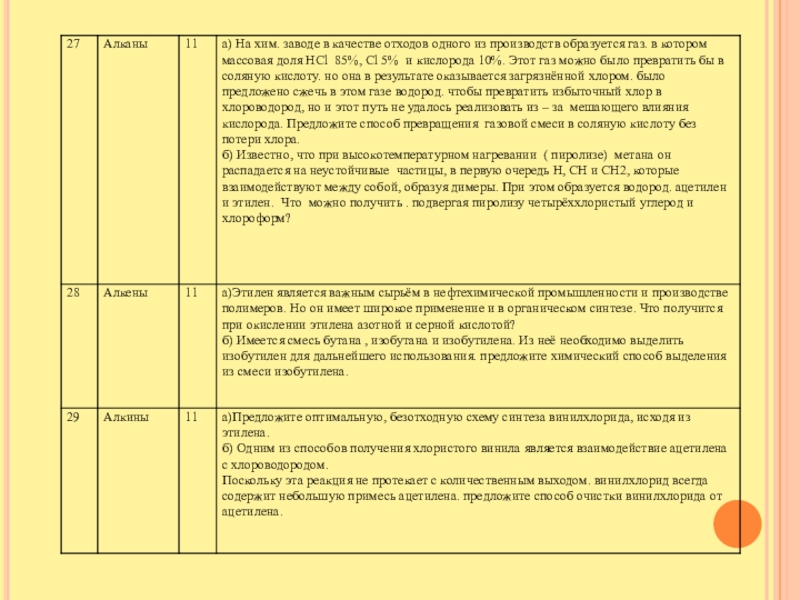
Слайд 144,1 гр смеси этилена и ацетилена способно прореагировать с 32 гр.
Вr2 Определите состав смеси.
Первый способ решения.
Составим уравнения реакций.
С2Н4 +Вr2 = С2Н4 Вr2
С2Н2 +2Вr2 = С2Н2 Вr4
Нам известна масса вещества Найдём количество. n (Вr2)= 32гр|160гр.\моль=0,2моль Количество брома в уравнениях разное. Примем в первом уравнении за х, во втором за у., х +у =0,2 моль
Масса смеси УВ складывается из масс С2Н4 и С2Н2 и равна 4,1 гр =m(С2Н4) + m(С2Н2) = 28х + 26 *0,5у, так как по уравнению количество брома и этилена равно, а количество ацетилена в 2 раза меньше.
Получили систему уравнений.
х +у=0,2
28х + 26 *0,5у=4,1
Отсюда х=0,1моль
у=0,1моль
m(С2Н4) =28 гр\моль *0,1 моль =2,8гр
m(С2Н2) =26гр\моль *0,5*0,1моль =1,3гр.
Первый способ решения.
Составим уравнения реакций.
С2Н4 +Вr2 = С2Н4 Вr2
С2Н2 +2Вr2 = С2Н2 Вr4
Нам известна масса вещества Найдём количество. n (Вr2)= 32гр|160гр.\моль=0,2моль Количество брома в уравнениях разное. Примем в первом уравнении за х, во втором за у., х +у =0,2 моль
Масса смеси УВ складывается из масс С2Н4 и С2Н2 и равна 4,1 гр =m(С2Н4) + m(С2Н2) = 28х + 26 *0,5у, так как по уравнению количество брома и этилена равно, а количество ацетилена в 2 раза меньше.
Получили систему уравнений.
х +у=0,2
28х + 26 *0,5у=4,1
Отсюда х=0,1моль
у=0,1моль
m(С2Н4) =28 гр\моль *0,1 моль =2,8гр
m(С2Н2) =26гр\моль *0,5*0,1моль =1,3гр.
Слайд 15Второй способ
Из уравнений реакций видно, что 1 моль этилена способен прореагировать
с одним молем брома, а 1 моль ацетилена с двумя молями брома. Обозначим количество этилена и ацетилена за х и у. Тогда получим
4,1 =28х +26у
32= 160х + 320у
Решаем систему уравнений. n(С2Н4)=0,1моль m(С2Н4) =28 гр\моль *0,1 моль =2,8гр
n(С2Н2)=0,05моль m(С2Н2) =26 гр\моль *0,05 моль =1,3гр
4,1 =28х +26у
32= 160х + 320у
Решаем систему уравнений. n(С2Н4)=0,1моль m(С2Н4) =28 гр\моль *0,1 моль =2,8гр
n(С2Н2)=0,05моль m(С2Н2) =26 гр\моль *0,05 моль =1,3гр
Слайд 16Третий способ решения.
х m1
С2Н4 +Вr2 =
С2Н4 Вr2
28 160
4,1-х m2
С2Н2 +2Вr2 = С2Н2 Вr4
26 320
Примем массу этилена за х, тогда масса ацетилена равна 4,1-х. Сколько прореагировало брома в первой и второй реакции мы незнаем, знаем только общую массу. Найдём массу брома по пропорции.
х : m1 =28 : 160 отсюда m1=160х\28 =5,7х
(4,1-х ) : m2 = 26 : 320 m2 = (4,1-х )320\26 =50,43 -12,3х
5,7х +50,43 -12,3х =32
6,6х=18,43
х= 2,8гр Это масса этилена.
Тогда масса ацетилена равна 4,1-2,8гр=1,3гр.
28 160
4,1-х m2
С2Н2 +2Вr2 = С2Н2 Вr4
26 320
Примем массу этилена за х, тогда масса ацетилена равна 4,1-х. Сколько прореагировало брома в первой и второй реакции мы незнаем, знаем только общую массу. Найдём массу брома по пропорции.
х : m1 =28 : 160 отсюда m1=160х\28 =5,7х
(4,1-х ) : m2 = 26 : 320 m2 = (4,1-х )320\26 =50,43 -12,3х
5,7х +50,43 -12,3х =32
6,6х=18,43
х= 2,8гр Это масса этилена.
Тогда масса ацетилена равна 4,1-2,8гр=1,3гр.
Слайд 17Творческая лаборатория «Пытливый ум» НОУ «Эрудит»
* решение нестандартных задач
*проектно- исследовательская деятельность,
которая включает в себя исследование для включения в структуру урока
проектно- исследовательскую деятельность, результатом которой являются исследовательские и курсовые работы.
Подготовка к ЕГЭ
проектно- исследовательскую деятельность, результатом которой являются исследовательские и курсовые работы.
Подготовка к ЕГЭ
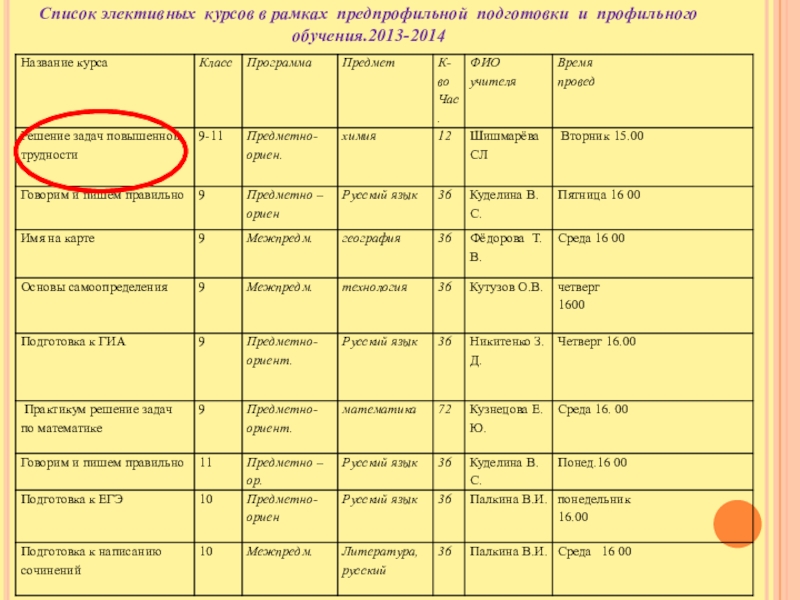
Слайд 18Список элективных курсов в рамках предпрофильной подготовки и профильного обучения.2013-2014
Слайд 35Система подготовки учащихся к олимпиадам и конкурсам – целеноправленный, длительный процесс,
специально организуемый на основе системно- деятельностного подхода, способствующий развитию интеллектуальных и волевых качеств учащихся
Слайд 40Средний балл по ЕГЭ
2003 – 2004 69 б.
2005
– 2006 71б.
2006 – 2007 68б.
2007 – 2008 66б.
2008 – 2009 54б.
2009 – 2010 78б.
2010 – 2011 66б.
2011 – 2012 53б.
2012 – 2013 70б.
2013 – 2014 69б.
2006 – 2007 68б.
2007 – 2008 66б.
2008 – 2009 54б.
2009 – 2010 78б.
2010 – 2011 66б.
2011 – 2012 53б.
2012 – 2013 70б.
2013 – 2014 69б.
Слайд 41Читинский
политехнический
институт
Новосибирский
Государственный
университет
Томский
Государственный
университет
Красноярский
технологический
университет
Восточно – сибирский
Институт
Иркутский государственный
медицинский университет
Новосибирский
государственный медицинский университет
Читинская государственная медицинская академия
Бурятская
государственная академия
ЗабГГУ
Успешная социализация