- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Окислительно-восстановительные реакции в органической химии
Содержание
- 1. Презентация по теме Окислительно-восстановительные реакции в органической химии
- 2. Мир веществ – мир разнообразный, причудливый и
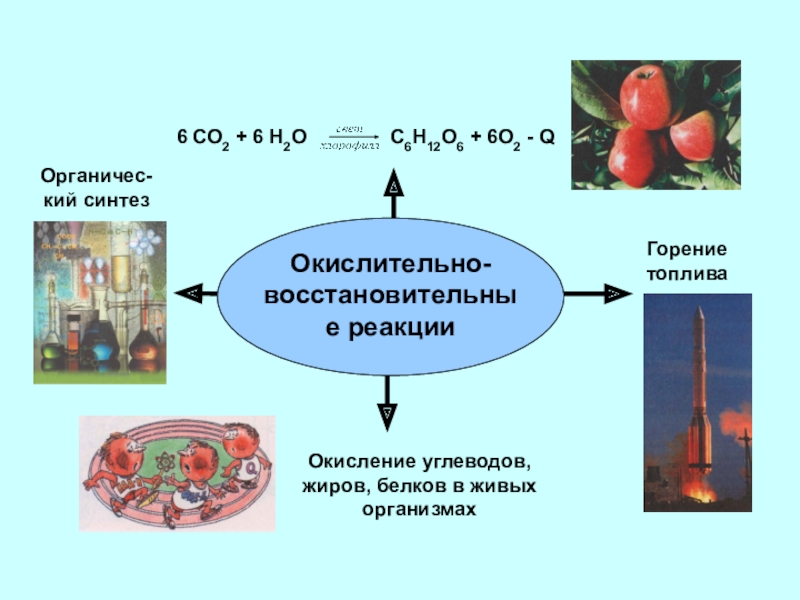
- 3. Окислительно-восстановительные реакцииГорение топливаОкисление углеводов, жиров, белков в живых организмахОрганичес-кий синтез
- 4. Окисление и восстановление в органической химииСложность определения
- 5. Цель:совершенствовать умения определять степени окисления атомов в
- 6. Определение степеней окисления атомов в молекулах органических
- 7. Вывод: все данные соединения содержат один атом
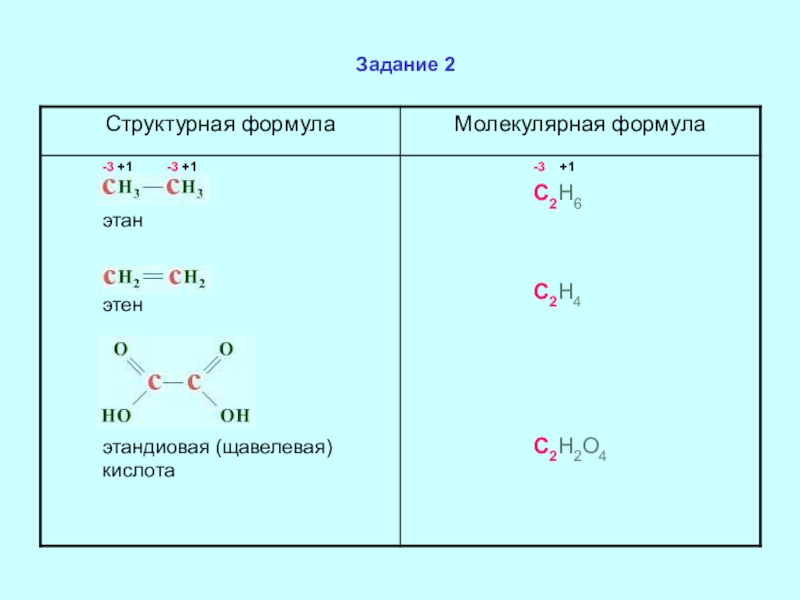
- 8. Задание 2
- 9. -2 +1 -2
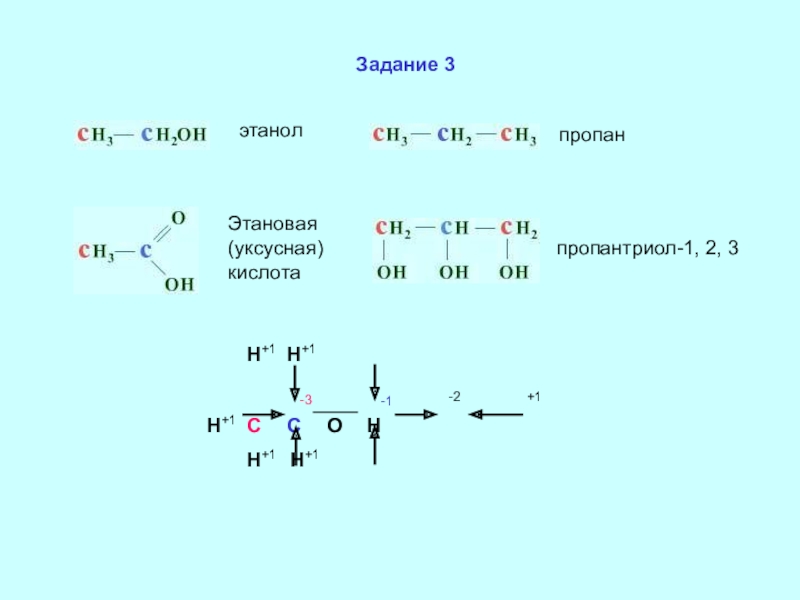
- 10. этанолпропанЭтановая (уксусная) кислотапропантриол-1, 2, 3 Н+1 Н+1 Н+1 С С О Н Н+1 Н+1-3-1-2+1Задание 3
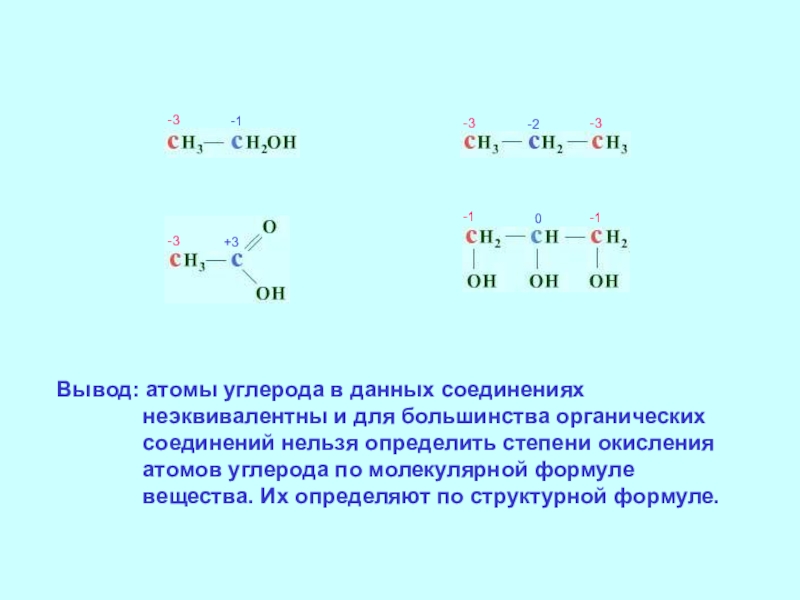
- 11. -3-1-3-3-2-3+3-1-10Вывод: атомы углерода в данных соединениях неэквивалентны
- 12. Составление уравнений окислительно-восстановительных реакций с участием органических
- 13. 4) Сбалансировать число электронов между окислителем и
- 14. Лист самоконтроляФамилия, имя ____________________________________________Тема ___________________________________________________1. Важность темы 3
Слайд 1Окислительно-восстановительные реакции в органической химии учитель химии МБОУ «СОШ №18»
Слайд 2Мир веществ – мир разнообразный, причудливый и таинственный. Каждое вещество может
Слайд 3
Окислительно-восстановительные реакции
Горение топлива
Окисление углеводов, жиров, белков в живых организмах
Органичес-кий синтез
Слайд 4Окисление и восстановление в органической химии
Сложность определения степени окисления элементов в
С точки зрения органической химии:
окисление – процесс присоединения молекулой атомов кислорода или потери атомов водорода
СН3СНО СН3СООН
CH3OH CH2O
восстановление – процесс, приводящий к увеличению атомов водорода или потере атомов кислорода молекулой.
СН2 = СН2 СН3 СН3
[O]
-2[H]
Н2, Ni
Слайд 5Цель:
совершенствовать умения определять степени окисления атомов в молекулах органических веществ;
рассмотреть применение
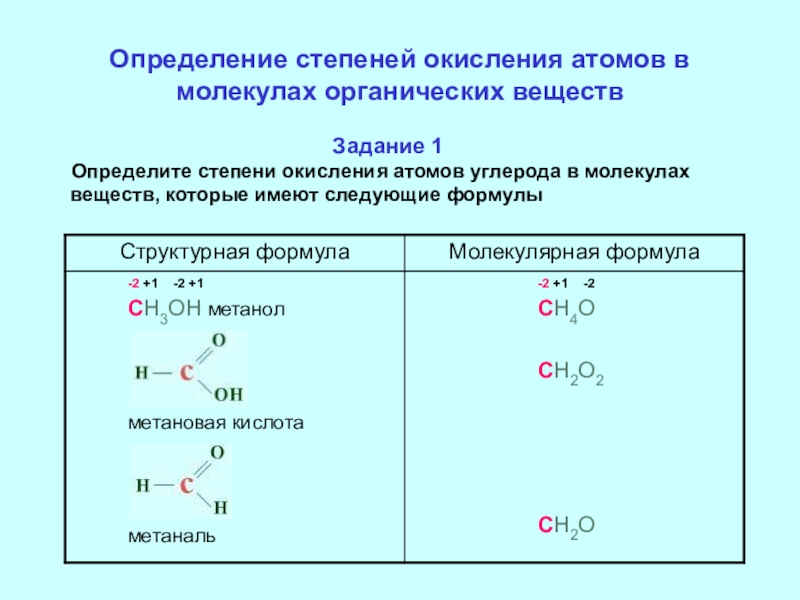
Слайд 6Определение степеней окисления атомов в молекулах органических веществ
Задание 1
Определите степени окисления
Слайд 7Вывод: все данные соединения содержат один атом углерода, степень окисления которого
+1
+2
-2
-2 +1
+1
0
+1
-2
+2 +1 -2
0 +1 -2
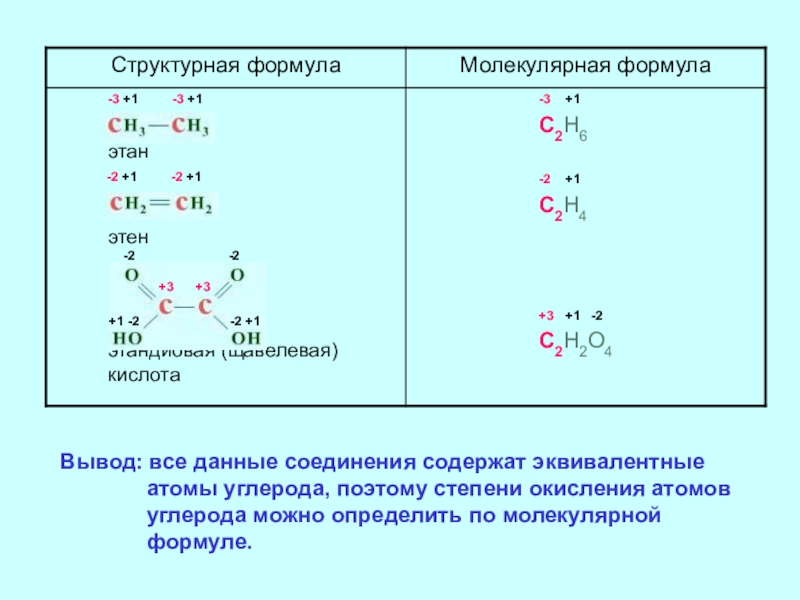
Слайд 9-2 +1 -2 +1
-2
-2
+3
+3
+1 -2
-2 +1
Вывод: все
Слайд 10этанол
пропан
Этановая (уксусная) кислота
пропантриол-1, 2, 3
Н+1 Н+1
Н+1 С С О Н
Н+1 Н+1
-3
-1
-2
+1
Задание
Слайд 11-3
-1
-3
-3
-2
-3
+3
-1
-1
0
Вывод: атомы углерода в данных соединениях неэквивалентны и для большинства органических
Слайд 12Составление уравнений окислительно-восстановительных реакций с участием органических веществ методом электронного баланса
Пример
Алгоритм.
1) Составить схему реакции
+ Cu(OH)2 + Cu2O + H2O
to
красный
2) Определить, атомы каких элементов изменяют степени окисления. Указать их степени окисления.
+ Cu(OH)2 + Cu2O + H2O
to
+1
+2
+3
+1
3) Составить электронные уравнения процессов окисления и восстановления.
окислитель Cu + 1ē Cu - процесс восстановления
восстановитель С - 2ē С - процесс окисления
+2
+1
+1
+3
Слайд 134) Сбалансировать число электронов между окислителем и восстановителем.
Cu + 1ē
С - 2ē С
+2
+1
+1
+3
2
1
5) Перенести эти коэффициенты в схему реакции. Подобрать коэффициенты перед формулами других веществ реакции.
+ 2Cu(OH)2 = + Cu2O + 2H2O
красный
Пример 2. Окисление пентена-1 раствором перманганата калия
3СH2 СH (СH2)2 CH3 + 2KMnO4 + 4H2O = 3 +2MnO2 + 2KOH
-2
-1
+7
-1
0
+4
C - 1ē C
С - 1ē С
-2
-1
-1
0
2
восстановитель
окислитель Mn + 3ē Mn
+7
+4
3
2
процесс окисления
процесс восстановления
Слайд 14Лист самоконтроля
Фамилия, имя ____________________________________________
Тема ___________________________________________________
1. Важность темы 3 - любопытно
4 – интересно
5
2. Понимание темы 3 - плохо
4 – хорошо
5 – отлично
3. Самооценка 3 – запомнил мало
4 – усвоил основное
5 – знаю