- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме: Азотная кислота и её соли.
Содержание
- 1. Презентация по теме: Азотная кислота и её соли.
- 2. Слайд 2
- 3. Получение азотной кислоты:1) Каталитическое окисление аммиака
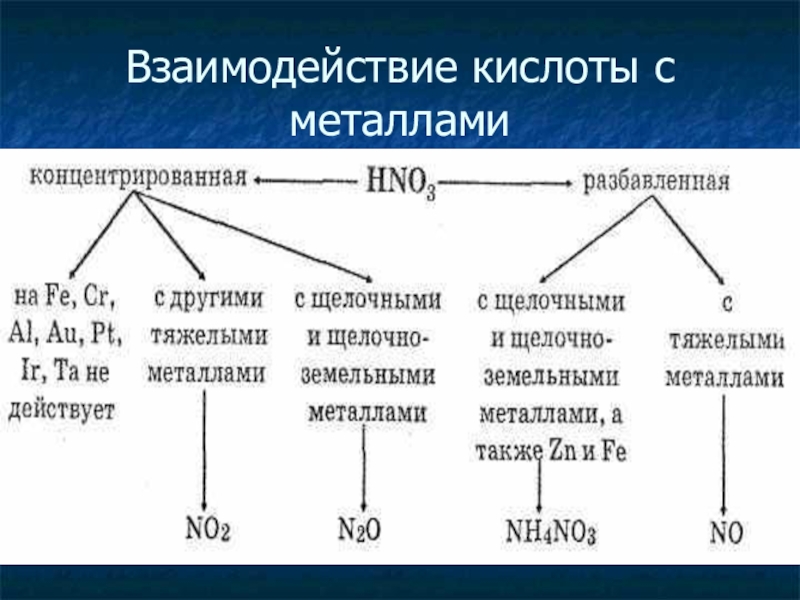
- 4. Взаимодействие кислоты с металлами
- 5. Особенности взаимодействия азотной кислоты с металлами.Выделяются разнообразные
- 6. Mg +HNO3 Mg (NO3)2+NH4NO3+H2O2.
- 7. Самостоятельная работаВариант 1. Свойства концентрированной азотной кислоты
- 8. Вывод1) При взаимодействии азотной кислоты любой концентрации
- 9. Взаимодействие с неметалламиS + …HNO3(60%) =
- 10. Качественная реакция на ион NO3NaNO3 + H2SO4
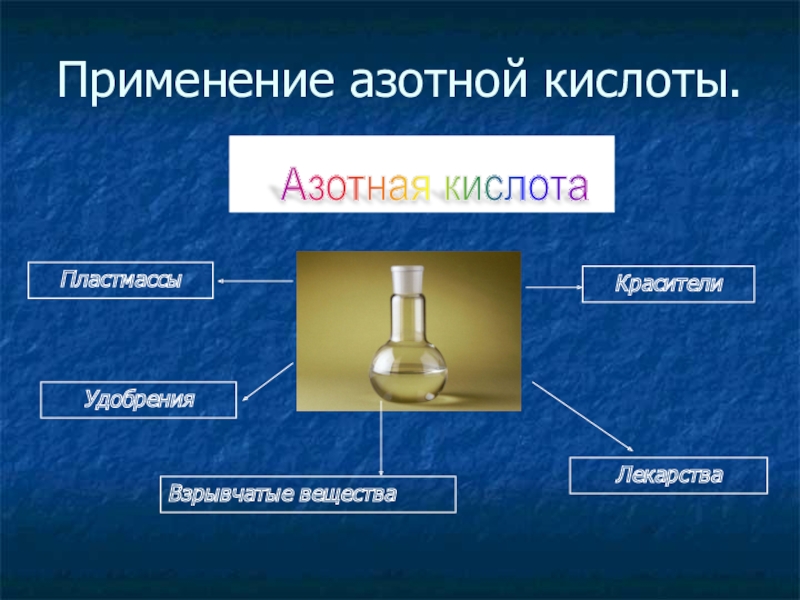
- 11. Применение азотной кислоты.Азотная кислота УдобренияВзрывчатые веществаКрасителиЛекарстваПластмассы
- 12. Особенности свойств нитратовАзот – это один из
- 13. Разложение нитратов
- 14. Нитраты при нагревании необратимо разлагаются, продукты разложения
- 15. В глазах древних исследователей азотная кислота –
- 16. Применение азотной кислоты имеет два лица: созидательное
- 17. Применение азотной кислоты имеет два лица: созидательное
- 18. Нитраты - минеральные удобрения, но использовать их
- 19. 4. При длительном поступлении нитратов в организм
Слайд 3Получение азотной кислоты:
1) Каталитическое окисление аммиака
4NH3
2) Окисление оксида азота (II)
2NO + O2 2NO2
3)Поглощение оксида азота (IV) водой в присутствии О2
4NO2 + O2 +2H2O 4HNO3
Pt
Слайд 5Особенности взаимодействия азотной кислоты с металлами.
Выделяются разнообразные соединения азота - NO2
N2 , NH3 , NH4NO3 .
Продукт реакции зависит от активности металла и концентрации кислоты.
С азотной кислотой реагируют металлы, стоящие до и после водорода в ряду активности.
Слайд 6
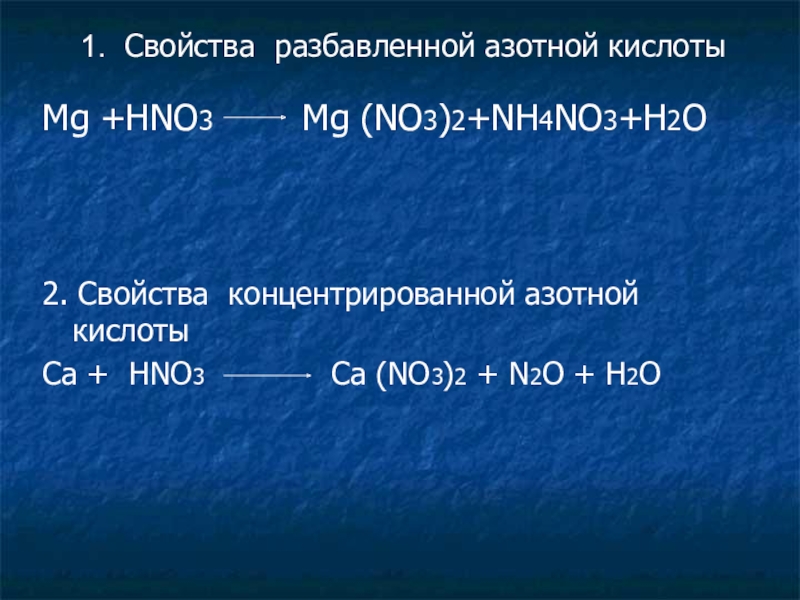
Mg +HNO3 Mg (NO3)2+NH4NO3+H2O
2. Свойства концентрированной азотной кислоты
Ca
1. Свойства разбавленной азотной кислоты
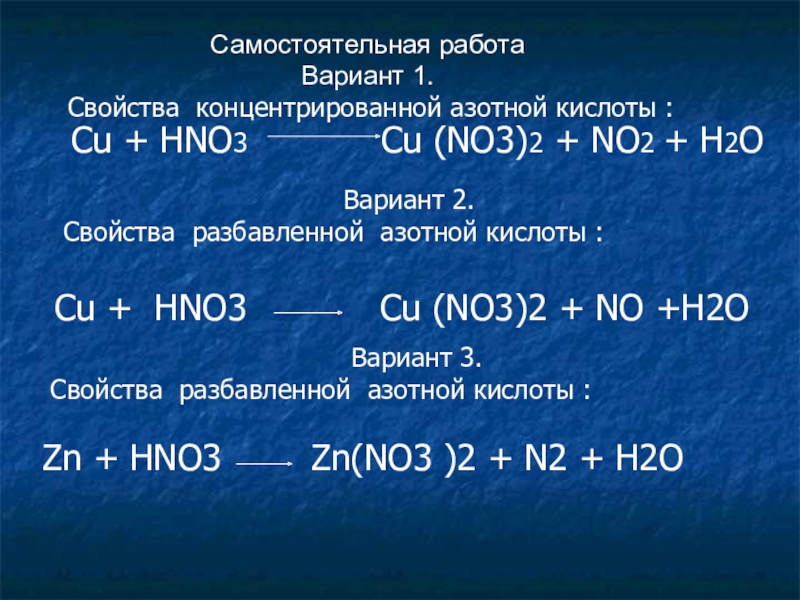
Слайд 7Самостоятельная работа
Вариант 1.
Свойства концентрированной азотной кислоты :
Cu + HNO3
Вариант 2.
Свойства разбавленной азотной кислоты :
Сu + HNO3 Cu (NO3)2 + NO +H2O
Вариант 3.
Свойства разбавленной азотной кислоты :
Zn + HNO3 Zn(NO3 )2 + N2 + H2O
Слайд 8Вывод
1) При взаимодействии азотной кислоты любой концентрации с металлами водород никогда
2) увеличение активности металла
----------------------------------------- >
NO2 NO N2O N2 NH4NO3
------------------------------------------>
уменьшение концентрации кислоты
Слайд 9 Взаимодействие с неметаллами
S + …HNO3(60%) = H2SO4 + …NO2 +
S + …HNO3(40%) = H2SO4 + …NO
P + …HNO3 (60%) = H3 PO4 + …NO2 + H2O
…P + …HNO3 (30%) + …H2O = …H3 PO4 + …NO
Вывод:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2.
Слайд 10Качественная реакция на ион NO3
NaNO3 + H2SO4 (k)
HNO3 + Cu Cu (NO3)2 + NO2 + H2O
-
бурый
Слайд 11Применение азотной кислоты.
Азотная кислота
Удобрения
Взрывчатые вещества
Красители
Лекарства
Пластмассы
Слайд 12Особенности свойств нитратов
Азот – это один из химических элементов для растений,
Все нитраты растворимы в воде.
Нитраты разлагаются при нагревании.
Слайд 14Нитраты при нагревании необратимо разлагаются, продукты разложения определяются катионом:
Вариант 1. а)
Вариант 2. б) нитраты металлов, расположенных в ряду напряжений между магнием и медью: …Al(NO3 )3 = …Al2O3 + …NO2 + …O2
Вариант 3. в) нитраты металлов, расположенных в ряду напряжений правее ртути: …AgNO3 = …Ag + …NO2 + O2
г) нитрат аммония: NH4NO3 = N2O + …H2O
Слайд 15В глазах древних исследователей азотная кислота – это жидкость, обладающая великой
Старинное название азотной кислоты - «крепкая водка»
Алхимики писали: «Крепкая водка пожирает луну. Выпуская лисий хвост…»
Расшифруйте это высказывание.
Луна- серебро
Пожирает – растворяет
Лисий хвост- оксид азота (IV)
Слайд 16Применение азотной кислоты имеет два лица:
созидательное и разрушительное
В начале как
А затем для получения ……….
Шведский химик А.Нобель использовал это для получения……..
Слайд 17Применение азотной кислоты имеет два лица:
созидательное и разрушительное
В начале как
А затем для получения ……….
Шведский химик А.Нобель использовал это для получения……..
Слайд 18Нитраты - минеральные удобрения, но использовать их нужно грамотно…
Избыток нитратов
1. Развитию патогенной кишечной микрофлоры, которая выделяет токсины.
2. Нитраты снижают содержание витаминов в пище.
3. Под воздействием ферментов в организме человека и животных нитраты восстанавливаются до нитритов. Они взаимодействуя с гемоглобином крови, образуют вещество, которое уже не способно переносить кислород, нарушается нормальное дыхание клеток и тканей организма.
Слайд 19
4. При длительном поступлении нитратов в организм человека уменьшается количество йода,
5. Нитраты влияют на возникновение раковых опухолей в желудочно-кишечном тракте.
6. Нитраты способны вызывать резкое расширение сосудов, в результате чего понижается кровяное давление.