- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Алкены
Содержание
- 1. Презентация по теме Алкены
- 2. Алкены(непредельные углеводороды)
- 3. Содержание1. Общая формула, гомологический ряд 2. Изомерия,
- 4. 1. Общая формула, гомологический ряд этиленаС4Н8
- 5. Гомологический ряд этиленаС2Н4БутенДеценЭтенС3Н6ПентенС5Н10Пропен С4Н8С8Н16ГептенГексенС7Н14С6Н12НоненС9Н18ОктенС10Н20Гомологи- СН2- гомологическая разность
- 6. Виды изомерии2. Изомерия, номенклатура СтруктурнаяУглеродного скелетаПоложения ФГМежклассоваяПространственная(стереоизомерия)Геометрическая
- 7. Номенклатура
- 8. 3. Строение молекулы этиленаС2Н4Какова структурная формула вещества?Как происходит образование кратной связи?
- 9. S PspdfEPyPx12С2е4е+6Строение атома
- 10. S PspdfES+PSP221Строение атома углерода Гибридизация атомных орбиталей
- 11. 4. Нахождение в природе
- 12. Слайд 12
- 13. 5. ПолучениеВ лабораторииА) H2C _ CH2 HOHH2C
- 14. 5. ПолучениеВ промышленности На производстве этилен получают
- 15. 6. Физические свойстваГазыЖидкостиТвердые веществаЭтилен – бесцветный газ со слабо-нефтяным запахом, малорастворим в воде
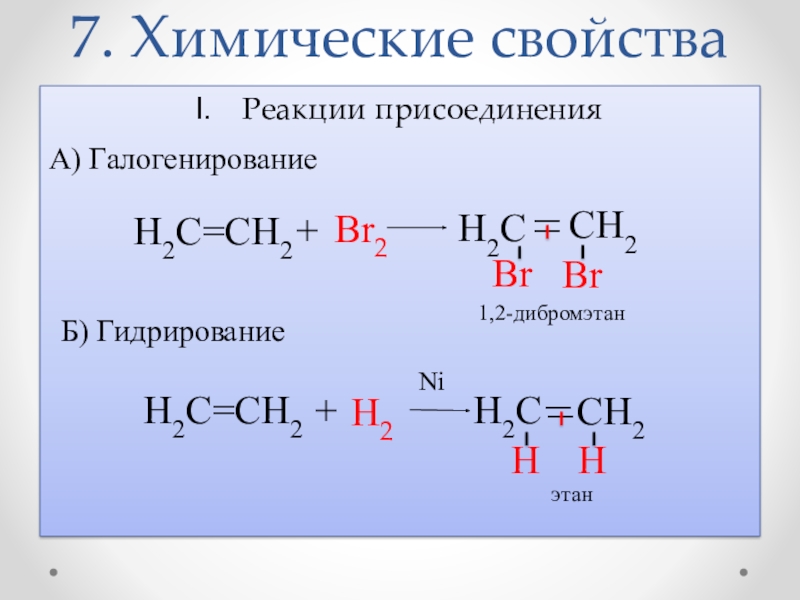
- 16. 7. Химические свойстваРеакции присоединенияА) Галогенирование H2C _ CH2 _ BrBrH2C=CH2+Br2Б) ГидрированиеH2C=CH2+Н2 H2C _ _ CH2 НН1,2-дибромэтанэтанNi
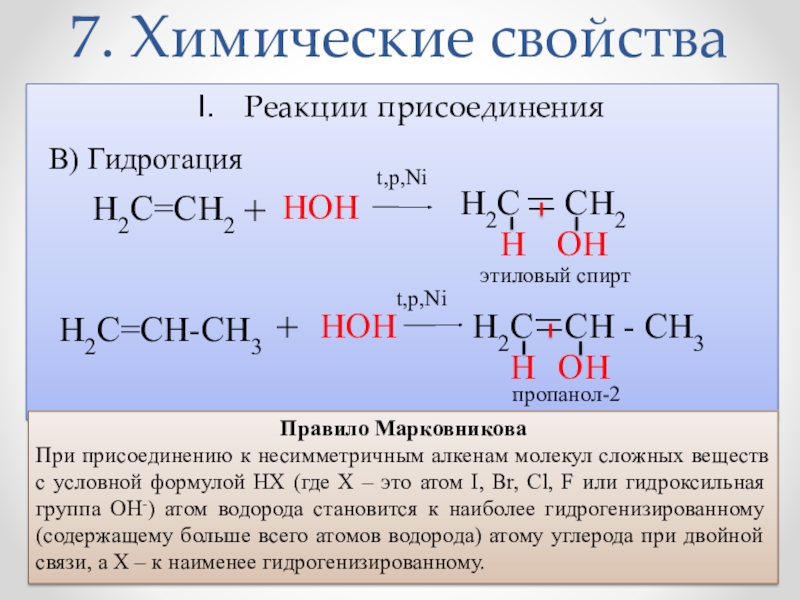
- 17. 7. Химические свойстваРеакции присоединенияВ) Гидротация H2C _
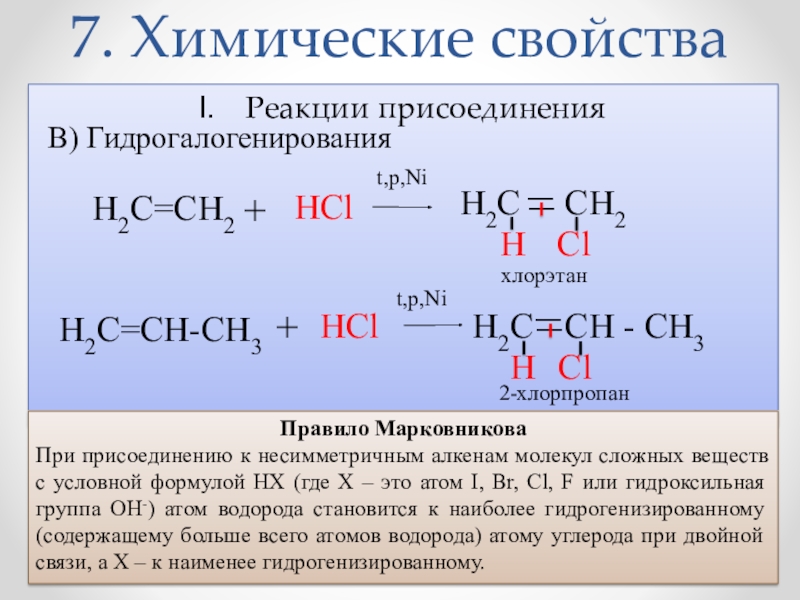
- 18. 7. Химические свойстваРеакции присоединенияВ) Гидрогалогенирования H2C _
- 19. 7. Химические свойстваII. Реакции окисленияС2Н4А) Горение +СО2О2Н2О+Б) Мягкое окислениеH2C=CH2+КMnO4Н2O+H2C CH2+КОН+MnО2_ _ OHHOэтиленгликоль
- 20. 7. Химические свойстваIII. Реакции дегидрированияC=C+Н2IV. Реакция полимеризацииH2C=CH2
- 21. 8. ПрименениеГидрогалогенированиеГалогенированиеПолимеризацияГорениеМягкое окислениеполиэтиленЭтиленгликольтопливохлорэтан1,2-дихлорэтан
- 22. Это интересно… Простейший представитель этого класса органических
Слайд 3Содержание
1. Общая формула, гомологический ряд
2. Изомерия, номенклатура
3. Строение
4. Нахождение в
6. Физические свойства
7. Химические свойства
5. Получение
8. Применение
Слайд 41. Общая формула, гомологический ряд этилена
С4Н8 С8Н16 С6Н12
Общая электронная формула
СnН2n
Слайд 5Гомологический ряд этилена
С2Н4
Бутен
Децен
Этен
С3Н6
Пентен
С5Н10
Пропен
С4Н8
С8Н16
Гептен
Гексен
С7Н14
С6Н12
Нонен
С9Н18
Октен
С10Н20
Гомологи
- СН2- гомологическая разность
Слайд 6Виды изомерии
2. Изомерия, номенклатура
Структурная
Углеродного скелета
Положения ФГ
Межклассовая
Пространственная
(стереоизомерия)
Геометрическая
Оптическая
Положения кратной связи
Напишите
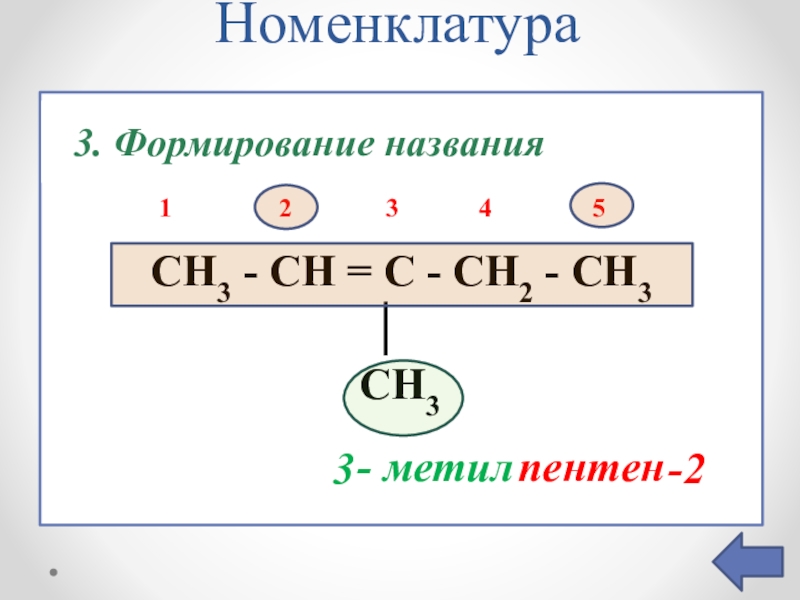
Слайд 7Номенклатура
CH3 -
│
CH3
1.Выбор главной цепи
1 2 3 4 5
пентен
- метил
2.Нумерация главной цепи
3. Формирование названия
3
-2
Слайд 83. Строение молекулы этилена
С2Н4
Какова структурная формула вещества?
Как происходит образование кратной связи?
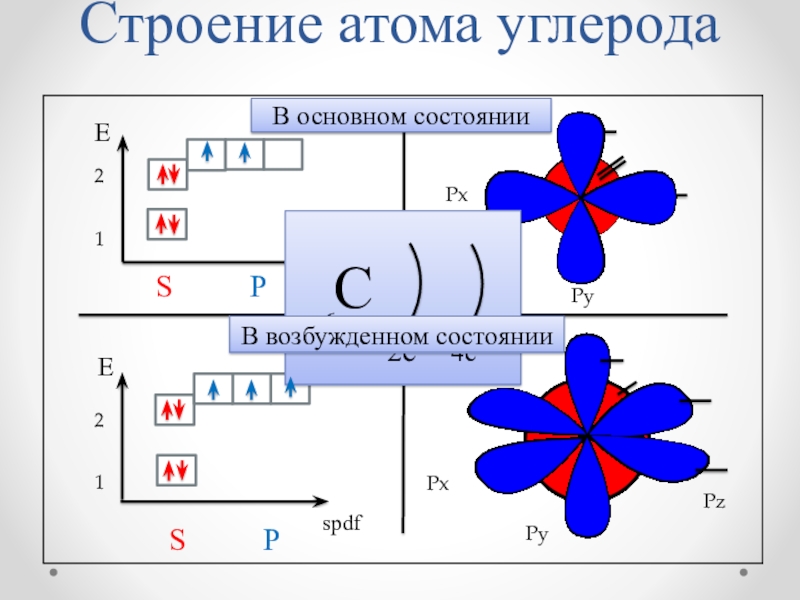
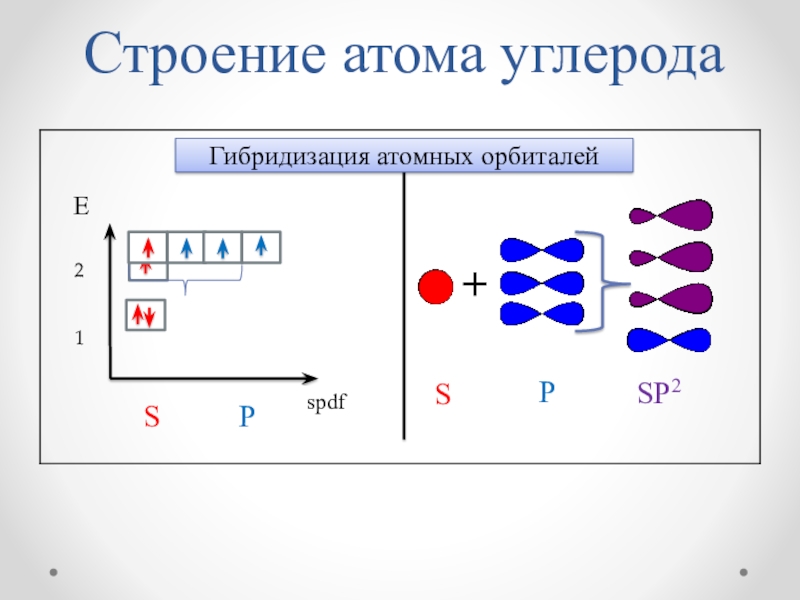
Слайд 9S P
spdf
E
Py
Px
1
2
С
2е
4е
+6
Строение атома углерода
Px
Py
Pz
S
1
2
spdf
E
В основном состоянии
В возбужденном состоянии
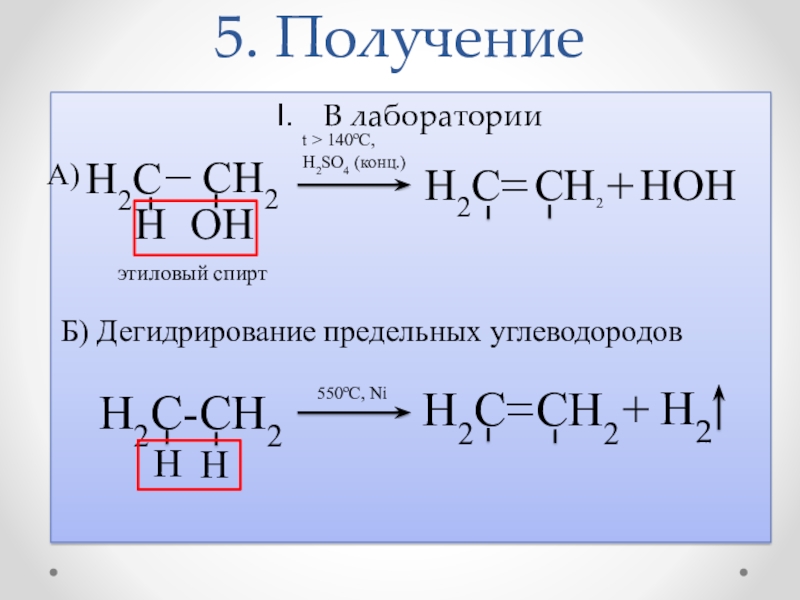
Слайд 135. Получение
В лаборатории
А)
H2C
_
CH2
H
OH
H2C CH2
+
HOH
Б) Дегидрирование
H2C-CH2
H2C
_
_
CH2
этиловый спирт
t > 140oC,
H2SO4 (конц.)
550oC, Ni
H
H
+
Н2
_
_
Слайд 145. Получение
В промышленности
На производстве этилен получают из природного газа и
Самостоятельно запишите уравнение получения этилена путем процессов крекинга и пиролиза
Слайд 156. Физические свойства
Газы
Жидкости
Твердые вещества
Этилен – бесцветный газ со слабо-нефтяным запахом, малорастворим
Слайд 167. Химические свойства
Реакции присоединения
А) Галогенирование
H2C
_
CH2
_
Br
Br
H2C=CH2
+
Br2
Б) Гидрирование
H2C=CH2
+
Н2
_
_
CH2
Н
Н
1,2-дибромэтан
этан
Ni
Слайд 177. Химические свойства
Реакции присоединения
В) Гидротация
H2C
_
CH2
_
H
OH
H2C=CH2
+
HOH
+
НOH
H2C
_
_
Н
OH
этиловый спирт
пропанол-2
t,p,Ni
H2C=CH-СН3
t,p,Ni
CH - СН3
Правило Марковникова
При присоединению к несимметричным алкенам молекул сложных веществ с условной формулой НХ (где Х – это атом I, Br, Cl, F или гидроксильная группа ОН-) атом водорода становится к наиболее гидрогенизированному (содержащему больше всего атомов водорода) атому углерода при двойной связи, а Х – к наименее гидрогенизированному.
Слайд 187. Химические свойства
Реакции присоединения
В) Гидрогалогенирования
H2C
_
CH2
_
H
Cl
H2C=CH2
+
HСl
+
НCl
H2C
_
_
Н
Cl
хлорэтан
2-хлорпропан
t,p,Ni
H2C=CH-СН3
t,p,Ni
CH - СН3
Правило Марковникова
При присоединению к несимметричным алкенам молекул сложных веществ с условной формулой НХ (где Х – это атом I, Br, Cl, F или гидроксильная группа ОН-) атом водорода становится к наиболее гидрогенизированному (содержащему больше всего атомов водорода) атому углерода при двойной связи, а Х – к наименее гидрогенизированному.
Слайд 197. Химические свойства
II. Реакции окисления
С2Н4
А) Горение
+
СО2
О2
Н2О
+
Б) Мягкое окисление
H2C=CH2
+
КMnO4
Н2O
+
H2C CH2
+
КОН
+
MnО2
_
_
OH
HO
этиленгликоль
Слайд 207. Химические свойства
III. Реакции дегидрирования
C=C
+
Н2
IV. Реакция полимеризации
H2C=CH2
H2C CH2
)
(
n
Процесс соединения одинаковых молекул в более крупные называется реакцией полимеризации
полиэтилен
Н
Н
Н
Н
C C
Н
Н
=
ацетилен
Слайд 218. Применение
Гидрогалогенирование
Галогенирование
Полимеризация
Горение
Мягкое окисление
полиэтилен
Этиленгликоль
топливо
хлорэтан
1,2-дихлорэтан
Слайд 22Это интересно…
Простейший представитель этого класса органических соединений — этилен— является
Один из немногих природных алкенов — мускалур (цис-трикозен-9) является половым аттрактантом самки домашней мухи (Musca domestica).