- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии за 9 класс на тему Галогены.
Содержание
- 1. Презентация по химии за 9 класс на тему Галогены.
- 2. Общая характеристика Галогены (от греч. «рождающие соли»)
- 3. Простые веществаФтор ( от греч.«уничтожать, истреблять, губить»)
- 4. Бром (от др.-греч. «вонючий») - токсичная тяжелая жидкость
- 5. Физические свойстваПлотность растет;Температура кипения и плавления растут;Окраска
- 6. Химические свойстваГалогены – типичные окислители.Более активный галоген
- 7. ГалогеноводородыHГ – летучие, хорошо растворимые в воде
- 8. Получение хлораВ промышленности электролиз раствора или расплава
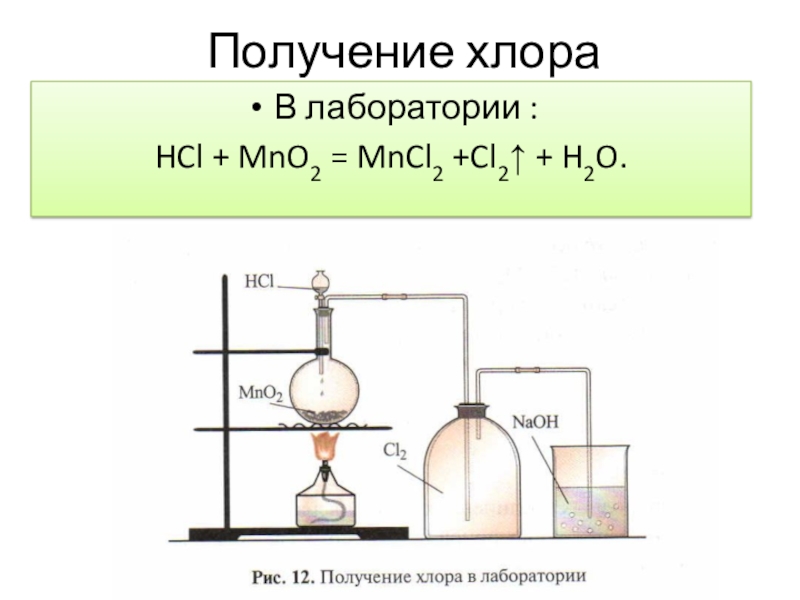
- 9. Получение хлора В лаборатории :HCl + MnO2 = MnCl2 +Cl2↑ + H2O.
- 10. Химические свойстваС металлами:Многие металлы, предварительно нагретые, сгорают в атмосфере хлора, в результате получаются соответствующие соли.
- 11. С металлами.
- 12. С водородом.
- 13. С другими неметаллами. Окисляет менее электроотрицательные неметаллы.
- 14. Взаимодействие с водойХорошо растворим в воде. Раствор
- 15. Вытеснение брома и йода из их солей.
- 16. ХлороводородВ промышленности – сжиганием водорода в хлоре.H2
- 17. Физические свойстваХлороводород – бесцветный газ с резким
- 18. Химические свойства соляной кислоты1) Сильная кислота →
- 19. 2) С основными и амфотерными оксидами и
- 20. 3) Окислительные свойства (Н+), металл вытесняет водород.Al
Общая характеристика Галогены (от греч. «рождающие соли») главная подгруппа 7 группы: F, Cl, Br, I и At.Все галогены, кроме At встречаются в виде соединений. В природе галогены в виде простых веществ не встречаются!Молекулы простых веществ состоят
Слайд 2Общая характеристика
Галогены (от греч. «рождающие соли») главная подгруппа 7 группы:
F, Cl, Br, I и At.
Все галогены, кроме At встречаются в виде соединений.
Все галогены, кроме At встречаются в виде соединений.
В природе галогены в виде простых веществ не встречаются!
Молекулы простых веществ состоят из двух атомов, в общем виде Г2.
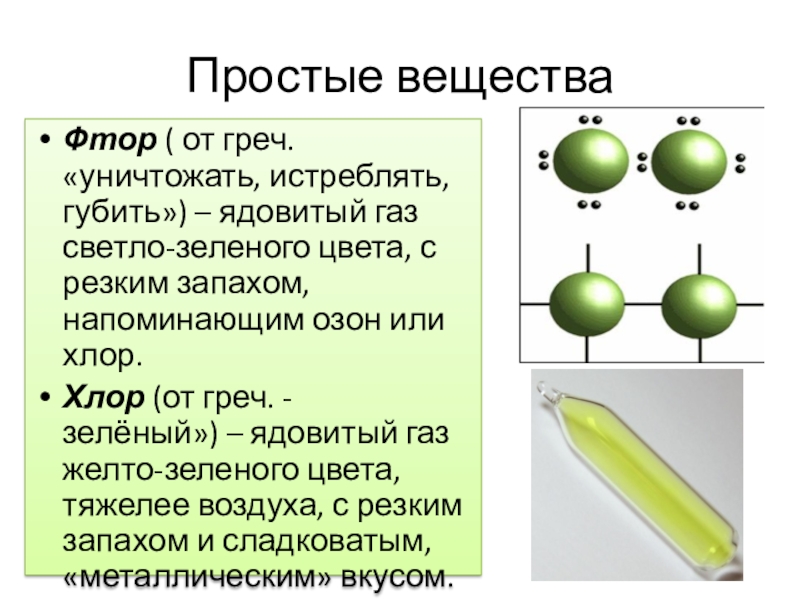
Слайд 3Простые вещества
Фтор ( от греч.«уничтожать, истреблять, губить») – ядовитый газ светло-зеленого
цвета, с резким запахом, напоминающим озон или хлор.
Хлор (от греч. - зелёный») – ядовитый газ желто-зеленого цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом.
Хлор (от греч. - зелёный») – ядовитый газ желто-зеленого цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом.
Слайд 4Бром (от др.-греч. «вонючий») - токсичная тяжелая жидкость красно-бурого цвета с сильным
неприятным запахом.
Йод (от др.-греч.— «фиолетовый») – кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом.
Йод (от др.-греч.— «фиолетовый») – кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом.
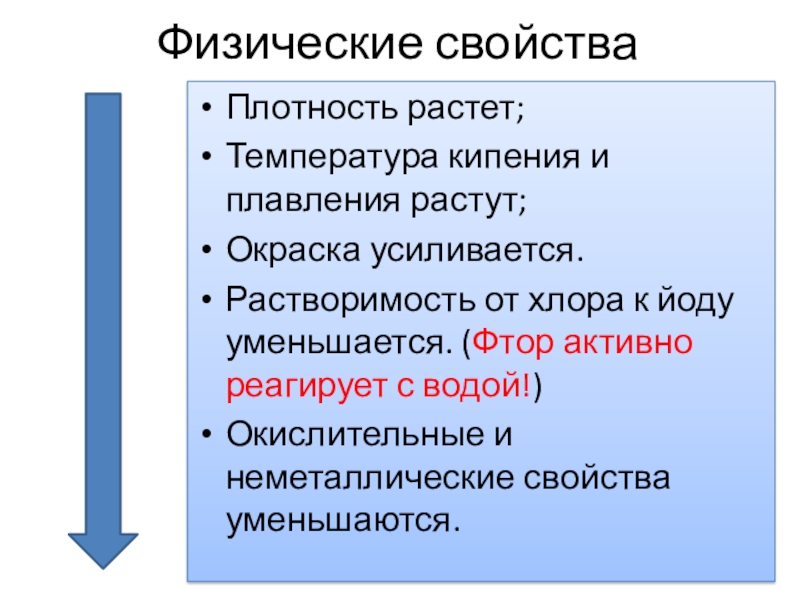
Слайд 5Физические свойства
Плотность растет;
Температура кипения и плавления растут;
Окраска усиливается.
Растворимость от хлора к
йоду уменьшается. (Фтор активно реагирует с водой!)
Окислительные и неметаллические свойства уменьшаются.
Окислительные и неметаллические свойства уменьшаются.
Слайд 6Химические свойства
Галогены – типичные окислители.
Более активный галоген вытесняет менее активный из
его соединений с металлами и водородом (исключение: F2).
Ионы галогенов Г- способны только отдавать электроны и являются восстановителями:
Ионы галогенов Г- способны только отдавать электроны и являются восстановителями:
Слайд 7Галогеноводороды
HГ – летучие, хорошо растворимые в воде соединения.
Водные растворы являются кислотами.
Сила кислот от HF к HI растет.
Устойчивость уменьшается.
Восстановительная активность для Г-1 в ряду увеличивается:
Устойчивость уменьшается.
Восстановительная активность для Г-1 в ряду увеличивается:
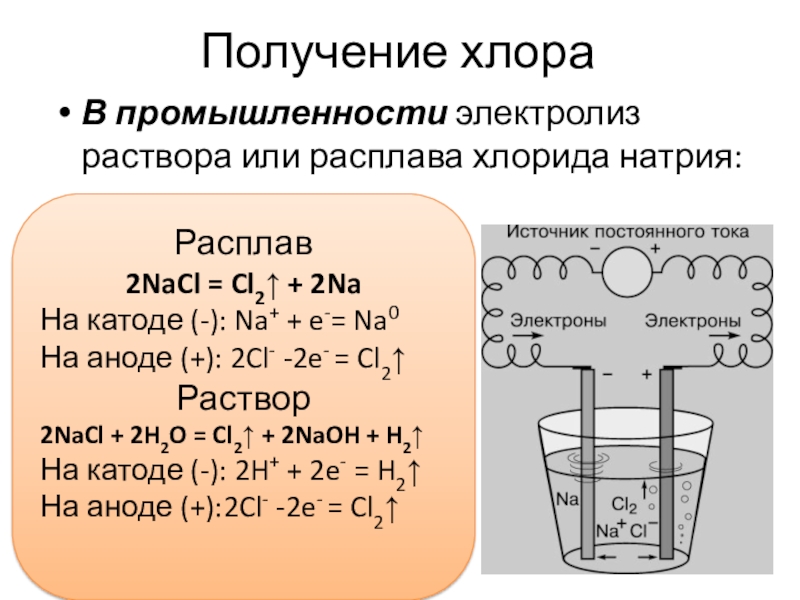
Слайд 8Получение хлора
В промышленности электролиз раствора или расплава хлорида натрия:
Расплав
2NaCl = Cl2↑
+ 2Na
На катоде (-): Na+ + e-= Na0
На аноде (+): 2Cl- -2e- = Cl2↑
Раствор
2NaCl + 2H2O = Cl2↑ + 2NaOH + H2↑
На катоде (-): 2H+ + 2e- = H2↑
На аноде (+):2Cl- -2e- = Cl2↑
На катоде (-): Na+ + e-= Na0
На аноде (+): 2Cl- -2e- = Cl2↑
Раствор
2NaCl + 2H2O = Cl2↑ + 2NaOH + H2↑
На катоде (-): 2H+ + 2e- = H2↑
На аноде (+):2Cl- -2e- = Cl2↑
Слайд 10Химические свойства
С металлами:
Многие металлы, предварительно нагретые, сгорают в атмосфере хлора, в
результате получаются соответствующие соли.
Слайд 13С другими неметаллами. Окисляет менее электроотрицательные неметаллы. Фтор не реагирует с O2, C,
N2 и благородными газами.
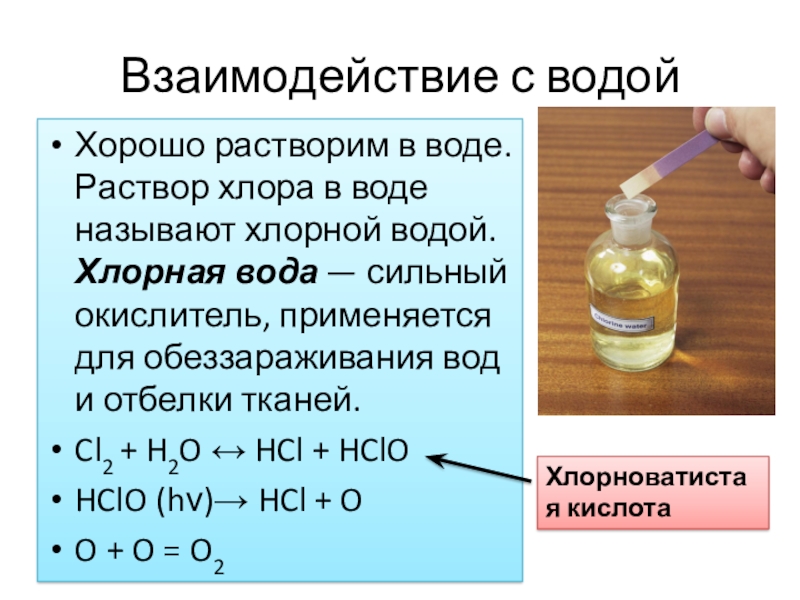
Слайд 14Взаимодействие с водой
Хорошо растворим в воде. Раствор хлора в воде называют
хлорной водой. Хлорная вода — сильный окислитель, применяется для обеззараживания вод и отбелки тканей.
Cl2 + H2O ↔ HCl + HClO
HClO (hν)→ HCl + O
O + O = O2
Cl2 + H2O ↔ HCl + HClO
HClO (hν)→ HCl + O
O + O = O2
Хлорноватистая кислота
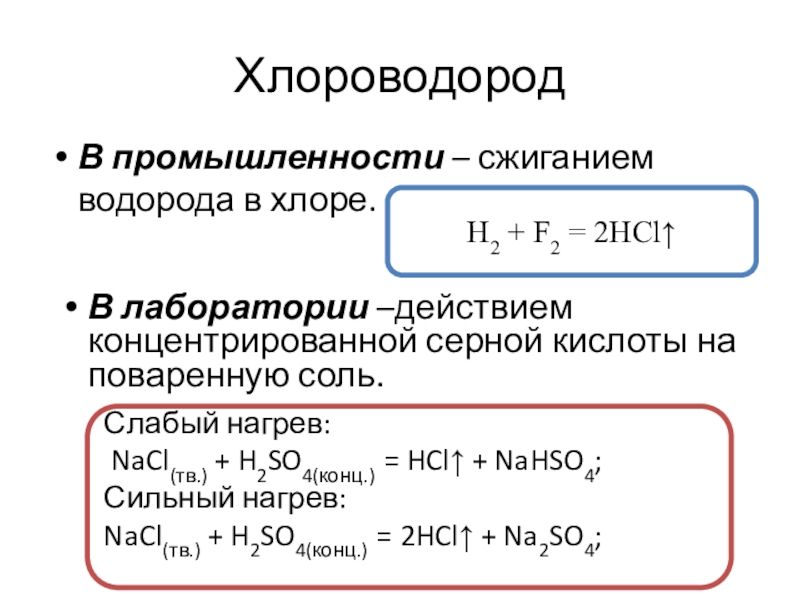
Слайд 16Хлороводород
В промышленности – сжиганием водорода в хлоре.
H2 + F2 = 2HCl↑
В
лаборатории –действием концентрированной серной кислоты на поваренную соль.
Слабый нагрев:
NaCl(тв.) + H2SO4(конц.) = HCl↑ + NaHSO4;
Сильный нагрев:
NaCl(тв.) + H2SO4(конц.) = 2HCl↑ + Na2SO4;
Слайд 17Физические свойства
Хлороводород – бесцветный газ с резким запахом, тяжелее воздуха, хорошо
растворим в воде.
Раствор хлороводорода – соляная кислота.
Соляная кислота – бесцветный раствор, сильно дымящийся на воздухе, с резким запахом.
Раствор хлороводорода – соляная кислота.
Соляная кислота – бесцветный раствор, сильно дымящийся на воздухе, с резким запахом.
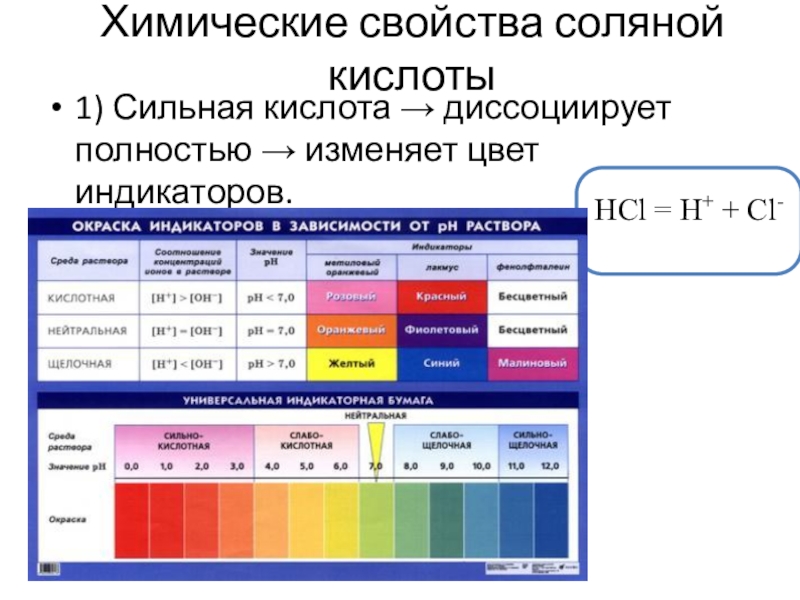
Слайд 18Химические свойства соляной кислоты
1) Сильная кислота → диссоциирует полностью → изменяет
цвет индикаторов.
HCl = H+ + Cl-
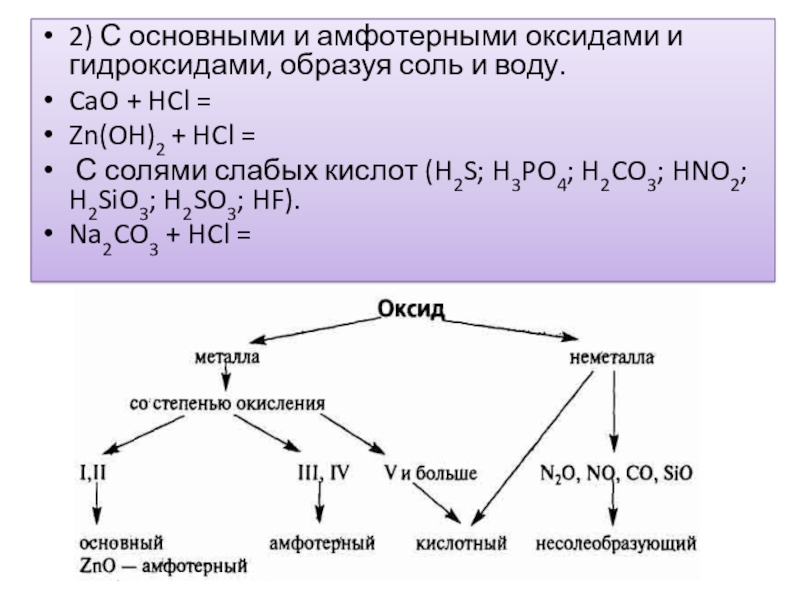
Слайд 192) С основными и амфотерными оксидами и гидроксидами, образуя соль и
воду.
CaO + HCl =
Zn(OH)2 + HCl =
С солями слабых кислот (H2S; H3PO4; H2CO3; HNO2; H2SiO3; H2SO3; HF).
Na2CO3 + HCl =
CaO + HCl =
Zn(OH)2 + HCl =
С солями слабых кислот (H2S; H3PO4; H2CO3; HNO2; H2SiO3; H2SO3; HF).
Na2CO3 + HCl =
Слайд 203) Окислительные свойства (Н+), металл вытесняет водород.
Al + HCl =
4)
Взаимодействие с окислителями в конц. виде (восстановитель хлорид-ион).
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O