- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Щелочные металлы(9 класс)
Содержание
- 1. Презентация по химии Щелочные металлы(9 класс)
- 2. Происхождение названий щелочных металлов Li (1817)
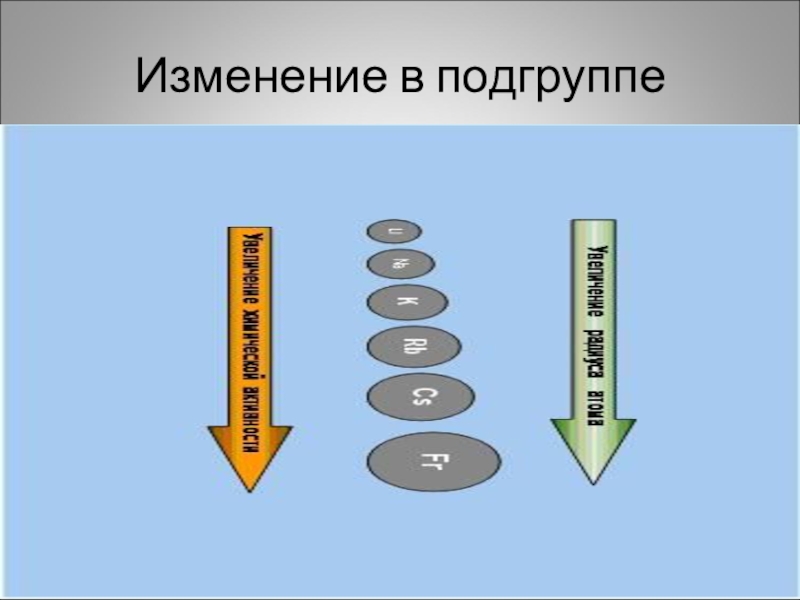
- 3. Положение в периодической системе химических элементов Д.И.МенделееваI группа главная подгруппа. Увеличивается радиус атомов ,растет восстановительная способность
- 4. Изменение в подгруппе
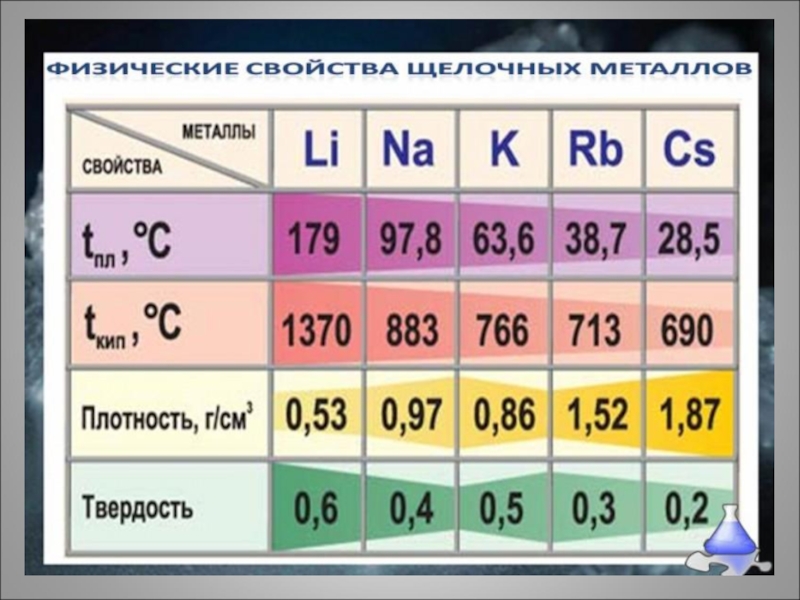
- 5. Слайд 5
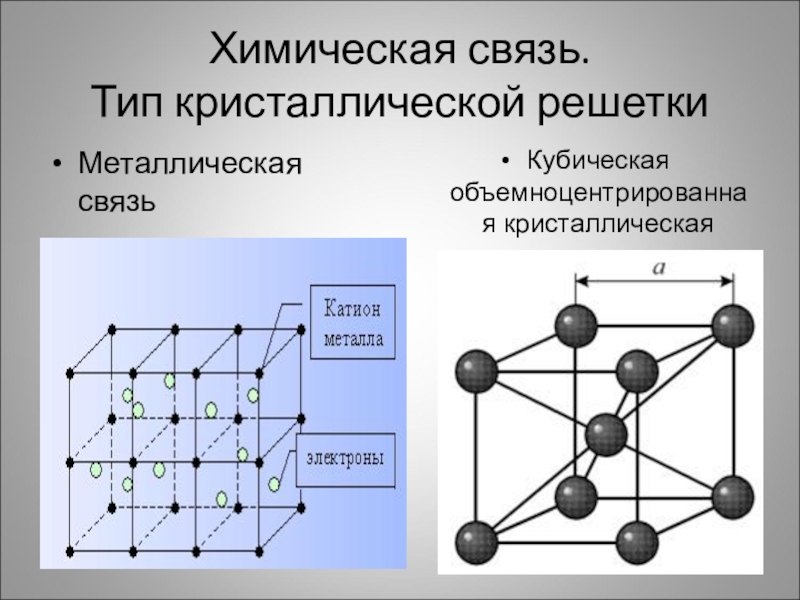
- 6. Химическая связь. Тип кристаллической решеткиМеталлическая связьКубическая объемноцентрированная кристаллическая решетка
- 7. Слайд 7
- 8. Слайд 8
- 9. Щелочные металлы – простые веществаЛитийНатрийЛитий и натрий
- 10. Щелочные металлыКалийРубидийКалий и рубидиймягкие щелочные металлы серебристо-белого цвета
- 11. Щелочные металлыцезийЦезий 99,99999% в ампулеМягкий щелочной металл золотисто-белого цвета
- 12. ФранцийФранций - щелочной металл, обладающий как радиоактивностью,
- 13. Химические свойства щелочных металлов Типичные
- 14. Химические свойства2Na + Cl2
- 15. Качественное определение щелочных металлов
- 16. Получение щелочных металлов 1) Электролиз расплавов соединений
- 17. Применение щелочных металловБИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯ
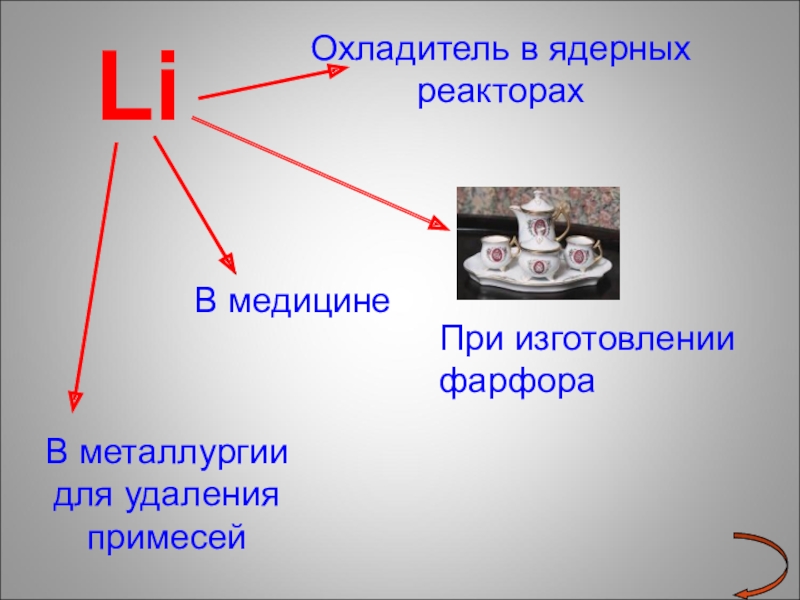
- 18. Li Охладитель в ядерных реакторахВ медицинеВ металлургии для удаления примесейПри изготовлении фарфора
- 19. К+ Внутриклеточный ион.
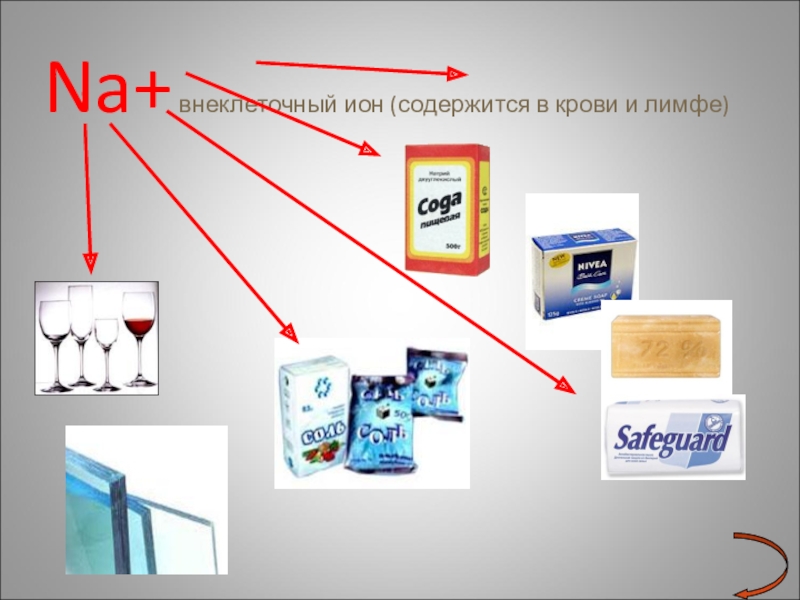
- 20. Na+ внеклеточный ион (содержится в крови и лимфе)
- 21. Сподуменн
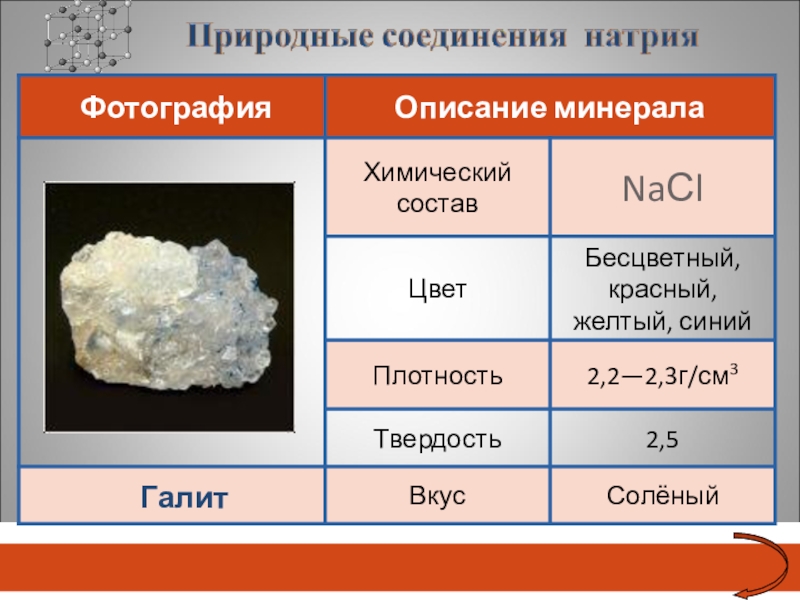
- 22. Галит
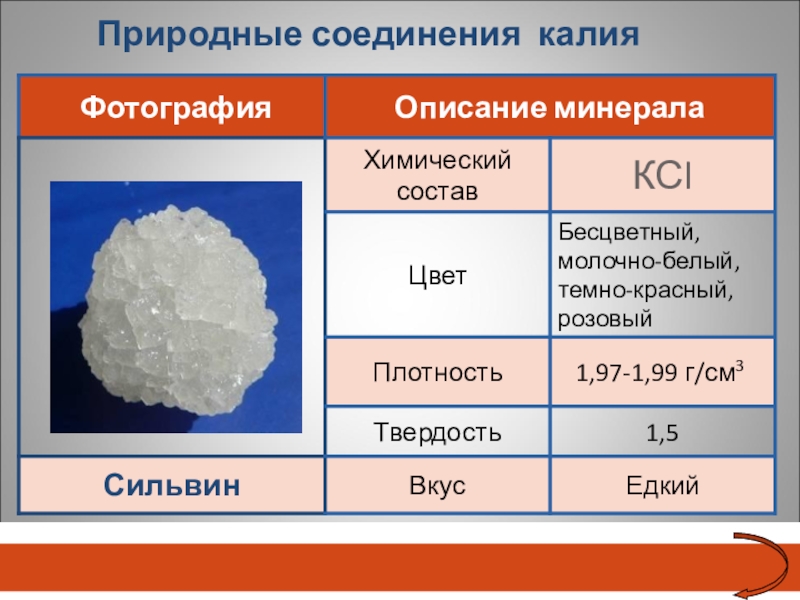
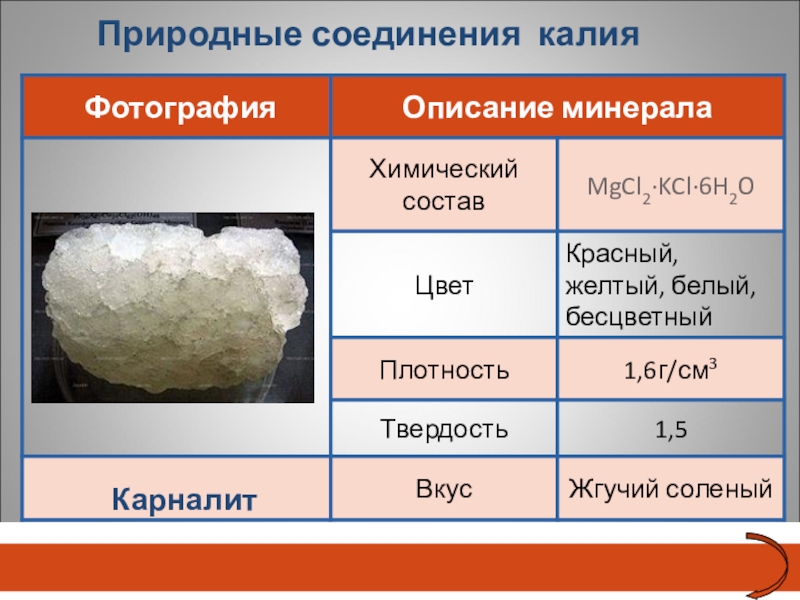
- 23. Природные соединения калияСильвин
- 24. Природные соединения калияКарналит
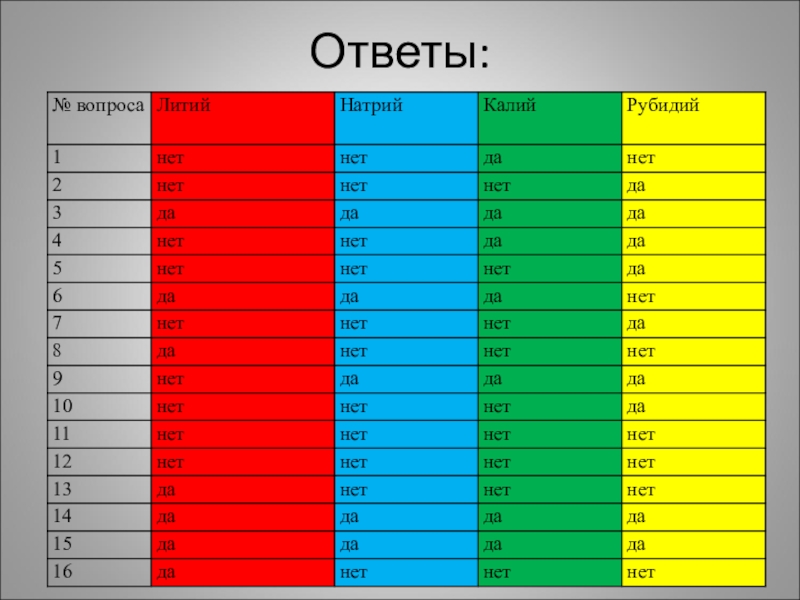
- 25. Ответы:
- 26. Проверка выполненных заданий:2М + 2H2O → 2МOH
- 27. сегодня на уроке… было интересно… было
- 28. Домашнее заданиеДайте характеристику химическим свойствам калия (записать
Слайд 2Происхождение названий
щелочных металлов
Li (1817) лат. " литос" - камень
Na (1807)
К (1807) араб. "алкали" - щелочь
Rb (1861) лат. "рубидус" - темно-красный
Cs (1860) лат. "цезиус" - небесно-голубой
Fr (1939) от названия страны Франция.
Слайд 3Положение в периодической системе химических элементов Д.И.Менделеева
I группа главная подгруппа.
Увеличивается
растет восстановительная способность
Слайд 6Химическая связь.
Тип кристаллической решетки
Металлическая связь
Кубическая объемноцентрированная кристаллическая решетка
Слайд 9Щелочные металлы – простые вещества
Литий
Натрий
Литий и натрий - мягкие щелочные металлы
Натрий – мягкий металл, его можно резать ножом.
Слайд 12Франций
Франций - щелочной металл, обладающий как радиоактивностью, так и высокой химической
Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов
Уран(235),
из которого поучают франций
Слайд 13
Химические свойства
щелочных металлов
Типичные металлы, очень сильные восстановители. В соединениях проявляют
Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды (кроме лития).
Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs
Слайд 14
Химические свойства
2Na + Cl2 = 2NaCl (в атмосфере
4Li + O2 = 2Li2O 2Na + O2 = Na2O2 K + O2 = KO2
оксид Li пероксид Na надпероксид K
3) 2Na + Н2 = 2NaН (при нагревании 200-400oC)
4) 6Li + N2 = 2Li3N (Li - при комнатной T, остальные щелочные Me -при нагревании)
5) 2Na + 2Н2О = 2NaОН + Н2
(Li - спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н2
Rb и Cs реагируют не только
с жидкой Н2О, но и со льдом. .
6) 2Na+ Н2SО4 = Na2SО4 + Н2
(протекают очень бурно)
Слайд 15
Качественное определение щелочных металлов
Li+
Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки.
Li+ - карминово-красный K+ - фиолетовый Cs+ фиолетово-синий
Na+ - желтый Rb + - красный
Слайд 16Получение щелочных металлов
1) Электролиз расплавов соединений щелочных металлов:
2МеCl = 2Ме +
4МеOH = 4Ме + 2Н2О + О2
2) Восстановление оксидов и гидроксидов щелочных металлов:
2Li2O + Si = 4Li + SiO2
KOH + Na = NаOH + K
Слайд 18 Li
Охладитель в ядерных реакторах
В медицине
В металлургии
При изготовлении фарфора
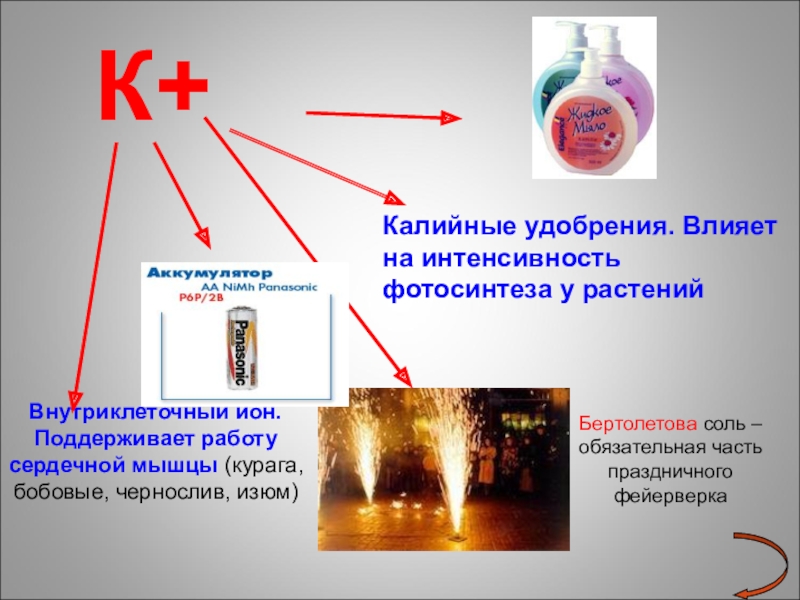
Слайд 19 К+
Внутриклеточный ион. Поддерживает работу сердечной мышцы
Калийные удобрения. Влияет на интенсивность фотосинтеза у растений
Бертолетова соль – обязательная часть праздничного фейерверка
Слайд 26Проверка выполненных заданий:
2М + 2H2O → 2МOH + H2 (щелочь и
2М + Cl2 → 2МCl (галогениды)
4Li + O2 → 2Li2O(оксид лития)
2Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (надпероксид калия)
2М + Н2 → 2МH (гидриды)
6М + N2 → 2М3N (нитриды)
Слайд 27сегодня на уроке…
было интересно… было трудно… я выполнял задания…
Слайд 28Домашнее задание
Дайте характеристику химическим свойствам калия (записать уравнения реакций и рассмотреть
учебник § 11, стр.52-54