- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Щелочные металлы
Содержание
- 1. Презентация по химии Щелочные металлы
- 2. Щелочные металлы — это элементы главной подгруппы
- 3. Литий (Li) Ли́тий — элемент главной подгруппы
- 4. Физические свойства Литий — серебристо-белый металл, мягкий и
- 5. Химические свойстваЛитий является наименее активным щелочным металлом,
- 6. В 1818 немецкий химик Леопольд
- 7. Нахождение в природе Содержание лития в верхней
- 8. Основные минералы лития слюда лепидолит KLi1,5Al1,5[Si3AlO10]пироксен сподумен
- 9. Месторождения лития известны в:России Мексике Боливии Аргентине
- 10. Применение Термоэлектрические материалыХимические источники токаРакетное топливоЛазерные материалыОкислителиДефектоскопияПиротехникаЭлектроникаМеталлургияЯдерная
- 11. Натрий (Na)На́трий — элемент главной подгруппы первой группы,
- 12. Физические свойства Натрий — серебристо-белый металл, в тонких
- 13. Химические свойства Щелочной металл, на воздухе легко
- 14. Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия».
- 15. Нахождение в природе Натрий по своей распространенности
- 16. Основные минералы натрияГалит(каменная соль) NaCl мирабилит (глауберова
- 17. Применение Как теплоноситель, а в сплаве с
- 18. Калий (К) Ка́лий — элемент главной
- 19. Физические свойстваКалий — серебристое вещество с характерным блеском
- 20. Химические свойства Элементарный калий, как и другие
- 21. Нахождение в природе в верхней континентальной корев морской водево всех живых клетках 2,4 % 380 мг/л
- 22. Основные минералы калияСильвин KCl Сильвинит KCl·NaCl Карналлит KCl·MgCl2·6H2O Каинит KCl·MgSO4·3H2O Поташ K2CO3
- 23. Применение Жидкий при комнатной температуре сплав калия
- 24. Спасибо за внимание!
Слайд 2
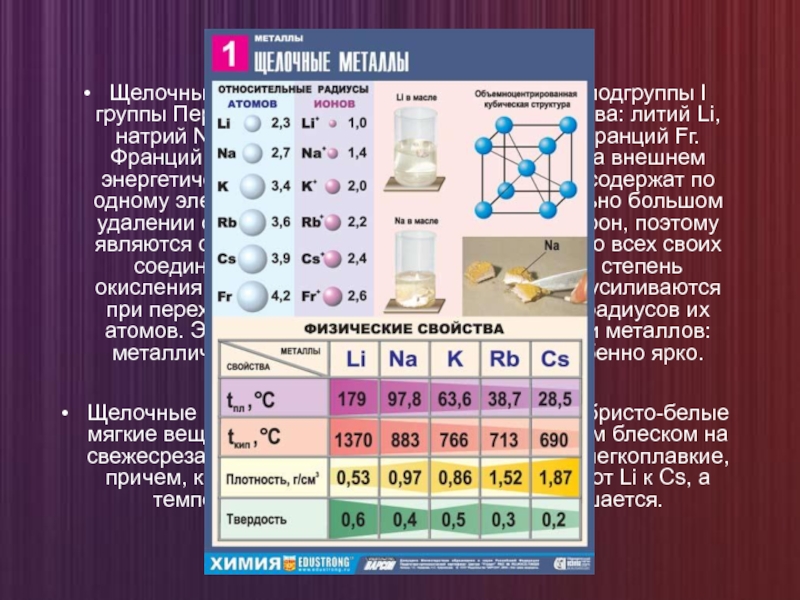
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы
Щелочные металлы — простые вещества. Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все они легкие и легкоплавкие, причем, как правило, плотность их возрастает от Li к Сs, а температура плавления, наоборот, уменьшается.
Слайд 3Литий (Li)
Ли́тий — элемент главной подгруппы первой группы, второго периода периодической
Слайд 4Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Слайд 5Химические свойства
Литий является наименее активным щелочным металлом, с сухим воздухом (и
Во влажном воздухе медленно реагирует с азотом. В кислороде при нагревании горит. Есть интересная особенность, что в интервале температур от 100 °C до 300 °C литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
Спокойно, без взрыва и возгорания, реагирует с водой. Реагирует также с этиловым спиртом (с образованием алкоголята), с водородом с образованием гидрида лития, с аммиаком и с галогенами (с йодом — только при нагревании)
Литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на кожу, слизистые оболочки и в глаза.
Слайд 6
В 1818 немецкий химик Леопольд Гмелин установил, что литий
Слайд 7Нахождение в природе
Содержание лития
в верхней континентальной коре
в морской воде
21 г/т
0,17 мг/л
Слайд 8
Основные минералы лития
слюда лепидолит
KLi1,5Al1,5[Si3AlO10]
пироксен сподумен
LiAl [Si2O6]
Когда литий
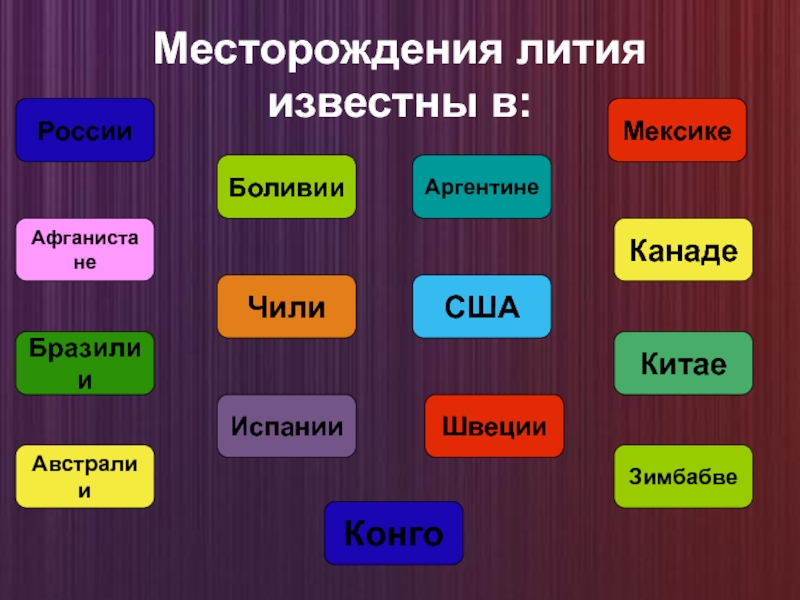
Слайд 9Месторождения лития известны в:
России
Мексике
Боливии
Аргентине
Афганистане
Канаде
Чили
США
Бразилии
Китае
Испании
Швеции
Австралии
Зимбабве
Конго
Слайд 10Применение
Термоэлектрические материалы
Химические источники тока
Ракетное топливо
Лазерные материалы
Окислители
Дефектоскопия
Пиротехника
Электроника
Металлургия
Ядерная энергетика
Сушка газов
Медицина
Смазочные материалы
Регенерация кислорода в
Силикатная промышленность
Текстильная промышленность
Пищевая промышленность
Слайд 11Натрий (Na)
На́трий — элемент главной подгруппы первой группы, третьего периода периодической системы
Слайд 12Физические свойства
Натрий — серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен,
Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C), температура плавления 97,86 °C, температура кипения 883,15 °C.
Под давлением становится прозрачным и красным, как рубин.
Слайд 13Химические свойства
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода
Натрий более активный чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность нитриду лития).
При большом избытке кислорода образуется пероксид натрия.
В воде натрий ведет себя почти так же, как литий: реакция идёт с бурным выделением водорода, в растворе образуется гидроксид натрия.
Слайд 14
Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии
Слайд 15Нахождение в природе
Натрий по своей распространенности в природе занимает 6 место
в верхней континентальной коре
в морской воде
в крови
(Осмотическое давление крови поддерживается на необходимом уровне в основном за счет хлорида натрия.)
2.3%
0.6%
1.05%
Слайд 16
Основные минералы натрия
Галит
(каменная соль)
NaCl
мирабилит (глауберова соль) Na2SО4 • 10Н2О
криолит Na3А1F6
бура (тетраборат натрия) Na2В4О7 • 10Н2О
Слайд 17Применение
Как теплоноситель, а в сплаве с калием — в атомной энергетике
В качестве катализатора
Для получения тугоплавких металлов
Пероксид натрия — для отбелки шерсти, тканей, шелка и др.
Гидроксид натрия - для очистки продуктов переработки нефти
Бромид натрия — используется в медицине и в фотографии
Фторид натрия — в сельском хозяйстве, для обработки древесины, в производстве эмалей и др.
Силикат натрия — растворимое стекло
Сульфат натрия — в стекольной, кожевенной, мыловаренной, текстильной, целлюлозно-бумажной промышленности
Хлорид натрия (поваренная соль) — в технике, медицине, в пищевой промышленности, для производства соды, едкого натра и др.
Сода кальцинированная (карбонат натрия) и питьевая (бикарбонат натрия) — основные продукты химической промышленности.
Слайд 18Калий (К)
Ка́лий — элемент главной подгруппы первой группы, четвёртого
Слайд 19Физические свойства
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности.
Очень
Относительно хорошо растворяется в ртути, образуя амальгамы.
Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Слайд 20Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические
На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат).
При длительном контакте с атмосферой способен полностью разрушиться.
С водой реагирует со взрывом.
Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью.
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия).
Слайд 21Нахождение в природе
в верхней континентальной коре
в морской воде
во всех живых клетках
380 мг/л
Слайд 22Основные минералы калия
Сильвин KCl
Сильвинит KCl·NaCl
Карналлит KCl·MgCl2·6H2O
Каинит KCl·MgSO4·3H2O
Поташ
Слайд 23Применение
Жидкий при комнатной температуре сплав калия и натрия используется в качестве
Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
Соли калия широко используются в гальванотехнике.
Бромид калия применяется в медицине и как успокаивающее средство для нервной системы.
Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ.
Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород.






![Презентация по химии Щелочные металлы Основные минералы лития слюда лепидолит KLi1,5Al1,5[Si3AlO10]пироксен сподумен LiAl [Si2O6] Когда литий Основные минералы лития слюда лепидолит KLi1,5Al1,5[Si3AlO10]пироксен сподумен LiAl [Si2O6] Когда литий не образует самостоятельных минералов, он изоморфно](/img/thumbs/726b1262d71e3ecd362633d722b0fe75-800x.jpg)