применяемое в технике, как серная кислота…»
(Д. И. Менделеев)
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Производство серной кислоты
Содержание
- 1. Презентация по химии Производство серной кислоты
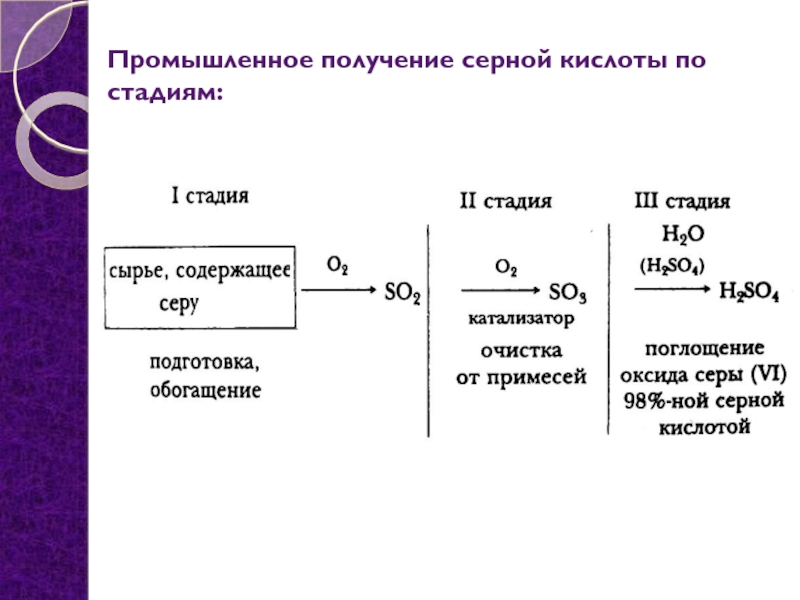
- 2. Промышленное получение серной кислоты по стадиям:
- 3. Исходное сырье.Сырьё – исходный материал для производства
- 4. Производство серной кислотыS(самородная сера) H2S(сероводород)FeS2 (пирит)Дымовые , топочные газыПобочные продукты других производств
- 5. FeS2 –пирит.Залегает в земной коре, горная порода,
- 6. Слайд 6
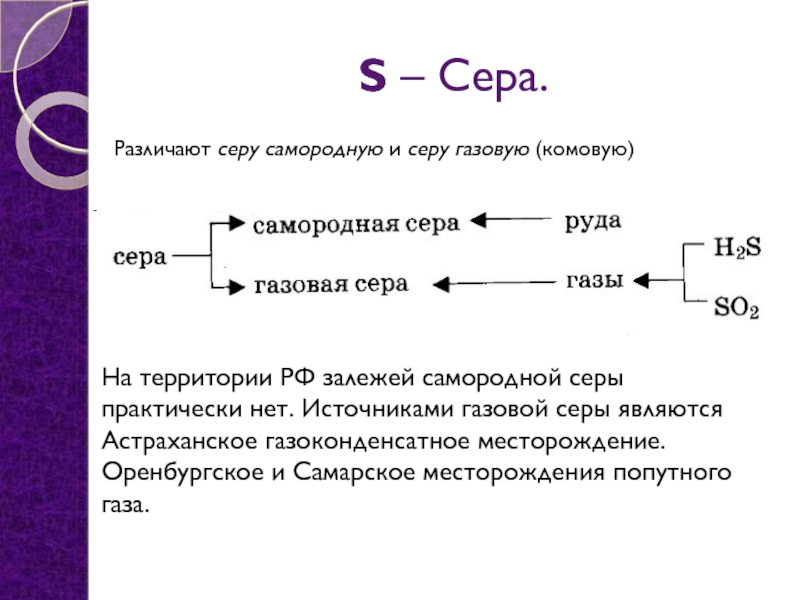
- 7. S – Сера.Различают серу самородную и серу
- 8. Получение газовой серы из сероводорода : H2S +
- 9. H2S Источником сероводорода служат различные горючие газы:
- 10. Прочие виды сырья Агломерационные газы получаются
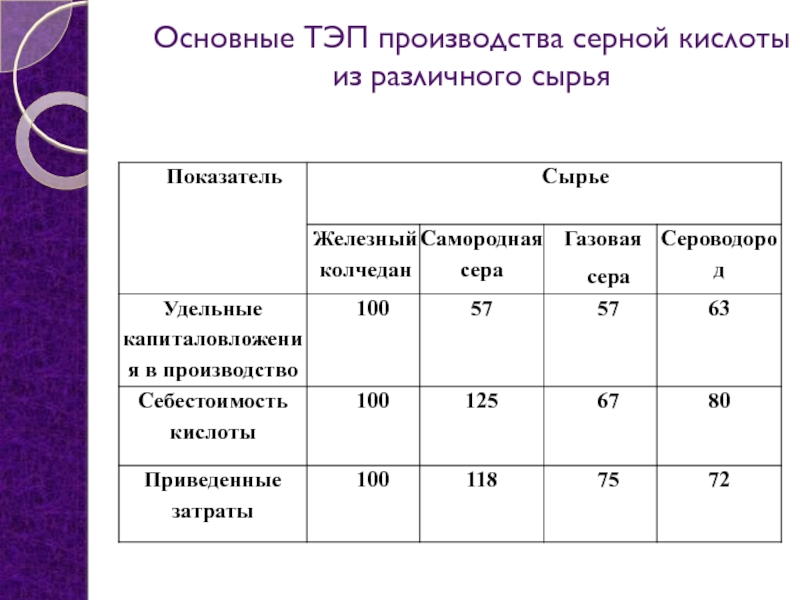
- 11. Основные ТЭП производства серной кислоты из различного сырья
- 12. В мире: 75% H2SO4 получают из S
Промышленное получение серной кислоты по стадиям:
Слайд 1Производство
серной кислоты.
« Едва найдется другое, искусственно добываемое вещество, столь часто
Слайд 3Исходное сырье.
Сырьё – исходный материал для производства промышленных продуктов.
Обогащение-процесс подготовки сырья,
направленный на повышение в нем полезных составных частей.
Флотация - способ разделения размельченной породы, основанный на различной смачиваемости минералов водой, через которую пропускают воздух (барботирование).
Флотация - способ разделения размельченной породы, основанный на различной смачиваемости минералов водой, через которую пропускают воздух (барботирование).
Слайд 4Производство серной кислоты
S
(самородная сера)
H2S(сероводород)
FeS2 (пирит)
Дымовые ,
топочные газы
Побочные продукты
других
производств
Слайд 5FeS2 –пирит.
Залегает в земной коре, горная порода, находится в смеси с
другими металлами: ZnS, CuS, NiS, CoS.
На территории РФ существуют залежи колчедана, на Урале и Кавказе, где его добывают в рудниках в виде рядового колчедана.
На территории РФ существуют залежи колчедана, на Урале и Кавказе, где его добывают в рудниках в виде рядового колчедана.
Слайд 7S – Сера.
Различают серу самородную и серу газовую (комовую)
На территории РФ
залежей самородной серы практически нет. Источниками газовой серы являются Астраханское газоконденсатное месторождение. Оренбургское и Самарское месторождения попутного газа.
Слайд 8
Получение газовой серы из сероводорода :
H2S + 1,5 O2 → S02
+ H2O
2H2S + S02 → 2H20 + 1.5S2
2H2S + O2 → 2Н2О + S2.
Является самым совершенным сырьём(легко сгорает не образуя побочных продуктов), но слишком дорога и является ценной для других производств.
2H2S + S02 → 2H20 + 1.5S2
2H2S + O2 → 2Н2О + S2.
Является самым совершенным сырьём(легко сгорает не образуя побочных продуктов), но слишком дорога и является ценной для других производств.
Слайд 9H2S
Источником сероводорода служат различные горючие газы: коксовый, генераторный, попутный, газы
нефтепереработки.
H2S + 3O2 → 2H2O (пар) + 3SO2
H2S + SO2 → 2H2O (пар) + S
(S – перевозят)
Хорошее сырьё, но H2S зависит от газодобычи.
Газы цветной металлургии.
В этих газах содержится от 4 до 10% оксида серы (IV) и они могут непосредственно использоваться для производства серной кислоты.
H2S + 3O2 → 2H2O (пар) + 3SO2
H2S + SO2 → 2H2O (пар) + S
(S – перевозят)
Хорошее сырьё, но H2S зависит от газодобычи.
Газы цветной металлургии.
В этих газах содержится от 4 до 10% оксида серы (IV) и они могут непосредственно использоваться для производства серной кислоты.
Слайд 10Прочие виды сырья
Агломерационные газы получаются при агломерации железной руды перед
загрузкой в доменные печи. Концентрация SO2 в таких газах составляет 0,5— 1.5%.
Топочные и горючие газы содержат сернистый ангидрид или сероводород. SO2 образуется при сжигании в топках угля, содержащего серу.
Гипс CaS04×2H2О и фосфогипс (отходы в производстве фосфорной кислоты и фосфорных удобрений) обжигают с углем и глиной. При этом восстановление сульфата кальция сопровождается образованием SO2; огарок измельчают и используют в качестве строительного материала (цемент).
Отработанные кислоты получаются при сульфировании, очистке нефтепродуктов, осушке и т. д. Отработанные кислоты термически разлагают, а образующийся при этом SO2 используют для получения серной кислоты.
Tpaвильные растворы получаются при травлении металлов серной кислотой. Они содержат 2—4% серной кислоты и до 25% FeSO4. Серную кислоту этих растворов нейтрализуют избытком огарка и сульфат восстанавливают углем в печи. Образующийся сернистый ангидрид используют для производства серной кислоты.
Алуниты K2S04-Ala(S04)3•2AI2О3•6Н20 обезвоживают и восстанавливают, при этом образуются SO2, используемый для производства серной кислоты, и глинозем А12О3, поступающий на производство алюминия.
Топочные и горючие газы содержат сернистый ангидрид или сероводород. SO2 образуется при сжигании в топках угля, содержащего серу.
Гипс CaS04×2H2О и фосфогипс (отходы в производстве фосфорной кислоты и фосфорных удобрений) обжигают с углем и глиной. При этом восстановление сульфата кальция сопровождается образованием SO2; огарок измельчают и используют в качестве строительного материала (цемент).
Отработанные кислоты получаются при сульфировании, очистке нефтепродуктов, осушке и т. д. Отработанные кислоты термически разлагают, а образующийся при этом SO2 используют для получения серной кислоты.
Tpaвильные растворы получаются при травлении металлов серной кислотой. Они содержат 2—4% серной кислоты и до 25% FeSO4. Серную кислоту этих растворов нейтрализуют избытком огарка и сульфат восстанавливают углем в печи. Образующийся сернистый ангидрид используют для производства серной кислоты.
Алуниты K2S04-Ala(S04)3•2AI2О3•6Н20 обезвоживают и восстанавливают, при этом образуются SO2, используемый для производства серной кислоты, и глинозем А12О3, поступающий на производство алюминия.
Слайд 12
В мире: 75% H2SO4 получают из S ( в США –
80%, в России – 60%); 20% - из пирита; 5% - H2S или SO2.
Вследствие сложностей с транспортом серной кислоты сернокислотные заводы располагаются преимущественно в районах ее потребления.
Поэтому производство серной кислоты развито во всех экономических районах РФ. Важнейшими центрами его являются: Щелково, Новомосковск, Воскресенск, Дзержинск, Березняки, Пермь.
Вследствие сложностей с транспортом серной кислоты сернокислотные заводы располагаются преимущественно в районах ее потребления.
Поэтому производство серной кислоты развито во всех экономических районах РФ. Важнейшими центрами его являются: Щелково, Новомосковск, Воскресенск, Дзержинск, Березняки, Пермь.