- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Периодический закон и периодическая система химических элементов Д.И.Менделеева
Содержание
- 1. Презентация по химии Периодический закон и периодическая система химических элементов Д.И.Менделеева
- 2. История открытия периодического закона1829 год –
- 3. 1869 год – Дмитрий Иванович
- 4. Физический смысл периодического законапериодическое изменение
- 5. Периоды – горизонтальные ряды элементов, расположенные в порядке увеличения атомных масс элементов
- 6. В периодах слева направо:1. Металлические свойства ослабевают,
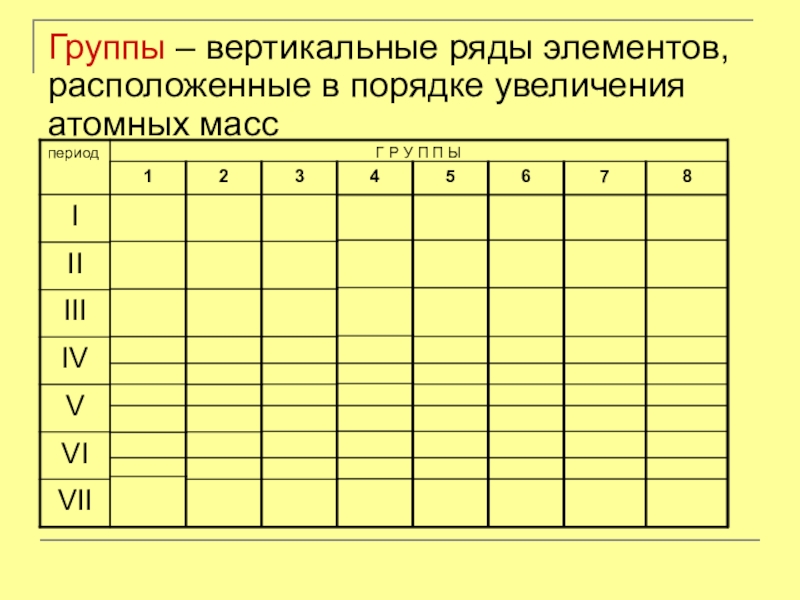
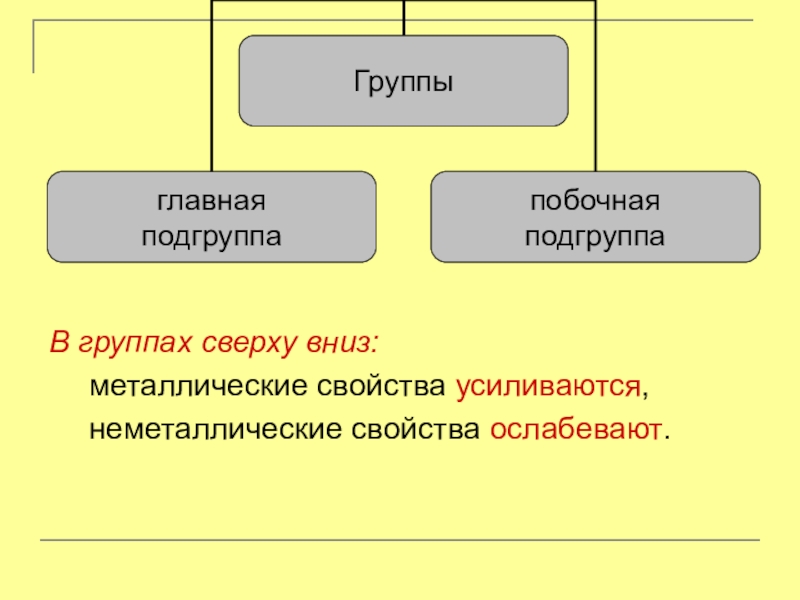
- 7. Группы – вертикальные ряды элементов, расположенные в порядке увеличения атомных масс
- 8. В группах сверху вниз: металлические свойства усиливаются, неметаллические свойства ослабевают.
- 9. общие формы кислородных соединений одинаковая высшая валентность элементов по кислородуПризнакигруппы
- 10. Значение периодического закона1. Развитие периодического закона позволили
- 11. План характеристики элемента по положению в периодической
- 12. Пример характеристики элемента азота на основании его
- 13. «Периодическому закону будущее не грозит разрушением,
История открытия периодического закона1829 год – Иоганн Вольфганг Дёберейнер (закон триад);1843 год – Леопольд Гмелин (таблица химически сходных элементов, расставленных по группам в определенном порядке);1863 год – Александр Эмиль Бегуйе де Шанкуртуа (винтовой график элементов
Слайд 1Урок
«Периодический закон
и периодическая система химических элементов
Д.И. Менделеева»
(8 класс)
Слайд 2История открытия
периодического закона
1829 год – Иоганн Вольфганг Дёберейнер (закон триад);
1843
год – Леопольд Гмелин (таблица химически сходных элементов, расставленных по группам в определенном порядке);
1863 год – Александр Эмиль Бегуйе де Шанкуртуа (винтовой график элементов – «земная спираль»);
1864 год – Джон Александр Рейна Ньюлендс (закон октав);
1864 год - Юлиус Лотар Мейер (таблица, в которой 44 элемента были расставлены в шести столбцах в соответствии с их валентностью по водороду).
1863 год – Александр Эмиль Бегуйе де Шанкуртуа (винтовой график элементов – «земная спираль»);
1864 год – Джон Александр Рейна Ньюлендс (закон октав);
1864 год - Юлиус Лотар Мейер (таблица, в которой 44 элемента были расставлены в шести столбцах в соответствии с их валентностью по водороду).
Слайд 31869 год –
Дмитрий Иванович
Менделеев
сформулировал
периодический закон:
Свойства элементов,
а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра атома (порядкового номера) элемента.
Слайд 4Физический смысл
периодического закона
периодическое изменение
свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и электронных структур атомов
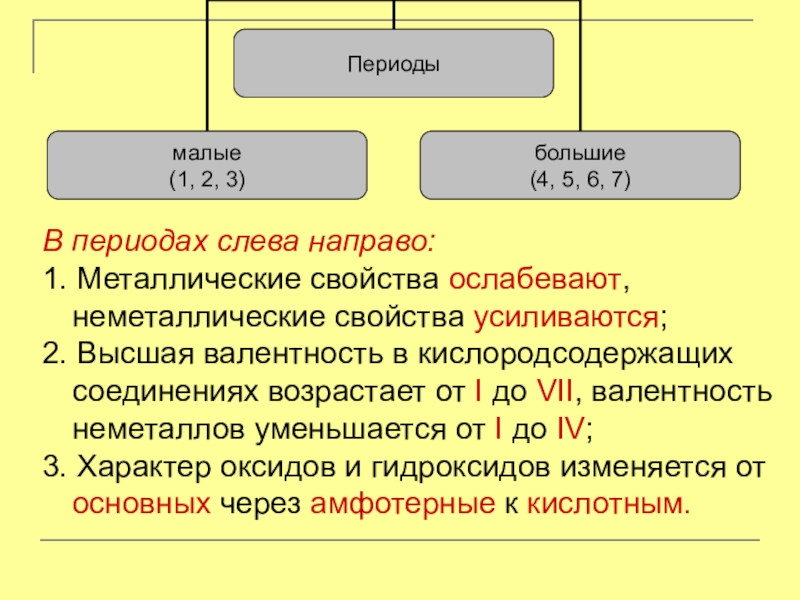
Слайд 5Периоды – горизонтальные ряды элементов, расположенные в порядке увеличения атомных масс
элементов
Слайд 6В периодах слева направо:
1. Металлические свойства ослабевают, неметаллические свойства усиливаются;
2. Высшая
валентность в кислородсодержащих соединениях возрастает от I до VII, валентность неметаллов уменьшается от I до IV;
3. Характер оксидов и гидроксидов изменяется от основных через амфотерные к кислотным.
3. Характер оксидов и гидроксидов изменяется от основных через амфотерные к кислотным.
Слайд 8
В группах сверху вниз:
металлические свойства усиливаются,
неметаллические свойства ослабевают.
Слайд 9
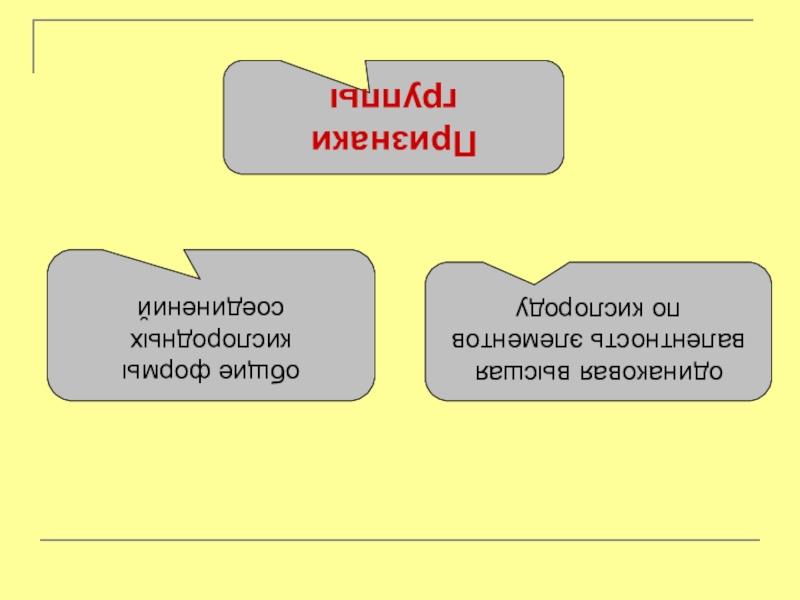
общие формы кислородных соединений
одинаковая высшая валентность элементов по кислороду
Признаки
группы
Слайд 10Значение периодического закона
1. Развитие периодического закона позволили выявить ряд новых характеристик
химических элементов и периодичность их изменения;
2. На основе периодического закона удалось предсказать и открыть урановые элементы;
3. Периодический закон и периодическая система имели большое значение для открытия радиоактивных изотопов.
2. На основе периодического закона удалось предсказать и открыть урановые элементы;
3. Периодический закон и периодическая система имели большое значение для открытия радиоактивных изотопов.
Слайд 11План характеристики элемента по положению в периодической системе
1. Нахождение в таблице
(период, ряд, группа, подгруппа, порядковый номер, атомная масса).
2. Строение атома.
3. Характер элемента (металл, неметалл или переходный).
4. Летучее водородное соединение.
5. Высший оксид, гидроксид, характер соединений.
6. Металлические или неметаллические свойства в сравнении с соседями.
2. Строение атома.
3. Характер элемента (металл, неметалл или переходный).
4. Летучее водородное соединение.
5. Высший оксид, гидроксид, характер соединений.
6. Металлические или неметаллические свойства в сравнении с соседями.
Слайд 12Пример характеристики элемента азота на основании его положения
в периодической системе
1.
2 период (малый), 2 ряд (четный), группа V, подгруппа главная, порядковый номер 7, относительная атомная масса 14.
2. Заряд ядра +7 N+7)2)5
Электронная формула 1s22s22p3.
3. Неметалл.
4. NH3 – аммиак.
5. N2O5, HNO3 – азотная кислота, кислотный.
6. C < N < O
V
Р
2. Заряд ядра +7 N+7)2)5
Электронная формула 1s22s22p3.
3. Неметалл.
4. NH3 – аммиак.
5. N2O5, HNO3 – азотная кислота, кислотный.
6. C < N < O
V
Р
Слайд 13«Периодическому закону будущее не грозит разрушением, а только надстройка и развитие
обещаются…»
Д.И. Менделеев