элементов
Окислители- это атомы элементов, которые принимают электроны.
Восстановители – это атомы элементов, которые отдают электроны.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Окислительно- восстановительные реакции (11 класс)
Содержание
- 1. Презентация по химии Окислительно- восстановительные реакции (11 класс)
- 2. Основные окислители:Типичные неметаллы (F2 ,Cl2 ,Br2 ,I2
- 3. Неметаллы- окислителиГалогены, выступая в качестве окислителей приобретают
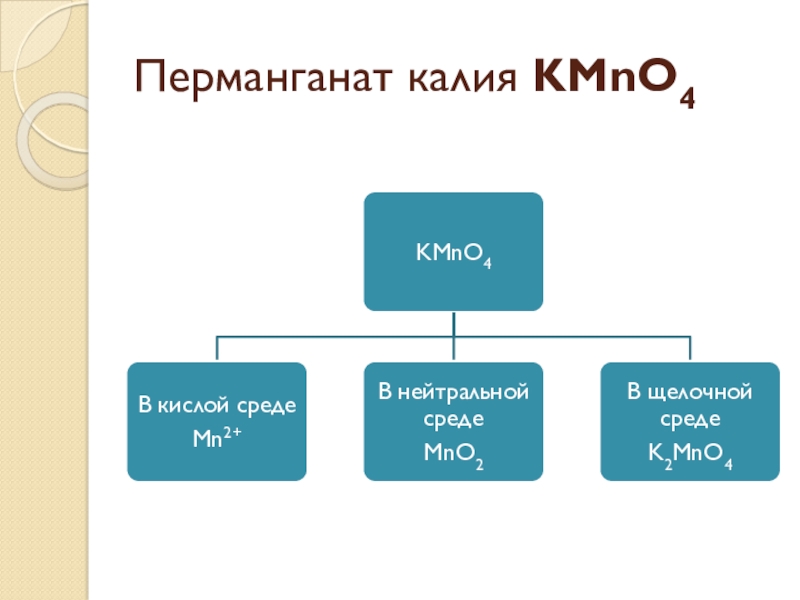
- 4. Перманганат калия KMnO4
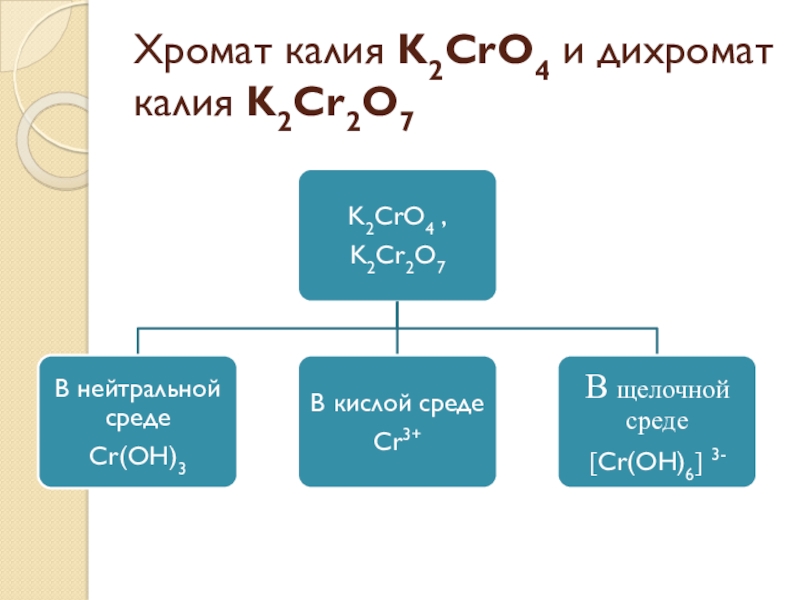
- 5. Хромат калия K2CrO4 и дихромат калия K2Cr2O7
- 6. Серная кислота H2SO4 (концентрированная) Пассивирует на холоде
- 7. Азотная кислота HNO3 (сильно разбавленная)Металлы в ряду активности от лития до цинка Me+HNO3 →MeNO3+H2O+NH4NO3Железо Fe+HNO3 →Fe(NO3)3+H2O+N2
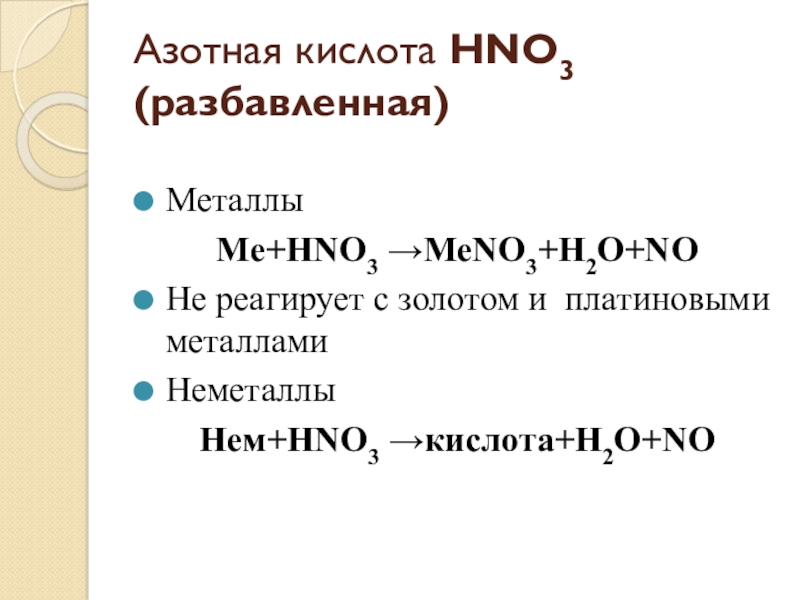
- 8. Азотная кислота HNO3 (разбавленная)Металлы Me+HNO3 →MeNO3+H2O+NOНе реагирует с золотом и платиновыми металлами Неметаллы Нем+HNO3 →кислота+H2O+NO
- 9. Азотная кислота HNO3 (концентрированная)Не реагирует с золотом
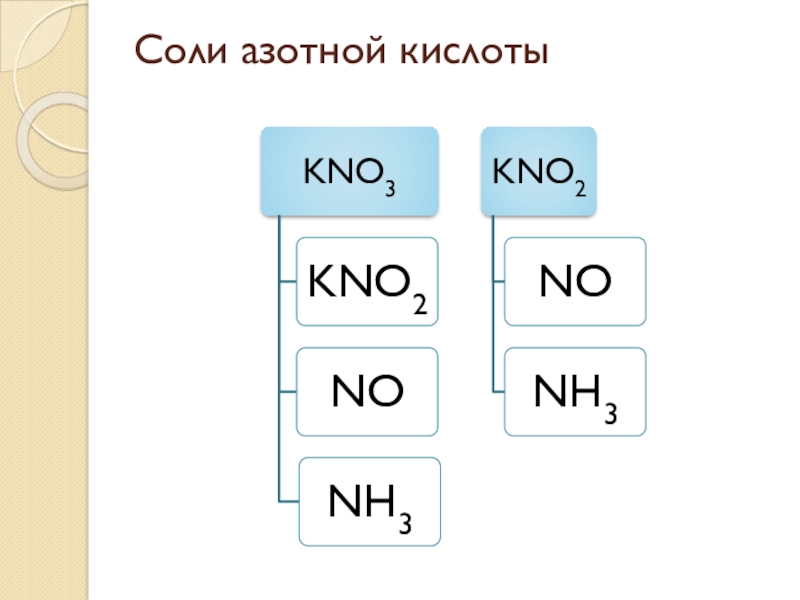
- 10. Соли азотной кислоты
- 11. Кислородсодержащие кислоты галогеновКислородсодержащие кислоты галогенов и их
- 12. Водород Н+1Водород в степени окисления +1 выступает
- 13. Ионы металлов в высшей степени окисления Выполняя
- 14. Основные восстановителиМеталлы Ме0-е=Ме+ Гидриды металлов I,II A
- 15. Основные восстановителиНеметаллы IV-VII A групп (чаще всего
- 16. Окислители и восстановителиТолько окислители- это атомы элементов
- 17. Окислительно- восстановительная двойственность Йод I2+H2S=2HI+S (окислитель)I2+5Cl2+6H2O=2HIO3+10HCl (восстановитель)Пероксид водорода5H2O2+I2=2HIO3+4H2O (окислитель)3H2O2+2KMnO4=2MnO2+2KOH+3O2+2H2O (восстановитель)
- 18. Окислительно- восстановительная двойственность Азотистая кислота и ее
- 19. Окислительно- восстановительная двойственность Реакции конпропорционирования2H2S+SO2=3S+2H2O Реакции диспропорционирования 3S+6NaOH=2Na2S+Na2SO3+3H2OВнутримолекулярное окисление и восстановление 2KClO3=2KCl+3O2 (катализатор MnO2)
Основные окислители:Типичные неметаллы (F2 ,Cl2 ,Br2 ,I2 ,O2 ,O3). Кислородсодержащие кислоты и соли (H2SO4 ,HNO3 ,KMnO4 K2CrO4,K2Cr2O7 , HClO ,HClO3 ,HBrO3).Водород (Н)в степени окисления +1Ионы металлов, находящихся в высшей степени окисления (Fe3+ ,Cu2+ ,Hg2+)
Слайд 1Окислительно- восстановительные реакции
ОВР – это реакции, протекающие с изменением степени окисления
Слайд 2Основные окислители:
Типичные неметаллы (F2 ,Cl2 ,Br2 ,I2 ,O2 ,O3).
Кислородсодержащие кислоты
и соли (H2SO4 ,HNO3 ,KMnO4 K2CrO4,K2Cr2O7 , HClO ,HClO3 ,HBrO3).
Водород (Н)в степени окисления +1
Ионы металлов, находящихся в высшей степени окисления (Fe3+ ,Cu2+ ,Hg2+)
Водород (Н)в степени окисления +1
Ионы металлов, находящихся в высшей степени окисления (Fe3+ ,Cu2+ ,Hg2+)
Слайд 3Неметаллы- окислители
Галогены, выступая в качестве окислителей приобретают степень окисления -1
F2 →F-1,
Cl2 →Cl-1, I2 →I-1
Кислород, выступая в качестве окислителя приобретает степень окисления -2 (H2O ,
OH- или О-2)
O2 →H2O O2 →OH-1
Озон
О3→О2+О-2
Кислород, выступая в качестве окислителя приобретает степень окисления -2 (H2O ,
OH- или О-2)
O2 →H2O O2 →OH-1
Озон
О3→О2+О-2
Слайд 6Серная кислота H2SO4 (концентрированная)
Пассивирует на холоде Fe, Cr, Al
При нагревании
Fe, Cr, Al:
Me+ H2SO4→Me2(SO4)3+SO2+H2O
Щелочные и щелочноземельные металлы
Me+ H2SO4→Me SO4+H2S+H2O
Цинк
Zn + H2SO4→ ZnSO4+H2O +H2S(SO2 ,S )
Не реагирует с платиновыми и благородными металлами
Все остальные металлы
Me+ H2SO4→MeSO4+SO2+H2O
Неметаллы
Нем + H2SO4 →кислота+SO2+H2O
Me+ H2SO4→Me2(SO4)3+SO2+H2O
Щелочные и щелочноземельные металлы
Me+ H2SO4→Me SO4+H2S+H2O
Цинк
Zn + H2SO4→ ZnSO4+H2O +H2S(SO2 ,S )
Не реагирует с платиновыми и благородными металлами
Все остальные металлы
Me+ H2SO4→MeSO4+SO2+H2O
Неметаллы
Нем + H2SO4 →кислота+SO2+H2O
Слайд 7Азотная кислота HNO3 (сильно разбавленная)
Металлы в ряду активности от лития до
цинка
Me+HNO3 →MeNO3+H2O+NH4NO3
Железо
Fe+HNO3 →Fe(NO3)3+H2O+N2
Me+HNO3 →MeNO3+H2O+NH4NO3
Железо
Fe+HNO3 →Fe(NO3)3+H2O+N2
Слайд 8Азотная кислота HNO3 (разбавленная)
Металлы
Me+HNO3 →MeNO3+H2O+NO
Не реагирует с золотом и платиновыми
металлами
Неметаллы
Нем+HNO3 →кислота+H2O+NO
Неметаллы
Нем+HNO3 →кислота+H2O+NO
Слайд 9Азотная кислота HNO3 (концентрированная)
Не реагирует с золотом и платиновыми металлами
На
холоде пассивирует железо, алюминий, хром
Железо, алюминий, хром при нагревании
Me+HNO3 →Me(NO3)3+H2O+NO2
S- элементы I и II группы
Me+HNO3 →MeNO3+H2O+N2O
Все остальные металлы
Me+HNO3 →MeNO3+H2O+NO2
Неметаллы
Нем+HNO3 →кислоты+H2O+NO2
Железо, алюминий, хром при нагревании
Me+HNO3 →Me(NO3)3+H2O+NO2
S- элементы I и II группы
Me+HNO3 →MeNO3+H2O+N2O
Все остальные металлы
Me+HNO3 →MeNO3+H2O+NO2
Неметаллы
Нем+HNO3 →кислоты+H2O+NO2
Слайд 11Кислородсодержащие кислоты галогенов
Кислородсодержащие кислоты галогенов и их соли, действуя в качестве
окислителей, восстанавливаются до степени окисления галогенов -1 (хлор или бром) или 0 (йод)
Слайд 12Водород Н+1
Водород в степени окисления +1 выступает как окислитель преимущественно в
растворах кислот (при взаимодействии кислоты и металла) или в составе воды
Me+HCl →MeCl+H2
K+H2O → KOH+H2
Me+HCl →MeCl+H2
K+H2O → KOH+H2
Слайд 13Ионы металлов в высшей степени окисления
Выполняя функцию окислителей, ионы металлов
, находящиеся в высшей степени окисления , превращаются в ионы с более низкой степенью окисления:
Cu+2+1e → Cu+1
Hg+2+1e → Hg+1
Fe+3+1e → Fe+2
Cr+3+1e → Cr+2
Cu+2+1e → Cu+1
Hg+2+1e → Hg+1
Fe+3+1e → Fe+2
Cr+3+1e → Cr+2
Слайд 14Основные восстановители
Металлы
Ме0-е=Ме+
Гидриды металлов I,II A групп
2МеН-2е=Н2
МеН2-2е=Н2
Катионы металлов в низшей + степени окисления:
Cu+1-1e → Cu+2
Hg+1-1e → Hg+2
Fe+2-1e → Fe+3
Cr+2-1e → Cr+3
Катионы металлов в низшей + степени окисления:
Cu+1-1e → Cu+2
Hg+1-1e → Hg+2
Fe+2-1e → Fe+3
Cr+2-1e → Cr+3
Слайд 15Основные восстановители
Неметаллы IV-VII A групп (чаще всего H2,C,P,S)
H2-2e=2H+
C0-2e=C+2
C0-4e=C+4
P0-3e=P+3
P0-5e=P+5
S0-4e=S+4
S0-6e=S+6
Соединения неметаллов в низшей степени окисления
2Hal-1-2e=Hal20
H2S-ne=S(SO2,H2SO4)
2NH3-6e=N2O
Слайд 16Окислители и восстановители
Только окислители- это атомы элементов в своей положительной высшей
степени окисления.
Только восстановители – это атомы элементов в своей низшей отрицательной степени окисления.
Окислительно- восстановительную двойственность проявляют атомы элементов с промежуточной валентностью.
Только восстановители – это атомы элементов в своей низшей отрицательной степени окисления.
Окислительно- восстановительную двойственность проявляют атомы элементов с промежуточной валентностью.
Слайд 17Окислительно- восстановительная двойственность
Йод
I2+H2S=2HI+S (окислитель)
I2+5Cl2+6H2O=2HIO3+10HCl (восстановитель)
Пероксид водорода
5H2O2+I2=2HIO3+4H2O (окислитель)
3H2O2+2KMnO4=2MnO2+2KOH+
3O2+2H2O (восстановитель)
Слайд 18Окислительно- восстановительная двойственность
Азотистая кислота и ее соли
2NaNO2+2NaI+2H2SO4=2NO+I2+2Na2SO4+2H2O (окислитель)
5HNO2+2KMnO4+3H2SO4=5HNO3+2MnSO4+K2SO4+3H2O (восстановитель)
Галогены в щелочной среде участвуют в реакциях диспропорционирования
Cl2+2KOH=KOCl+KCl+H2O (холод)
3Cl2+6KOH=KClO3+5KCl+3H2O (при нагревании)
Слайд 19Окислительно- восстановительная двойственность
Реакции конпропорционирования
2H2S+SO2=3S+2H2O
Реакции диспропорционирования
3S+6NaOH=2Na2S+Na2SO3+3H2O
Внутримолекулярное окисление и восстановление
2KClO3=2KCl+3O2
(катализатор MnO2)