- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Неорганические кислоты
Содержание
- 1. Презентация по химии Неорганические кислоты
- 2. Кислоты – это сложные вещества, молекулы которых
- 3. Формулы и названия некоторых неорганических кислот
- 4. Классификация кислотпо содержанию кислорода
- 5. Классификация кислот
- 6. Получение кислотБескислородные кислоты получают:взаимодействием неметалла с водородом:H2
- 7. Получение кислотдействием на соль более сильной или
- 8. Получение кислотКислородсодержащие кислоты можно получить:взаимодействием кислотных оксидов
- 9. Получение кислотдействием на соль более сильной кислотой:Na2SiO3 + H2SO4 = H2SiO3 + Na2SO4+==+
- 10. Химические свойства кислотИзменение окраски индикатора
- 11. Химические свойства кислотКислоты реагируют с основаниями, образуя
- 12. Химические свойства кислотКислоты взаимодействуют с основными и
- 13. Zn + H2SO4ZnSO4 + H2
- 14. Химические свойства кислотКислоты вступают в реакции обмена
- 15. Химические свойства кислотРеакции обмена кислот с солями
- 16. 2NaCl+H2SO4 2HCl + Na2SO4
- 17. Химические свойства кислотПри нагревании некоторые кислоты разлагаются:H2SiO3 =t=SiO2 + H2O=t=+
- 18. Химические свойства кислотКислоты взаимодействуют с металлами, которые:стоят
- 19. Применение кислотМинеральные кислоты используются в различных отраслях
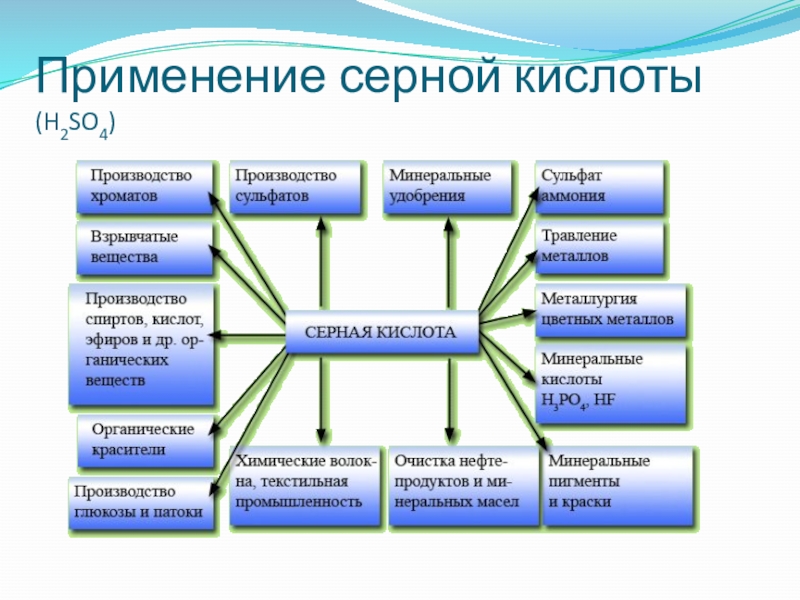
- 20. Применение серной кислоты (H2SO4)
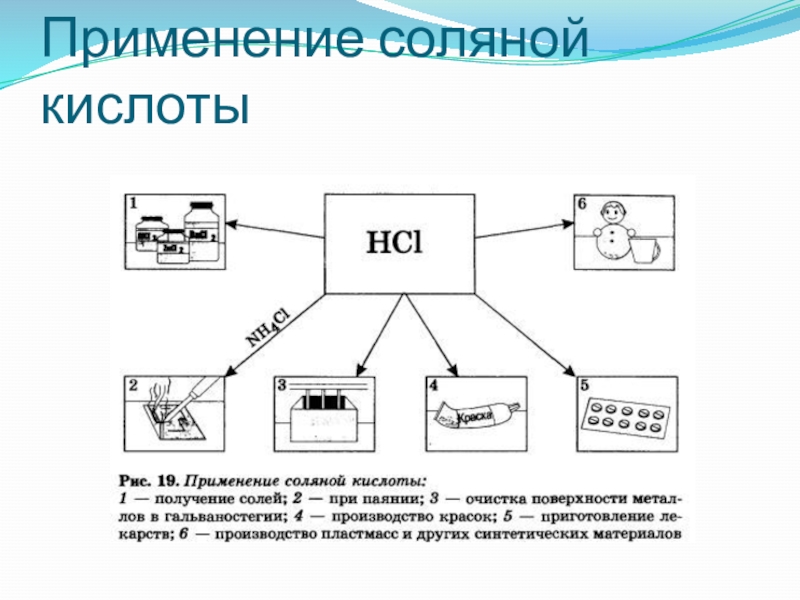
- 21. Применение соляной кислоты
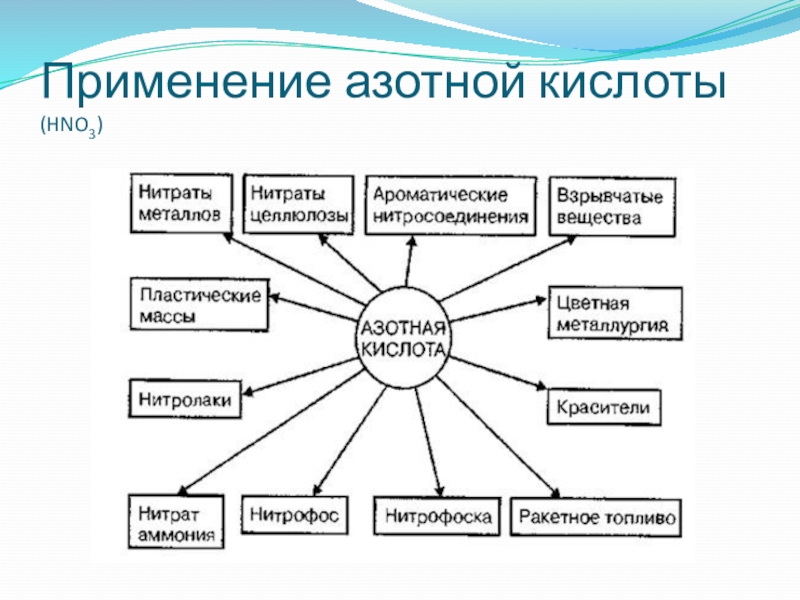
- 22. Применение азотной кислоты (HNO3)
- 23. Применение угольной кислотыУгольная кислота всегда присутствует в
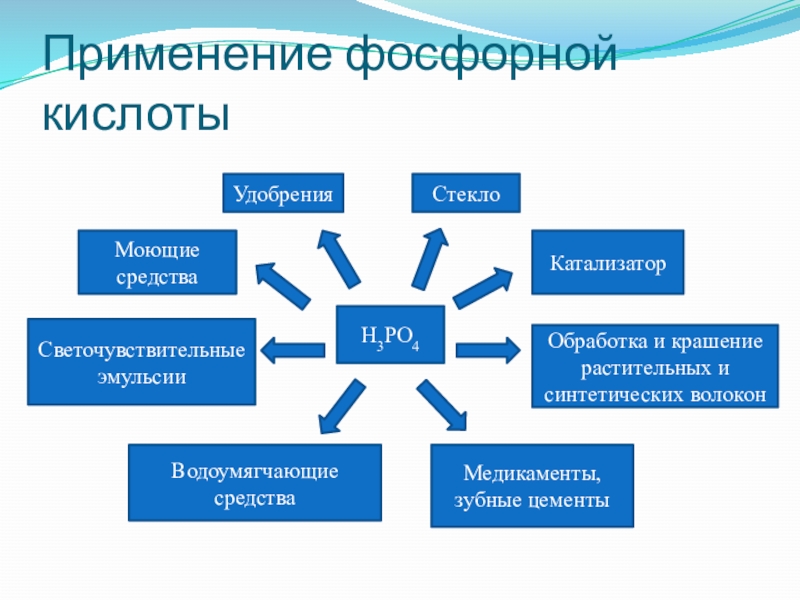
- 24. Применение фосфорной кислотыУдобренияМоющие средстваСветочувствительные эмульсииСтеклоКатализаторОбработка и крашение растительных и синтетических волоконВодоумягчающие средстваМедикаменты, зубные цементыH3PO4
- 25. Применение сероводородной кислотыВзрывчатые веществаОчистка поверхности металловH2SОчистка нефтепродуктовДругие кислотыУдобренияПластмассыКрасителиИскусственное волокноГербицид
- 26. Применение плавиковой кислотыТравление силикатного стекла СиликатыСмазочные маслаФторорганические соединенияФториды, кремнефториды и борфторидыТравление кремния ПластмассыHF
- 27. Тест1.Общая формула кислот: HxOy HnK MenKm Men(OH)m
- 28. 2.Выбрать букву под которой записана слабая кислота:HNO3H2SO4HClHNO2
- 29. 3.Кислоты не взаимодействуют с: основаниями основными и
- 30. 4. Фосфорная кислота применяется: в производстве светочувствительных
- 31. 5. Плавиковая кислота – тривиальное название:H2SO4HFH3PO4HCl
- 32. Ответы- B- D- C- A- B
- 33. СПАСИБО ЗА ВНИМАНИЕ!
Слайд 1НЕОРГАНИЧЕСКИЕ КИСЛОТЫ
Руководитель проекта :
учитель химии высшей квалификационной категории
Гук Светлана
МБОУ «Средняя общеобразовательная школа №9 с углубленным изучением китайского языка г. Владивостока»
Слайд 2Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода,
Слайд 4Классификация кислот
по содержанию кислорода
кислородосодержащие
HNO3, H2SO4, H3PO4 HCl, HI, H2S
по основности
(по числу атомов водорода в молекуле кислоты)
одноосновные многоосновные
HCl, HNO3, HBr H2SO4, H3PO4, H2S
по растворимости
растворимые нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
Слайд 5Классификация кислот
Летучие Нелетучие
HNO3, H2S, HCl H2SO4, H3PO4, H2SiO3, HI
по силе (по степени диссоциации)
Сильные (α =100 %) Слабые (α < 100 %)
HCl, HNO3, H2SO4, HBr H2S, HNO2, H2CO3 *, H2SO3*
* - неустойчивое соединение
Слайд 6Получение кислот
Бескислородные кислоты получают:
взаимодействием неметалла с водородом:
H2 + Cl2 = 2HCl
Горение водорода в хлоре
Подтверждение наличия соляной кислоты универсальной индикаторной бумагой
Слайд 7Получение кислот
действием на соль более сильной или менее летучей кислотой:
FeS +
NaCl + H2SO4 = NaHSO4 + HCl
тв. конц.
Полученные газообразные водородные соединения растворяют в воде.
+
=
+
Слайд 8Получение кислот
Кислородсодержащие кислоты можно получить:
взаимодействием кислотных оксидов с водой:
SO3 + H2O
N2O5 + H2O = 2HNO3
+
=
Слайд 9Получение кислот
действием на соль более сильной кислотой:
Na2SiO3 + H2SO4 = H2SiO3
+
=
=
+
Слайд 11Химические свойства кислот
Кислоты реагируют с основаниями, образуя соль и воду (реакция
H2SO4 + 2KOH = K2SO4 + 2H2O
+
+
=
Слайд 12Химические свойства кислот
Кислоты взаимодействуют с основными и амфотерными оксидами:
MgO + H2SO4
основный оксид
ZnO + 2HNO3 = Zn(NO3)2 + H2O
амфотерный оксид
+
+
=
Слайд 14Химические свойства кислот
Кислоты вступают в реакции обмена с солями согласно правилу:
Na2S + 2HCl = 2NaCl + H2S
+
=
+
Слайд 15Химические свойства кислот
Реакции обмена кислот с солями возможны в том случае,
осадок HCl + AgNO3 = AgCl + HNO3 ;
H2SO4 + Na2SiO3 = H2SiO3 + Na2SO4
более слабая, неустойчивая или более летучая кислота
Na2CO3 + 2HCl = 2NaCl + H2O +CO2
Слайд 17Химические свойства кислот
При нагревании некоторые кислоты разлагаются:
H2SiO3 =t=SiO2 + H2O
=t=
+
Слайд 18Химические свойства кислот
Кислоты взаимодействуют с металлами, которые:
стоят в ряду активности до
образуют с этими кислотами растворимые соли
Слайд 19Применение кислот
Минеральные кислоты используются в различных отраслях промышленности: в металло -
Слайд 23Применение угольной кислоты
Угольная кислота всегда присутствует в водных растворах углекислого газа
В биохимии позволяет H2CO3 регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Слайд 24Применение фосфорной кислоты
Удобрения
Моющие средства
Светочувствительные эмульсии
Стекло
Катализатор
Обработка и крашение растительных и синтетических волокон
Водоумягчающие
Медикаменты, зубные цементы
H3PO4
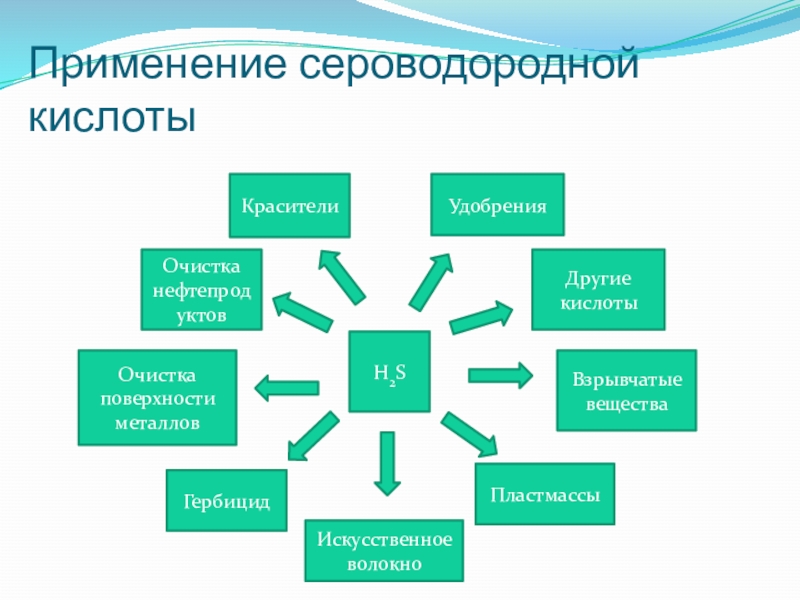
Слайд 25Применение сероводородной кислоты
Взрывчатые вещества
Очистка поверхности металлов
H2S
Очистка нефтепродуктов
Другие кислоты
Удобрения
Пластмассы
Красители
Искусственное волокно
Гербицид
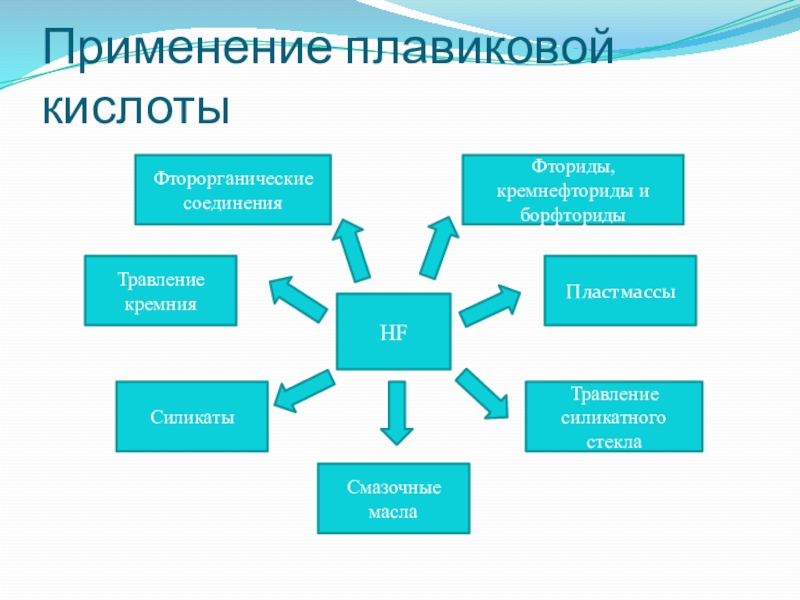
Слайд 26Применение плавиковой кислоты
Травление силикатного стекла
Силикаты
Смазочные масла
Фторорганические соединения
Фториды, кремнефториды и борфториды
Травление
Пластмассы
HF
Слайд 293.Кислоты не взаимодействуют с:
основаниями
основными и амфотерными оксидами
металлами стоящими
солями при определенном условии
Слайд 304. Фосфорная кислота применяется:
в производстве светочувствительных эмульсий
в сельском хозяйстве
в производстве смазочных масел
в производстве взрывчатых веществ