- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему:Фосфор и его соединения.
Содержание
- 1. Презентация по химии на тему:Фосфор и его соединения.
- 2. Слайд 2
- 3. ПРОИСХОЖДЕНИЕ НАЗВАНИЯЯ светоносный элемент.Я спичку вам зажгу
- 4. ФОСФОР И ЕГО СОЕДИНЕНИЯФосфор Р +15)2е)8е)5е
- 5. РМИНЕРАЛЫФОСФОЛИПИДЫ,ФЕРМЕНТЫ,ФОСФАТ КАЛЬЦИЯ, ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫВ ЗУБАХ
- 6. ПОЛУЧЕНИЕФосфор производят в электрических печах, восстанавливая апатит
- 7. ФИЗИЧЕСКИЕ СВОЙСТВАЭлементарный фосфор в обычных условиях представляет
- 8. Молекулы P4 имеют форму тетраэдра.
- 9. Существует несколько форм красного фосфора
- 10. Черный фосфор имеет слоистую атомную
- 11. С металлами:C неметаллами:
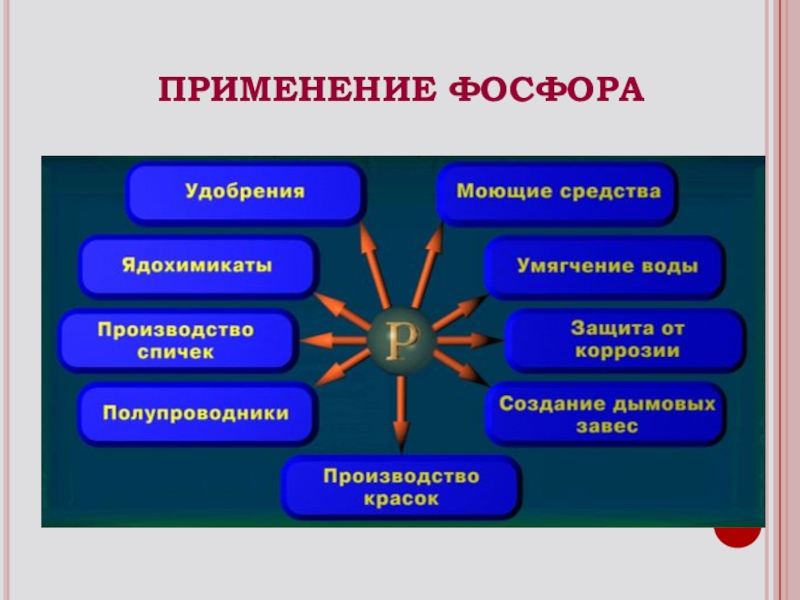
- 12. ПРИМЕНЕНИЕ ФОСФОРА
- 13. СОЕДИНЕНИЯ ФОСФОРАР2O5HPO3метафосфорнаякислотаH4P2O7пирофосфорнаякислотаH3PO4ортофосфорнаякислотаФОСФАТЫCa3(PO4)2Р2O5Р2O5HPO3метафосфорнаякислотаГИДРОФОСФАТЫCaНPO4H3PO4ортофосфорнаякислотаФОСФАТЫCa3(PO4)2ДИГИДРОФОСФАТЫCa(Н2PO4)2H4P2O7пирофосфорнаякислота
- 14. ФИЗИЧЕСКИЕ СВОЙСТВА P2O5 Белый, рыхлый порошок, гигроскопичный. Хранят в герметически закрытых сосудах.
- 15. ХИМИЧЕСКИЕ СВОЙСТВА P2O5 Проявляет свойства кислотного оксида.
- 16. С металламиС основаниямиС оксидамиметалловС солямиH3PO4ОРТОФОСФОРНАЯ КИСЛОТА ВЗАИМОДЕЙСТВУЕТ:H3PO4С оксидамиметалловС солямиС металламиС основаниями
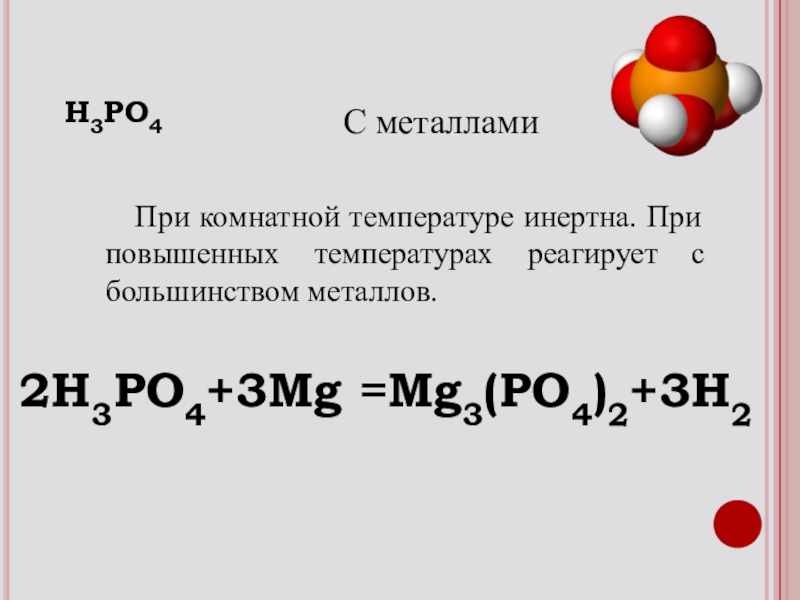
- 17. При комнатной температуре инертна. При повышенных температурах реагирует с большинством металлов.2H3PO4+3Mg =Mg3(PO4)2+3H2С металламиH3PO4
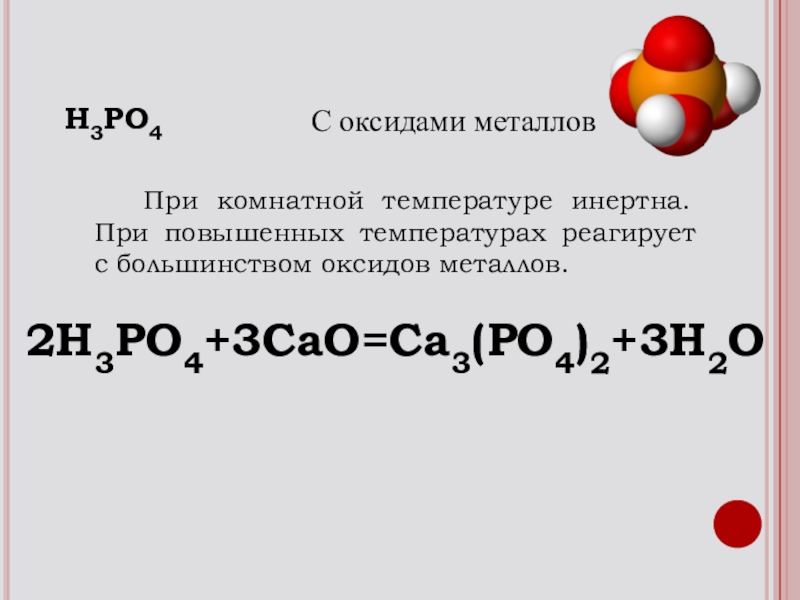
- 18. При комнатной температуре инертна. При повышенных температурах реагирует с большинством оксидов металлов.2H3PO4+3CaO=Ca3(PO4)2+3H2OH3PO4С оксидами металлов
- 19. Фосфорная кислота является относительно слабой
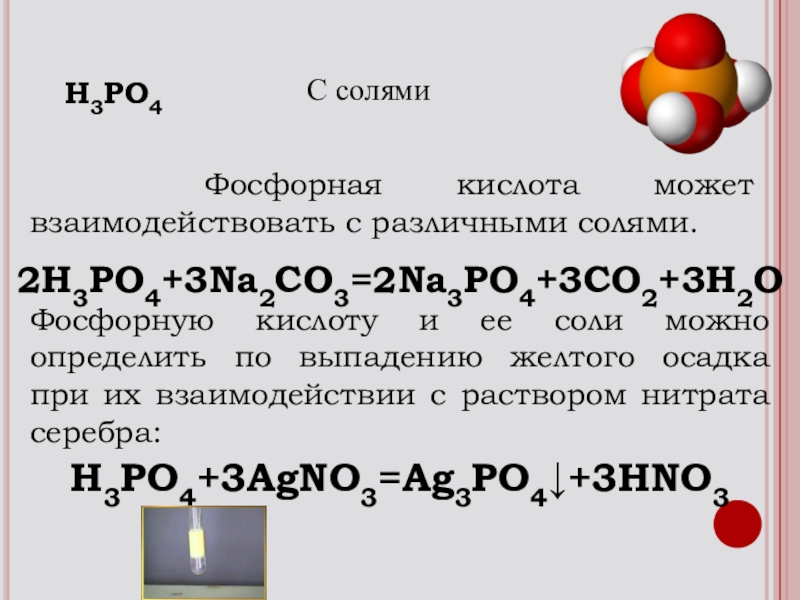
- 20. Фосфорная кислота может взаимодействовать с
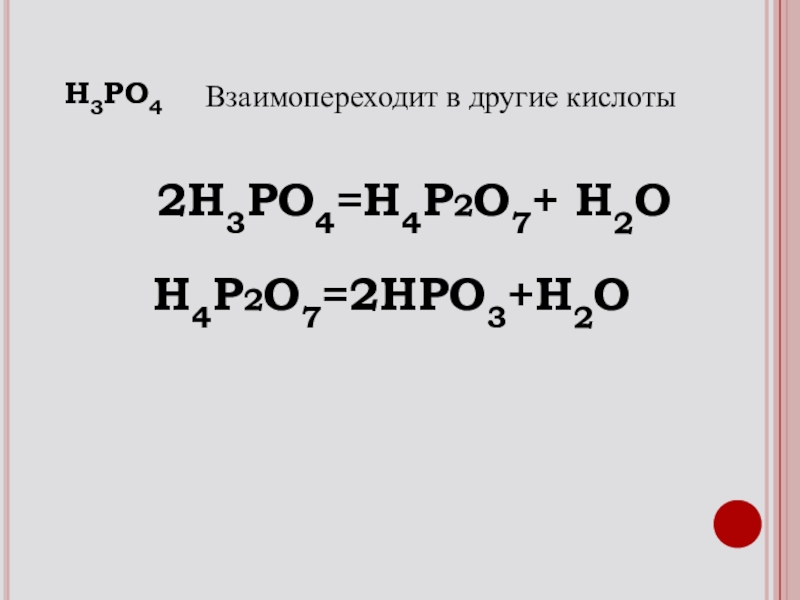
- 21. 2H3PO4=H4P2O7+ H2OH3PO4Взаимопереходит в другие кислотыH4P2O7=2HPO3+H2O
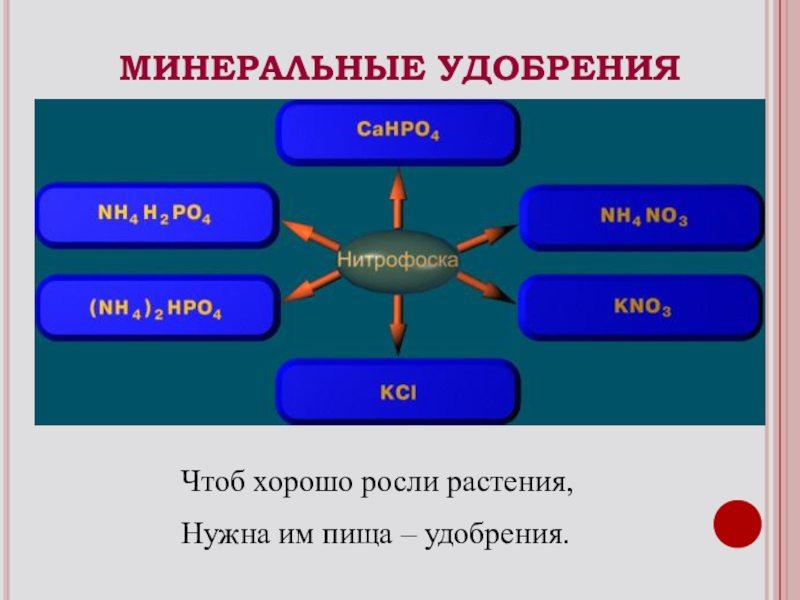
- 22. МИНЕРАЛЬНЫЕ УДОБРЕНИЯЧтоб хорошо росли растения, Нужна им пища – удобрения.
- 23. ДОМАШНЕЕ ЗАДАНИЕ§27, упр. 2-6, пр.р. №6 стр.146-147,
Слайд 3ПРОИСХОЖДЕНИЕ НАЗВАНИЯ
Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня –
Оксид мой станет кислотой.
V
Слайд 4ФОСФОР И ЕГО СОЕДИНЕНИЯ
Фосфор Р +15)2е)8е)5е 15р,15е,16п
Решётки
( молекулярная Р4,
Атомные Р8)
Слайд 5
Р
МИНЕРАЛЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ,
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
АПАТИТ
ФОСФОРИТ
БИРЮЗА
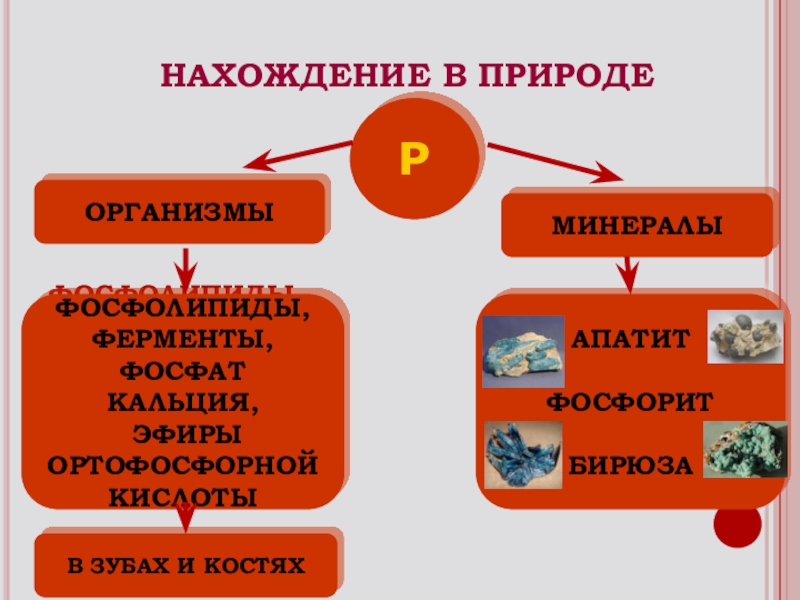
НАХОЖДЕНИЕ В ПРИРОДЕ
Р
ОРГАНИЗМЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ,
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
МИНЕРАЛЫ
АПАТИТ
ФОСФОРИТ
БИРЮЗА
Слайд 6ПОЛУЧЕНИЕ
Фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема:
Ca3(PO4)2+3SiO2+5C=3CaSiO3+
5CO+2P
Пары
Печь для добывания фосфора
Слайд 7ФИЗИЧЕСКИЕ СВОЙСТВА
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических
Слайд 8 Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС,
БЕЛЫЙ ФОСФОР
Слайд 9 Существует несколько форм красного фосфора Их структуры окончательно не
КРАСНЫЙ ФОСФОР
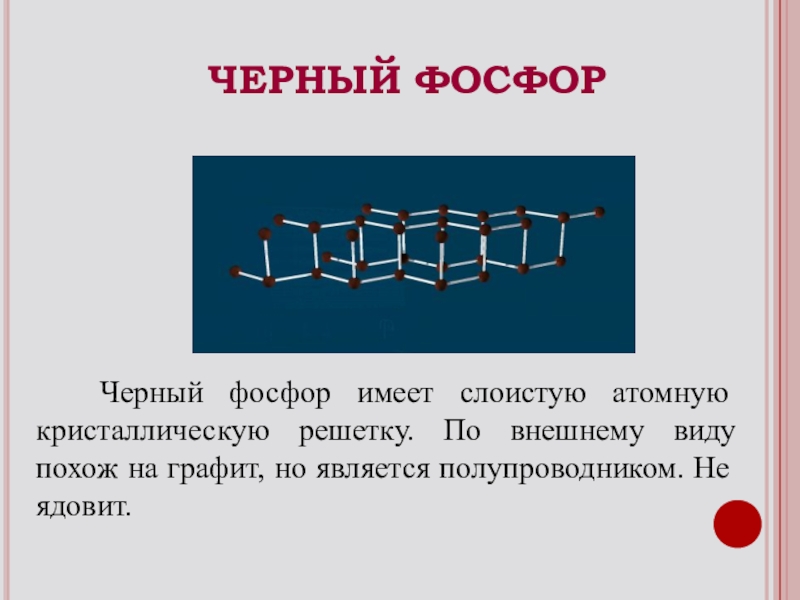
Слайд 10 Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему
ЧЕРНЫЙ ФОСФОР
Слайд 11С металлами:
C неметаллами:
3Сl2 + 2P = 2PCl3 PСl3 + Cl2 = PCl5
Со сложными веществами
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
4P + 16H2O = 4H3PO4 + 10H2
3Ca + 2P = Ca3P2
ХИМИЧЕСКИЕ СВОЙСТВА
2P + 3S = 2P2S3
Слайд 13
СОЕДИНЕНИЯ ФОСФОРА
Р2O5
HPO3
метафосфорная
кислота
H4P2O7
пирофосфорная
кислота
H3PO4
ортофосфорная
кислота
ФОСФАТЫ
Ca3(PO4)2
Р2O5
Р2O5
HPO3
метафосфорная
кислота
ГИДРОФОСФАТЫ
CaНPO4
H3PO4
ортофосфорная
кислота
ФОСФАТЫ
Ca3(PO4)2
ДИГИДРОФОСФАТЫ
Ca(Н2PO4)2
H4P2O7
пирофосфорная
кислота
Слайд 14ФИЗИЧЕСКИЕ СВОЙСТВА P2O5
Белый, рыхлый порошок, гигроскопичный. Хранят в герметически
Слайд 15ХИМИЧЕСКИЕ СВОЙСТВА P2O5
Проявляет свойства кислотного оксида.
1) реагирует с водой:
P2O5 + 3H2O t 2H3PO4
2) реагирует с основными оксидами:
P2O5 + 3К2O 2К3РО4
3) реагирует с основаниями:
P2O5 + 6NaOH 2Na3РО4 + 3H2O
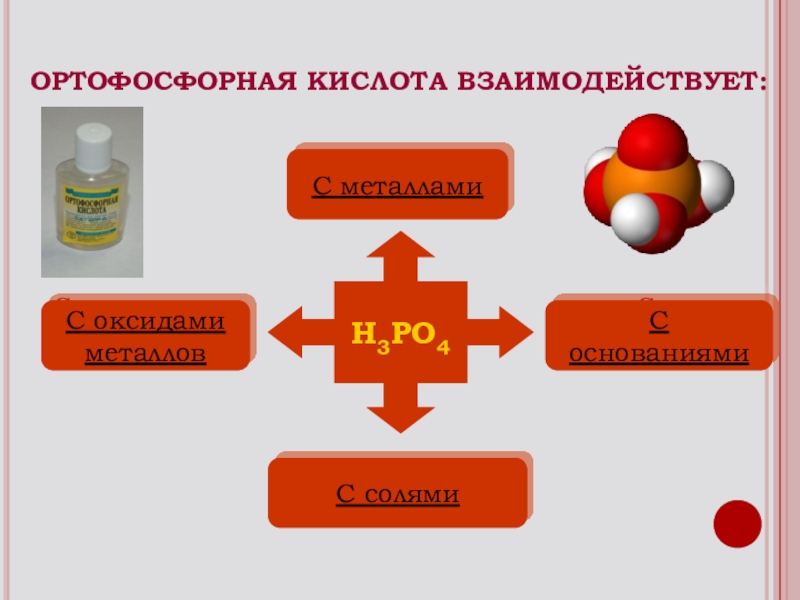
Слайд 16С металлами
С основаниями
С оксидами
металлов
С солями
H3PO4
ОРТОФОСФОРНАЯ КИСЛОТА ВЗАИМОДЕЙСТВУЕТ:
H3PO4
С оксидами
металлов
С солями
С металлами
С основаниями
Слайд 17 При комнатной температуре инертна. При повышенных температурах реагирует с
2H3PO4+3Mg =Mg3(PO4)2+3H2
С металлами
H3PO4
Слайд 18 При комнатной температуре инертна. При повышенных температурах реагирует с
2H3PO4+3CaO=Ca3(PO4)2+3H2O
H3PO4
С оксидами металлов
Слайд 19 Фосфорная кислота является относительно слабой кислотой. При её нейтрализации
H3PO4+ NaOH=NaH2PO4+ H2O
H3PO4
С основаниями
H3PO4+2NaOH=Na2HPO4+2H2O
Слайд 20 Фосфорная кислота может взаимодействовать с различными солями.
Фосфорную кислоту
2H3PO4+3Na2СO3=2Na3PO4+3СО2+3H2O
H3PO4
С солями
H3PO4+3AgNO3=Ag3PO4↓+3HNO3