- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Водород
Содержание
- 1. Презентация по химии на тему: Водород
- 2. План1. История открытия.2.Общая характеристика.3.Нахождение в природе.4. Получение.5.Физические свойства.6.Химические свойства.7. Применение.
- 3. История открытияВодород (в переводе с лытыни «рождающий воду»
- 4. История открытияВодород открыт в 1766 г. английским физико-химиком Г. Кавендишем при взаимодействии
- 5. Общая характеристика1.Символ элемента и порядковый номер;2. Ar3.Формула простого вещества;3. Mr4. Валентность.5. Свободный и связанный водород
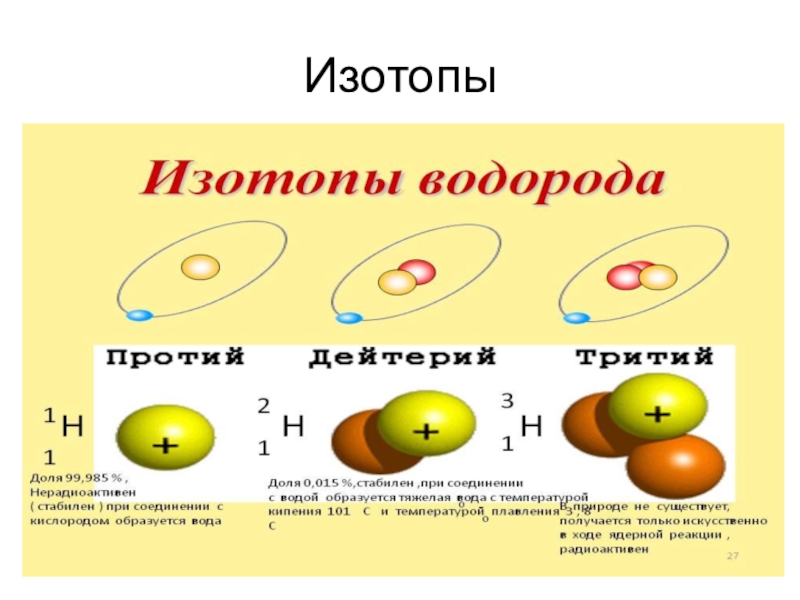
- 6. Изотопы
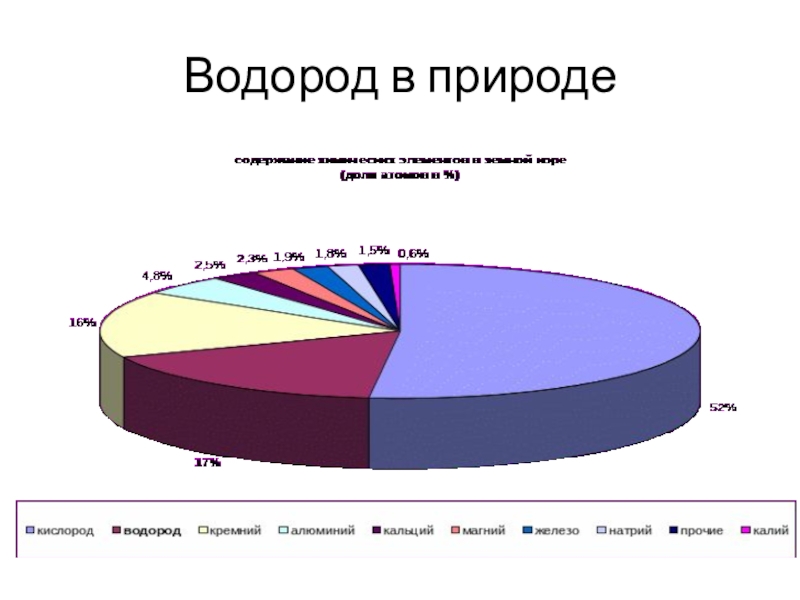
- 7. Водород в природе
- 8. Нахождение в природеВ земной коре массовая часть
- 9. Элемент космоса Вблизи Земли в свободном состоянии
- 10. Физические свойства Водород – газ, без цвета,
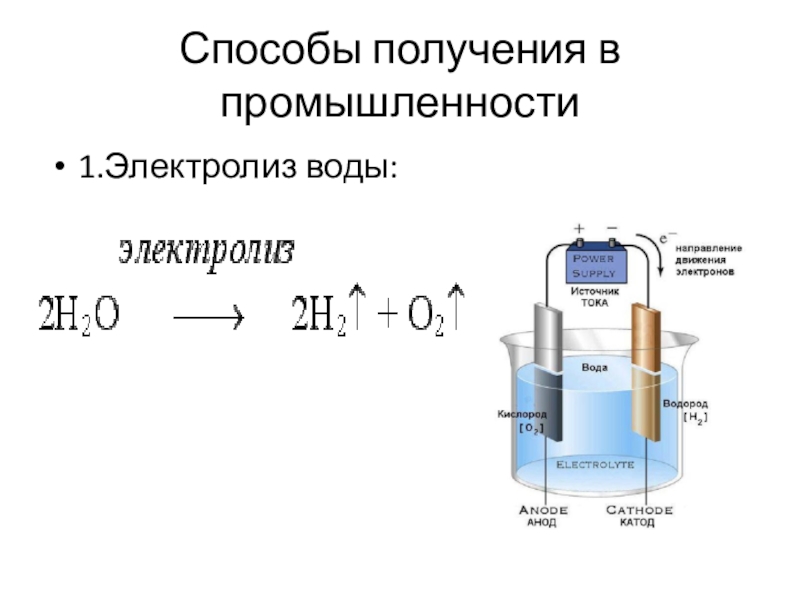
- 11. Способы получения в промышленности1.Электролиз воды:
- 12. Способы получения в промышленности
- 13. Способы получения в лаборатории
- 14. Реакции замещенияРеакции замещения - химические реакции, в которых
- 15. Аппарат Киппа и Кирюшкина
- 16. Аппарат Кирюшкина
- 17. Меры предосторожности при работе с водородом!!!!!Смеси водорода
- 18. Химические свойства1. Взаимодействие с простыми веществами:А) с кислородом (смесь водорода с кислородом при поджигании взрывается)
- 19. Химические свойстваБ) с серой (при нагревании)H2 +
- 20. Химические свойстваВзаимодействие с активными металлами (при нагревании)
- 21. Химические свойстваH2 + 2Na = 2NaH
- 22. Взаимодействие со сложными веществамиВосстанавливает металлы из их
- 23. ПрименениеСинтез хлороводорода.Восстановление металлов.Топливо в двигателях.Синтез аммиака. (минеральные
План1. История открытия.2.Общая характеристика.3.Нахождение в природе.4. Получение.5.Физические свойства.6.Химические свойства.7. Применение.
Слайд 2План
1. История открытия.
2.Общая характеристика.
3.Нахождение в природе.
4. Получение.
5.Физические свойства.
6.Химические свойства.
7. Применение.
Слайд 4История открытия
Водород открыт в 1766 г. английским физико-химиком Г. Кавендишем при взаимодействии цинка с кислотами он
наблюдал выделение газа, сгорающего на воздухе с образованием воды.
Слайд 5Общая характеристика
1.Символ элемента и порядковый номер;
2. Ar
3.Формула простого вещества;
3. Mr
4. Валентность.
5.
Свободный и связанный водород
Слайд 8Нахождение в природе
В земной коре массовая часть водорода составляет 1%. Однако
его соединения широко распространены, например вода. Водород входит в состав природного газа, нефти и всех органических веществ белки, жиры, углеводы, аминокислоты, и т.д.
Слайд 9Элемент космоса
Вблизи Земли в свободном состоянии водород встречается крайне редко,
на высоте 50 км его содержится 3% по объему, а на высоте 100 км примерно 95%. Водород, самый распространенный элемент во Вселенной. Он является главной составной частью Солнца, а также многих звезд и Галактик. Масса многих космических объектов почти наполовину состоят из водорода.
Слайд 10Физические свойства
Водород – газ, без цвета, вкуса и запаха.
Намного легче воздуха (в 14,5 раз).
В виду малой молекулярной массы это самый подвижный и самый легкоподвижный из газов.
Плохо растворим в воде.
t0 кипения = -2530 C
t0 плавления = -2590C
В виду малой молекулярной массы это самый подвижный и самый легкоподвижный из газов.
Плохо растворим в воде.
t0 кипения = -2530 C
t0 плавления = -2590C
Слайд 14Реакции замещения
Реакции замещения - химические реакции, в которых атомы или группы атомов
одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе.
Слайд 17Меры предосторожности при работе с водородом!!!!!
Смеси водорода с воздухом взрывоопасны!!!
Перед началом
работы водород необходимо проверить на чистоту: если раздается резкий «лающий» звук, водород содержит примесь воздуха, с ним работать нельзя. Глухой хлопок- чистота водорода достаточна, с ним можно работать.
Слайд 18Химические свойства
1. Взаимодействие с простыми веществами:
А) с кислородом (смесь водорода с
кислородом при поджигании взрывается)
Слайд 19Химические свойства
Б) с серой (при нагревании)
H2 + S = H2S↑
Образуется газ
с запахом тухлых яиц
в) с хлором (при нагревании)
H2 + Cl2 = 2HCl↑
г) С азотом (при температуре, давлении и с катализатором)
3H2 + N2 = 2NH3
в) с хлором (при нагревании)
H2 + Cl2 = 2HCl↑
г) С азотом (при температуре, давлении и с катализатором)
3H2 + N2 = 2NH3
Слайд 22Взаимодействие со сложными веществами
Восстанавливает металлы из их оксидов
МеО+ H2 = Mе
+ H2O (при нагревании)
Водород-восстановитель
Химические реакции оксидов металлов с водородом- реакции восстановления
Водород-восстановитель
Химические реакции оксидов металлов с водородом- реакции восстановления
Слайд 23Применение
Синтез хлороводорода.
Восстановление металлов.
Топливо в двигателях.
Синтез аммиака. (минеральные удобрения)
Получение маргарина.
Водородная сварка и
резка металлов.
Синтез метанола.
Наполнение воздушных шаров, дирижаблей.
9. Дейтерий лития – основной компонент заряда водородной бомбы.
Синтез метанола.
Наполнение воздушных шаров, дирижаблей.
9. Дейтерий лития – основной компонент заряда водородной бомбы.